
- •ВВЕДЕНИЕ
- •1. ОБЩИЕ СВЕДЕНИЯ О ДИСПЕРСНЫХ СИСТЕМАХ
- •1.1. Основные понятия и определения
- •1.3. Специфические особенности высокодисперсных систем
- •1.4. Классификации дисперсных систем
- •1.5. Методы получения дисперсных систем
- •1.5.1. Диспергационные методы
- •1.5.2. Конденсационные методы
- •1.5.3. Метод пептизации
- •1.6. Методы очистки дисперсных систем
- •1.7.1. Поверхностное натяжение
- •1.8. Поверхностно-активные вещества
- •1.9. Смачивание
- •1.10. Флотация
- •1.11. Строение коллоидных мицелл
- •1.12. Устойчивость и коагуляция дисперсных систем
- •2. НЕФТЯНЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ
- •2.2. Строение и свойства дисперсионной среды
- •2.3. Способы описания механических свойств
- •2.4. Виды локальных образований в нефтяных системах. Строение сложных структурных единиц
- •2.5. Виды межмолекулярных взаимодействий
- •2.6. Влияние межмолекулярных взаимодействий на свойства молекулярных растворов и НДС
- •2.7. Факторы, влияющие на устойчивость дисперсных систем. Методы определения и способы регулирования устойчивости НДС
- •2.9. Способы получения и регулирования свойств НДС. Нефтяные эмульсии
- •2.9.1. Классификация эмульсий
- •2.9.2. Методы получения эмульсий
- •2.9.3. Механизм образования эмульсий
- •2.9.4. Факторы, влияющие на устойчивость эмульсий
- •3. ХАРАКТЕРИСТИКА ОСНОВНЫХ СОЕДИНЕНИЙ НЕФТИ
- •3.1. Алканы
- •3.1.1. СТРОЕНИЕ АЛКАНОВ
- •3.1.2. НОМЕНКЛАТУРА АЛКАНОВ. Правила построения названий алканов по номенклатуре ИЮПАК
- •3.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА
- •3.1.4. Содержание алканов в нефтях
- •3.1.5. Теплофизические свойства
- •3.1.6. Газообразные алканы
- •3.1.7. Применение газов
- •3.1.8. Жидкие алканы
- •3.1.8.1. Углеводороды лёгких фракций нефти
- •3.1.8.2. Углеводороды средних фракций нефти
- •3.1.8.3. Изопреноидные углеводороды нефти
- •3.1.9. Твёрдые алканы
- •3.1.10. ХИМИЧЕСКИЕ СВОЙСТВА
- •3.2.2. Физические свойства циклоалканов
- •3.2.3. Химические свойства
- •3.3.2. СТРОЕНИЕ БЕНЗОЛА
- •3.3.3. Физические свойства аренов
- •3.3.4. ХИМИЧЕСКИЕ СВОЙСТВА аренов
- •3.3.5. Правило ориентации и реакционная способность
- •ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
- •Дисперсные системы
- •Нефтяные Дисперсные системы
- •ОБЩАЯ ХАРАКТЕРИСТИКА НЕФТИ. СОСТАВ НЕФТИ. ПЕРЕРАБОТКА НЕФТИ И ГАЗА
- •ФИЗИЧЕСКИЕ СВОЙСТВА НЕФТИ
- •ВЫВОДЫ
- •Библиографический список
- •Оглавление
- •ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
- •Введение
- •Содержание
vk.com/club152685050 | vk.com/id446425943
Для водных растворов различают несколько типов изотерм поверхностного натяжения.
Первый тип изотерм образуют поверхностно-
инактивные вещества (ПИВ), растворение которых не изменяет (кривая 2, рис. 4) или слегка повышает (кривая 1, рис. 4) величину поверхностного натяжения.
Второй тип изотерм образуют поверхностно-активные вещества (ПАВ), снижающие при растворении поверхностное натяжение (кривая 3, рис. 4).
Третий тип изотерм адсорбции образуют
мицеллообразующие (коллоидные) ПАВ, сильно снижающие поверхностное натяжение в области больших концентраций и практически не влияющие на его величину в области малых концентраций (кривая 4, рис. 4)
1.8. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА
Способность вещества при адсорбции на границе раздела фаз снижать поверхностное натяжение в зависимости от его концентрации в объеме называется поверхностной или межфазной активностью.
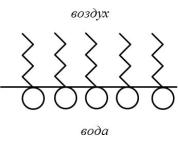
Признаком поверхностной активности молекул является их дифильность, т.е. наличие у них полярной (гидрофильной) и неполярной (гидрофобной) частей, которая удачно охарактеризована Гартли (одним из первых исследователей растворов поверхностно-активных веществ) как «раздвоение личности». Обычно полярную часть дифильной молекулы ПАВ изображают кружком, а неполярную часть – прямой или ломаной линией. Характерная особенность ПАВ состоит в адсорбции на границе раздела фаз (рис.5), при этом полярная
29
vk.com/club152685050 | vk.com/id446425943
часть погружается в полярную фазу (например, воду), а неполярная часть − в неполярную фазу (масло или воздух).
Рис. 5. Адсорбция молекул ПАВ на границе раздела фаз.
С увеличением длины неполярной гидрофобной цепи на одну группу CH2 поверхностная активность ПАВ увеличивается в 3-3,5 раза (правило Траубе). Для длиноцепочечных ПАВ (число атомов углерода в цепи 10-20) характерен оптимальный баланс гидрофильных и гидрофобных свойств.
По химической природе водорастворимые ПАВ делятся на катионактивные, анионактивные и неионогенные. При эмульгировании одной фазы в другой действует правило Банкрофта: дисперсионной средой становится та, в которой лучше растворимо поверхностно-активное вещество, следовательно, водорастворимые ПАВ – это стабилизаторы прямых эмульсий, а маслорастворимые ПАВ – это стабилизаторы обратных эмульсий.
Различают ПАВ синтетического и природного происхождения. Синтетические ПАВ входят в состав различных химических реагентов.
К природным ПАВ относят нефтяные кислоты, фенолы, смолы, асфальтены. Природные ПАВ являются стабилизаторами
30

vk.com/club152685050 | vk.com/id446425943
водно-нефтяных эмульсий. Они способствуют образованию структурно-механического барьера на поверхности глобул воды и препятствуют их коалесценции (слиянию), предшествующей разделению эмульсии на макрофазы. Механизм действия деэмульгаторов (специально синтезированных веществ, применяющихся для деэмульсации воднонефтяных эмульсий) заключается в вытеснении за счет более высокой поверхностной активности с поверхности глобул воды молекул природных ПАВ и разрушении структурно-механического барьера.
При малых концентрациях ПАВ образуют истинные растворы, диспергируясь до отдельных молекул или ионов. С ростом концентрации происходит их самоассоциация в растворе с образованием мицелл (термин введен в 1913 г. Мак Беном). Мицеллы характеризуют числом агрегации, т.е. числом молекул в мицелле, (обычно 50-100 молекул ПАВ в воде образуют мицеллы) и мицеллярной массой (сумма молекулярных масс, образующих мицеллу). Число агрегации в обратных мицеллах оказывается значительно ниже, чем в прямых мицеллах (рис. 6).
Рис. 6. Типы мицелл.
Образование мицелл происходит при кооперативном связывании между собой молекул ПАВ в узком интервале
31

vk.com/club152685050 | vk.com/id446425943
концентраций, превышающих критическую концентрацию (ККМ). В результате мицеллообразования резко изменяется ряд свойств раствора (рис.7). Как известно, по мере увеличения концентрации ПАВ происходят фазовые превращения истинного раствора в мицеллярную вначале жидкоподобную систему с резким скачкообразным изменением физикохимических свойств вплоть до формирования по мере роста концентрации ПАВ твердообразной концентрированной дисперсии. В результате подобных концентрационных исследований в классической коллоидной химии по величине концентрации ПАВ, при которой происходит характер изменения ряда свойств раствора, определяют величину ККМ различных ПАВ в жидких средах.
Рис. 7. Схематическая зависимость электропроводности (λ) и поверхностного натяжения (σ) растворов ПАВ от концентрации последнего.
32
