
- •ВВЕДЕНИЕ
- •1. ОБЩИЕ СВЕДЕНИЯ О ДИСПЕРСНЫХ СИСТЕМАХ
- •1.1. Основные понятия и определения
- •1.3. Специфические особенности высокодисперсных систем
- •1.4. Классификации дисперсных систем
- •1.5. Методы получения дисперсных систем
- •1.5.1. Диспергационные методы
- •1.5.2. Конденсационные методы
- •1.5.3. Метод пептизации
- •1.6. Методы очистки дисперсных систем
- •1.7.1. Поверхностное натяжение
- •1.8. Поверхностно-активные вещества
- •1.9. Смачивание
- •1.10. Флотация
- •1.11. Строение коллоидных мицелл
- •1.12. Устойчивость и коагуляция дисперсных систем
- •2. НЕФТЯНЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ
- •2.2. Строение и свойства дисперсионной среды
- •2.3. Способы описания механических свойств
- •2.4. Виды локальных образований в нефтяных системах. Строение сложных структурных единиц
- •2.5. Виды межмолекулярных взаимодействий
- •2.6. Влияние межмолекулярных взаимодействий на свойства молекулярных растворов и НДС
- •2.7. Факторы, влияющие на устойчивость дисперсных систем. Методы определения и способы регулирования устойчивости НДС
- •2.9. Способы получения и регулирования свойств НДС. Нефтяные эмульсии
- •2.9.1. Классификация эмульсий
- •2.9.2. Методы получения эмульсий
- •2.9.3. Механизм образования эмульсий
- •2.9.4. Факторы, влияющие на устойчивость эмульсий
- •3. ХАРАКТЕРИСТИКА ОСНОВНЫХ СОЕДИНЕНИЙ НЕФТИ
- •3.1. Алканы
- •3.1.1. СТРОЕНИЕ АЛКАНОВ
- •3.1.2. НОМЕНКЛАТУРА АЛКАНОВ. Правила построения названий алканов по номенклатуре ИЮПАК
- •3.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА
- •3.1.4. Содержание алканов в нефтях
- •3.1.5. Теплофизические свойства
- •3.1.6. Газообразные алканы
- •3.1.7. Применение газов
- •3.1.8. Жидкие алканы
- •3.1.8.1. Углеводороды лёгких фракций нефти
- •3.1.8.2. Углеводороды средних фракций нефти
- •3.1.8.3. Изопреноидные углеводороды нефти
- •3.1.9. Твёрдые алканы
- •3.1.10. ХИМИЧЕСКИЕ СВОЙСТВА
- •3.2.2. Физические свойства циклоалканов
- •3.2.3. Химические свойства
- •3.3.2. СТРОЕНИЕ БЕНЗОЛА
- •3.3.3. Физические свойства аренов
- •3.3.4. ХИМИЧЕСКИЕ СВОЙСТВА аренов
- •3.3.5. Правило ориентации и реакционная способность
- •ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
- •Дисперсные системы
- •Нефтяные Дисперсные системы
- •ОБЩАЯ ХАРАКТЕРИСТИКА НЕФТИ. СОСТАВ НЕФТИ. ПЕРЕРАБОТКА НЕФТИ И ГАЗА
- •ФИЗИЧЕСКИЕ СВОЙСТВА НЕФТИ
- •ВЫВОДЫ
- •Библиографический список
- •Оглавление
- •ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
- •Введение
- •Содержание
vk.com/club152685050 | vk.com/id446425943
распределением подобных структур в растительных и животных тканях.
В высококипящих нефтяных фракциях обнаружены арены с четырьмя конденсированными кольцами — пирен (VIII), хризен (IX), 1,2-бензантрацен (X), 3,4-бензфенантрен (XI). Гибридные углеводороды могут содержать 1-3 ароматических и несколько насыщенных колец. Имеются сообщения об идентификации алкилпроизводных аренов с 5-7 конденсированными ароматическими циклами: перилена (XI), 1,12-бензперилена (XII), коронена (XIII). С увеличением числа конденсированных колец содержание аренов в нефтях уменьшается.
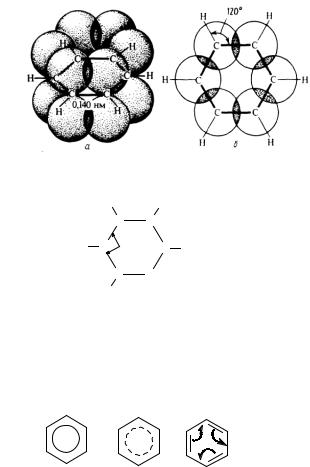
3.3.2. СТРОЕНИЕ БЕНЗОЛА
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1865 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряжёнными связями (чередуются простые и двойные связи) – циклогексатриен-1,3,5:
H
H С С С H
H С С С H H
С С H H
Согласно современным представлениям молекула бензола имеет строение плоского шестиугольника, стороны которого равны между собой и составляют 0,140 нм. Это расстояние является средним между длинами одинарной (0,154нм) и двойной (0,134нм) связей. В одной плоскости с кольцом лежат и шесть связей С–Н, каждая из которых образует с ребром шестиугольника угол, равный 120°. Каждый
184
vk.com/club152685050 | vk.com/id446425943
углеродный атом в молекуле бензола находится в состоянии sр2- гибридизации. Он связан тремя своими гибридными орбиталями с двумя соседними атомами углерода и одним атомом водорода, образуя три σ - связи. Четвертая – негибридизованная 2рорбиталь атома углерода, ось которой перпендикулярна плоскости бензольного кольца, перекрывается с 2р-орбиталями двух соседних углеродных атомов.
Рис.8. Взаимное перекрывание 2р-орбиталей в молекуле бензола
Н0,140 нм Н
СС
Н С 0 |
С Н |
. |
120 |
0,109 нм |
СС
Н Н
Н
Внастоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Практически это и невозможно сделать. Но чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к помощи следующих формул:
.
185
vk.com/club152685050 | vk.com/id446425943
Главной особенностью ароматических углеводородов является равномерное распределение π-электронной плотности в молекуле. Единая устойчивая замкнутая система π-электронов в циклической молекуле – основной признак ароматичности. Необходимым условием для такой делокализации π-электронов является строгая параллельность осей 2р-орбиталей, участвующих в образовании замкнутой π-электронной системы. Поэтому молекулы ароматических соединений обязательно имеют плоское строение. Если же это условие не выполняется, то круговое сопряжение π-электронов нарушается, как например, в молекуле циклооктатетраена. В результате это соединение не является ароматическим.
Для ароматических соединений характерно также определенное число π-электронов в молекуле. Немецкий химиктеоретик Э. Хюккель вывел правило (1931 г.): плоские циклические соединения, имеющие сопряженную систему π- электронов, могут быть ароматическими, если число этих электронов равно 4n+2 (где п = 0, 1, 2, 3 и т.д.). Другими словами, в ароматических соединениях может содержаться 2, 6, 10, 14 π-электронов и т.д. Это правило строго выполняется только для моноциклических соединений.
3.3.3. ФИЗИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Арены имеют значительно более высокую плотность и показатель преломления, чем алканы и циклоалканы.
Вязкость и плотность алкилбензолов возрастает с увеличением числа метильных групп, а индекс вязкости снижается. Плотность полиметилпроизводных бензола также выше, чем алкилбензолов с тем же числом углеродных атомов,
186
vk.com/club152685050 | vk.com/id446425943
что объясняется их повышенным межмолекулярным взаимодействием.
Арены обладают высокой детонационной стойкостью— высокими октановыми числами. Увеличение молекулярной массы аренов незначительно влияет на их детонационную стойкость. Наличие метильных групп в мета- и параположениях приводит к повышению октановых чисел, а в ортоположении — к их снижению.
Арены характеризуются наихудшей воспламеняемостью, низкими значениями цетановых чисел. Так, цетановое число 1- метилнафталина равно нулю. Поэтому топлива с высоким содержанием аренов в быстроходных дизелях не применяют.
Вследствие способности аренов к специфическим взаимодействиям их молекулы ассоциированы друг с другом в результате образования водородных связей или с гетероатомными соединениями нефти вследствие образования π-комплексов. Полициклические арены способны к образованию иглоподобных или пластинчатых структурных элементов. Образующиеся надмолекулярные структуры отличаются от изотропной массы большими упорядоченностью, плотностью, меньшей растворимостью в растворителях.
3.3.4. ХИМИЧЕСКИЕ СВОЙСТВА АРЕНОВ
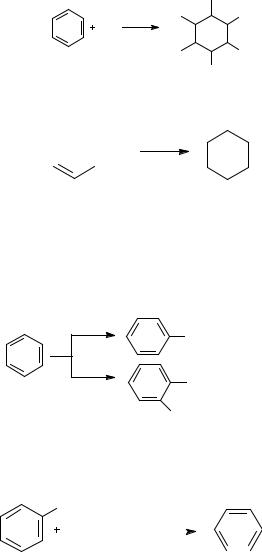
Реакции присоединения. Арены вступают в реакции присоединения с большим трудом. Для этого требуются высокие температуры, ультрафиолетовое облучение и катализаторы. К ним относятся:
Галогенирование:
187
vk.com/club152685050 | vk.com/id446425943
|
|
|
Cl |
3Cl |
УФ |
Cl |
Cl |
|
|
||
|
2 40-600 |
|
|
|
|
Cl |
Cl |
|
|
|
Cl |
Гексахлоран используется в качестве инсектицида.
Гидрирование:
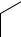

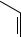
 3H2 200Ni -2300
3H2 200Ni -2300
Реакции замещения наиболее характерны для аренов. Они протекают в сравнительно мягких условиях. Особенно легко вступают в реакции замещения гомологи бензола.
Галоидирование. В зависимости от условий галоидирования можно получить продукты различной степени замещения:
40-600 |
Cl хлорбензол |
|
Cl2 Fe |
||
|
||
40-600 |
Cl |
|
AlCl3 |
||
о-дихлорбензол |
||
|
||
|
Cl |
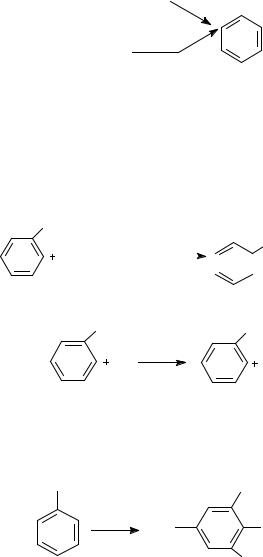
Сульфирование. Концентрированная серная кислота легко замещает водород на остаток серной кислоты с образованием сульфокислоты.
H
HO |
|
SO3H |
|
|
|
|
|
SO3H |
|
H2O |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
|
|
|
бензолсульфокислота |
|||||||
188
vk.com/club152685050 | vk.com/id446425943
C H SO |
H 2NaOH |
|
OH |
|||
|
||||||
6 |
5 |
3 |
NA |
SO |
|
|
|
|
|
|
|
||
|
|
|
2 |
3 |
|
|
C6H5Cl NaOH
Из бензолсульфокислоты и хлорбензола сплавлением их со щёлочью получают фенол.
Основная область применения фенола - производство фенолформальдегидных смол.
Нитрование. При действии на бензол смесью концентрированных азотной и серной кислот получается нитробензол:
H
HO |
|
NO2 |
|
|
|
H2SO4 |
|
|
|
|
|
|
|
NO2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2O |
|
|
|
H2SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Восстановлением нитробензола получают анилин:
NO2 |
NH2 |
3H2 |
2H2O |
Большая часть анилина используется для производства полиуретановых пенопластов.
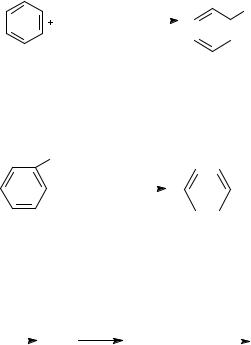
При полном нитровании толуола получают взрывчатое вещество тротил (2,4,6-тринитротолуол):
CH3 |
|
NO2 |
|
HNO3 |
NO2 |
CH3 |
|
H2SO4 |
|||
|
|
||
|
|
NO2 |
189
vk.com/club152685050 | vk.com/id446425943
Алкилирование. В присутствии таких катализаторов как АlCl3, HF, H2SO4, HCl, BF3 арены вступают в реакцию алкилирования с алкенами, спиртами, галоидзамещёнными алканами. Таким способом в промышленности получают этилбензол и изопропилбензол:
CH2 |
|
|
CH2 |
AlCl3,HCl |
|
|
|
CH2 |
|
CH3 |
|
|
|
|
|
|
|||||
|
|
0 |
|
|
|
|
|
|
||
|
|
|
|
90-100 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Каталитическим дегидрированием из этилбензола получают стирол, а из изопропилбензола - α-метилстирол - ценные мономеры, используемые в производстве каучуков и пластмасс:
CH2 |
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
600-6300 |
|
|
|
|
|
|
CH |
|
|
CH2 |
|||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Fe2O3+ Cr2O3+Na OH |
||||||||||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Алкилированием бензола хлоралканами и дальнейшим сульфированием и нейтрализацией образующихся продуктов получают алкиларилсульфонаты - синтетические поверхностноактивные вещества. Эти вещества с некоторыми добавками называют сульфонолами:
C6H6 |
RCl |
RC6H5H2SO4 |
RC6H4SO2OH |
NaOH |
RC6H4SO2ONa |
|
HCl |
H2O |
|||||
|
H2O |
|
|
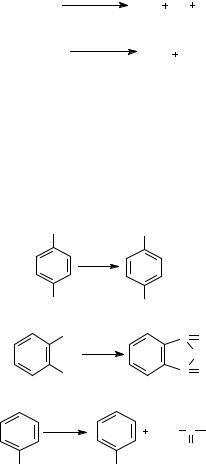
Деалкилирование и гидродеалкилирование. В связи с тем,
что наибольшее значение имеет бензол, его в настоящее время получают деалкилированием или гидродеалкилированием толуола:
190
vk.com/club152685050 | vk.com/id446425943
C6H5CH3 375Ni0, H2O C6H6 CO 2H2
Mo, Co, Cr |
C6H6 CH4 |
C6H5CH3 6000 |
Окисление. Арены (кроме бензола, нафталина и других голоядерных гомологов) легко вступают в реакции окисления. В ряду алкилпроизводных аренов устойчивость к окислению падает с увеличением длины и степени разветвления боковой цепи. При этом образуются кислые соединения. Эти свойства аренов широко используются в промышленности для получения кислородсодержащих производных:
CH3 |
|
|
COOH |
|
|
O2 |
|
|
|
кат-р |
|
|
|
|
CH3 |
|
|
COOH |
|
п-ксилол |
терефталевая кислота |
|||
CH3 |
О2 |
|
C |
O |
|
|
O |
||
кат-р |
|
|||
|
C |
O |
||
CH3 |
|
|
||
о-ксилол |
|
фталевый ангидрид |
||
O2 |
|
|
CH3 C |
CH3 |
1200,Cu |
|
|
||
|
|
O |
|
|
CH(CH3)2 |
|
OH |
ацетон |
|
|
|
|
||
|
фенол |
|
|
|
С целью получения терефталевой кислоты разработаны также различные процессы окисления толуола. Наиболее устойчивыми к окислению кислородом воздуха являются бензол и нафталин. Однако и они в очень жёстких условиях (высокая
191
vk.com/club152685050 | vk.com/id446425943
температура, катализатор) окисляются с разрывом бензольного кольца:
O2 |
|
C O |
|
|
|
O |
|
||
V O |
,400-4500 |
|
||
C |
|
|||
2 5 |
|
|
|
|
|
|
|
O |
|
|
|
малеиновый ангидрид |
|
|
|
O2 |
|
C O |
. |
|
|
O |
||
|
|
|
||
 V2O5
V2O5 
 C
C O
O
фталевый ангидрид
Терефталевая кислота - полупродукт для производства синтетического полиэфирного волокна - лавсана (терилена). Фталевый ангидрид применяется для производства алкидных и полиэфирных смол, пластификаторов, репеллентов. Малеиновый ангидрид используется в производстве полиэфирных смол и присадок к смазочным маслам.
Реакции с участием боковых цепей алкилбензолов.
Ароматическое кольцо оказывает влияние на реакционную способность боковых цепей в алкилбензолах, активируя связь С- Н в соседнем с ароматическим кольцом бензильномположении. Обычно эти реакции носят свободнорадикальный характер и протекают через промежуточное образование стабильных радикалов бензильного типа.
Галогенирование
Толуол хлорируется на свету или в присутствии перекисей только по метильной группе с образованием первоначально бензилхлорида, и затем бензальхлорида и бензотрихлорида:
192
