
- •ВВЕДЕНИЕ
- •1. ОБЩИЕ СВЕДЕНИЯ О ДИСПЕРСНЫХ СИСТЕМАХ
- •1.1. Основные понятия и определения
- •1.3. Специфические особенности высокодисперсных систем
- •1.4. Классификации дисперсных систем
- •1.5. Методы получения дисперсных систем
- •1.5.1. Диспергационные методы
- •1.5.2. Конденсационные методы
- •1.5.3. Метод пептизации
- •1.6. Методы очистки дисперсных систем
- •1.7.1. Поверхностное натяжение
- •1.8. Поверхностно-активные вещества
- •1.9. Смачивание
- •1.10. Флотация
- •1.11. Строение коллоидных мицелл
- •1.12. Устойчивость и коагуляция дисперсных систем
- •2. НЕФТЯНЫЕ ДИСПЕРСНЫЕ СИСТЕМЫ
- •2.2. Строение и свойства дисперсионной среды
- •2.3. Способы описания механических свойств
- •2.4. Виды локальных образований в нефтяных системах. Строение сложных структурных единиц
- •2.5. Виды межмолекулярных взаимодействий
- •2.6. Влияние межмолекулярных взаимодействий на свойства молекулярных растворов и НДС
- •2.7. Факторы, влияющие на устойчивость дисперсных систем. Методы определения и способы регулирования устойчивости НДС
- •2.9. Способы получения и регулирования свойств НДС. Нефтяные эмульсии
- •2.9.1. Классификация эмульсий
- •2.9.2. Методы получения эмульсий
- •2.9.3. Механизм образования эмульсий
- •2.9.4. Факторы, влияющие на устойчивость эмульсий
- •3. ХАРАКТЕРИСТИКА ОСНОВНЫХ СОЕДИНЕНИЙ НЕФТИ
- •3.1. Алканы
- •3.1.1. СТРОЕНИЕ АЛКАНОВ
- •3.1.2. НОМЕНКЛАТУРА АЛКАНОВ. Правила построения названий алканов по номенклатуре ИЮПАК
- •3.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА
- •3.1.4. Содержание алканов в нефтях
- •3.1.5. Теплофизические свойства
- •3.1.6. Газообразные алканы
- •3.1.7. Применение газов
- •3.1.8. Жидкие алканы
- •3.1.8.1. Углеводороды лёгких фракций нефти
- •3.1.8.2. Углеводороды средних фракций нефти
- •3.1.8.3. Изопреноидные углеводороды нефти
- •3.1.9. Твёрдые алканы
- •3.1.10. ХИМИЧЕСКИЕ СВОЙСТВА
- •3.2.2. Физические свойства циклоалканов
- •3.2.3. Химические свойства
- •3.3.2. СТРОЕНИЕ БЕНЗОЛА
- •3.3.3. Физические свойства аренов
- •3.3.4. ХИМИЧЕСКИЕ СВОЙСТВА аренов
- •3.3.5. Правило ориентации и реакционная способность
- •ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
- •Дисперсные системы
- •Нефтяные Дисперсные системы
- •ОБЩАЯ ХАРАКТЕРИСТИКА НЕФТИ. СОСТАВ НЕФТИ. ПЕРЕРАБОТКА НЕФТИ И ГАЗА
- •ФИЗИЧЕСКИЕ СВОЙСТВА НЕФТИ
- •ВЫВОДЫ
- •Библиографический список
- •Оглавление
- •ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ
- •Введение
- •Содержание
vk.com/club152685050 | vk.com/id446425943
молекул, находящихся внутри фазы по своему энергетическому состоянию, что приводит к возникновению избыточной поверхностной энергии. Избыточная поверхностная энергия равна произведению поверхностного натяжения на площадь межфазной поверхности. = ∙
Любая термодинамическая система стремится уменьшить свою поверхностную энергию. Избыточная поверхностная энергия может уменьшиться за счет:
•уменьшения поверхностного натяжения: адсорбция, адгезия, смачивание, образование двойного электрического слоя;
•уменьшения площади поверхности: сферическая форма капель (сглаживание поверхности), объединение частиц (коагуляция, агрегация, коалесценция).
1.7.1. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ
Физический смысл поверхностного натяжения
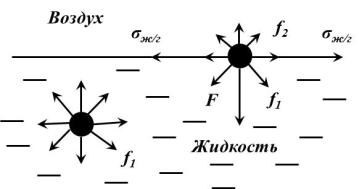
Изобразим границу раздела жидкости с ее собственным паром (рис.2). На молекулу, находящуюся внутри жидкости, действуют силы взаимного притяжения (силы молекулярного сцепления) со стороны всех окружающих ее соседних молекул. Равнодействующая этих сил равна нулю вследствие симметрии силового поля, и для перемещения молекулы внутри жидкости не требуется затрачивать работу. Это вызвано тем, что в газообразной фазе молекулы удалены друг от друга на большие расстояния, и молекулы, находящиеся на границе раздела фаз, испытывают действие межмолекулярных сил в большей степени со стороны жидкой фазы f1, чем со стороны газообразной f2
21
vk.com/club152685050 | vk.com/id446425943
(f1>>f2). Результирующая сила Р, пропорциональной разности сил (f1- f2), направлена внутрь жидкости. Эта сила, отнесенная к единице поверхности (1 м2 или 1 см2), называется внутренним
(молекулярным) давлением p .
= M = 1 − 2
Молекулярное давление определяется силой сцепления молекул, оно тем выше, чем полярнее вещество. Таким образом, на поверхности любой жидкости существует огромное давление, стремящееся затянуть все молекулы с поверхности внутрь жидкой фазы. Этим объясняется шарообразная форма капель жидкости.
Рис.2. Межмолекулярное взаимодействие внутри жидкости и на поверхности раздела фаз.
Молекулярные силы стремятся втянуть молекулы поверхностного слоя внутрь фазы. Поэтому, для образования новой поверхности необходимо затратить некоторую работу против сил молекулярного притяжения.
22

vk.com/club152685050 | vk.com/id446425943
Поверхностное натяжение (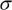 ) – работа обратимого изотермического процесса, затраченная на образование единицы
) – работа обратимого изотермического процесса, затраченная на образование единицы
площади поверхности раздела фаз (энергетическое определение |
||
поверхностного натяжения): |
равн |
|
= − |
|
, |
Знак минус говорит о том, что положительная работа совершается при уменьшении или сокращении поверхности.
Силовое определение: поверхностное натяжение –
сила, направленная тангенциально (параллельно) к поверхности и приходящаяся на единицу длины периметра, ограничивающего эту поверхность.
Физическая сущность – поверхностные молекулы стремятся уйти вглубь конденсированной фазы, тем самым, сжимая поверхность.
Оба эти определения необходимо рассматривать в единстве. Такое единство энергетического и силового подходов сложилось исторически.
Величина поверхностного натяжения была введена в
физику задолго до появления понятия энергии и рассматривалась как сила, стягивающая гипотетическую пленку на поверхности жидкости и противодействующая ее растяжению. Силовое определение более справедливо для жидкостей, так как у них одновременно с образованием поверхности молекулы и атомы на ней ориентируются, уплотняются, переходя в равновесное состояние и вызывая тем самым тангенциальное натяжение поверхности.
23
vk.com/club152685050 | vk.com/id446425943
Термодинамическое определение поверхностного натяжения
При p и Т = const запишем объединенное уравнение первого и второго начал термодинамики для гетерогенной
системы относительно изменения энергии Гиббса:
= − + + + +
где T – температура, S - энтропия, p – давление, V – объем, s – площадь поверхности, σ – количество электричества.
= |
|
При постоянных T, p, ni и q имеем: |
|
|
, , , |
Поверхностное натяжение есть частная производная от энергии Гиббса по площади поверхности раздела фаз при постоянных: давлении, температуре, числе моль компонентов и заряде.
Так как объединенное уравнение первого и второго начал термодинамики может быть записано и относительно других термодинамических потенциалов, а именно внутренней
энергии U, энергии |
Гельмгольца |
А и |
энтальпии H, то при |
|
|
|
|
|
|
соответствующих постоянных параметрах получим: |
, , |
|||
= , , = , , = |
, , = |
|||
Поверхностное натяжение – частная производная от термодинамического потенциала, являющегося функцией состояния при данных условиях, по площади поверхности раздела фаз при постоянных соответствующих параметрах.
24
vk.com/club152685050 | vk.com/id446425943
Единицы измерения поверхностного натяжения
Энергетическому и силовому определению поверхностного натяжения соответствует энергетическая и силовая единица измерения.
Энергетической единицей является Дж/м2, силовой – Н/м. Энергетическое и силовое выражение эквивалентны, и численная величина совпадает в обеих размерностях. Так для
Дж
воды при 293 К:
2 = 72,75 ∙ 10−3 м2 = 72,75 ∙ 10−3Н/м
Влияние различных факторов на величину поверхностного натяжения
Влияние химической природы вещества
Поверхностное натяжение – работа, затрачиваемая на разрыв межмолекулярных связей. Поэтому, чем сильнее межмолекулярные связи в данном теле, тем больше его поверхностное натяжение на границе с газовой фазой. Следовательно, поверхностное натяжение меньше у неполярных жидкостей, имеющих слабые межмолекулярные связи, и больше у полярных жидкостей. Большим поверхностным натяжением обладают вещества, имеющие межмолекулярные водородные связи, например вода.
Таблица 2. Значения поверхностного натяжения и удельной поверхностной энергии некоторых веществ на границе с воздухом
Вещество |
Т, К |
σ·103Дж/м2 |
Вещество |
Т, К |
σ·103Дж/м2 |
Гелий (ж) |
3 |
0,22 |
Серебро (ж) |
1273 |
920 |
Бензол |
298 |
28,2 |
*Серебро (т) |
1023 |
1140 |
|
|
|
|
|
|
25
vk.com/club152685050 | vk.com/id446425943
Вещество |
Т, К |
σ·103Дж/м2 |
Вещество |
Т, К |
σ·103Дж/м2 |
|
Муравьиная |
298 |
36,3 |
*Железо (т) |
298 |
3959 |
|
к-та |
||||||
|
|
|
|
|
||
Вода |
298 |
71,96 |
*Вольфрам (т) |
298 |
6814 |
|
|
|
|
|
|
|
|
Ртуть |
298 |
473,5 |
*Алмаз |
298 |
11400 |
* – приведены значения удельной поверхностной энергии
Влияние температуры
С ростом температуры расстояние между молекулами увеличивается, с увеличением температуры поверхностное натяжение индивидуальных жидкостей уменьшается, то есть
выполняется соотношение: < 0
Для многих жидкостей зависимость σ=f(T) близка к линейной. Экстраполяция линейной зависимости к оси абсцисс определяет критическую температуру ТС данного вещества. При этой температуре двухфазная система жидкость – пар перестает существовать и становится однофазной.
Рис. 3. Влияние температуры на величину поверхностного натяжения
26
vk.com/club152685050 | vk.com/id446425943
Для большинства неполярных жидкостей зависимость поверхностного натяжения от температуры выражается
уравнением: |
= 0 − ∆ |
|
где σT – поверхностное натяжение при любой температуре, σ0 – поверхностное натяжение при стандартной температуре, Т – разность между данной и стандартной температурой, α –
= −
температурный коэффициент поверхностного натяжения:
Для многих веществ температурные коэффициенты поверхностного натяжения составляют примерно от –0,1 до –0,2 мДж/(м2К).
Влияние природы граничащих фаз
Поверхностное натяжение (σ12) на границе двух жидкостей 1 и 2 зависит от их химической природы (полярности).
Таблица 3. Межфазное натяжение (σ12) на границе воды (εH2O = 81) с жидкими органическими веществами
Вещество |
ε |
σ12, мДж/м2 |
Бензол |
2,27 |
34,4 |
Хлороформ |
4,72 |
33,8 |
Анилин |
35,97 |
4,8 |
Крезол |
42,4 |
3,9 |
Из таблицы 3 следует, что чем больше разность полярностей жидкостей, тем больше поверхностное натяжение на границе их раздела (правило Ребиндера).
27
vk.com/club152685050 | vk.com/id446425943
Количественно межфазное поверхностное натяжение на границе двух взаимно насыщенных жидкостей можно рассчитать по приближенному правилу Антонова.
Правило Антонова (1907): Если жидкости ограниченно растворимы друг в друге, то поверхностное натяжение на границе ж1/ж2 равно разности между поверхностными
натяжениями взаимно насыщенных жидкостей на границе их с воздухом или с их собственным= паром−:
ж1/ж2 ж1/Г ж2/Г
Влияние природы и концентрации растворенного вещества
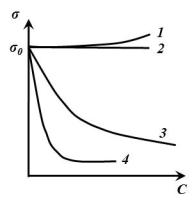
Поверхностное натяжение растворов отличается от поверхностного натяжения чистого растворителя ζ0. Зависимость поверхностного натяжения от концентрации растворенного вещества при Т=const называют изотермой поверхностного натяжения.
Рис. 4. Изотермы поверхностного натяжения: 1 и 2 – ПИВ; 3 – ПАВ; 4
– мицеллообразующие ПАВ
28
