
- •Предисловие
- •Введение
- •Глава 1. Классификация и критерии конструирования композиционных материалов
- •1.1. Что такое композит?
- •1.2. Классификация композиционных материалов
- •1.3. Критерии конструирования композита
- •1.4. Свойства некоторых современных композиционных материалов
- •Глава 2. Периодическая таблица Менделеева. Электронное строение элементов, типы связей и свойства веществ
- •2.1. Периодический закон д.И. Менделеева и свойства элементов
- •2.2. Электронная структура и типы связей элементов и соединений
- •Глава 3. Фазовые переходы и их влияние на структуру и свойства материалов
- •3.1. Основные виды фазовых диаграмм двухкомпонентных систем
- •3.2. Фазовые превращения металлических структур
- •3.2.1. Полиморфные превращения
- •3.2.2. Условия образования и виды твердых растворов
- •3.3. Влияние на фазовые переходы внешних полей и размеров компонентов композита
- •Глава 4. Физико-химические свойства основных компонентов композитов
- •4.1. Металлы
- •4.2. Полупроводники
- •4.3. Полимеры
- •4.4. Жидкие кристаллы
- •4.5. Стекла
- •4.6. Керамики
- •4.7. Основные группы композиционных материалов
- •Глава 5. Термодинамика композиционных систем с границами раздела
- •5.1. Предмет термодинамики. Основные законы классической термодинамики и термодинамические функции состояния системы
- •5.2. Термодинамика систем с поверхностями раздела
- •5.2.1.Обобщенное уравнение термодинамики для систем с поверхностями раздела
- •5.2.2. Термодинамические функции для систем с межфазными границами раздела
- •5.2.3. Условие равновесия на фазовой границе с ненулевой кривизной. Формула Лапласа
- •5.2.4. Поверхностное натяжение и специальные границы
- •5.3. Пути развития термодинамики: от равновесной к неравновесной нелинейной
- •Глава 6. Межфазное взаимодействие, совместимость компонентов, стабильность границы и прочность композита
- •6.1. Совместимость компонентов композита
- •6.1.1. Химическая совместимость компонентов
- •6.1.2. Основные термодинамические представления о совместимости материалов
- •6.1.3. Влияние легирующих добавок на стабильность волокнистого композита
- •6.2. Классификация композитов на основе межфазного взаимодействия
- •6.3. Типы связей и стабильность границы раздела композита
- •6.3.1. Типы связей на границе раздела между компонентами композита
- •6.3.2. Термическая и механическая стабильность поверхности раздела композита
- •6.3.3. Прочность границы и характер разрушения композита
- •Глава 7. Физические свойства композитов. Упругие и прочностные свойства
- •7.1. Общее определение физических свойств композита. Х-y-эффект
- •7.2. Упругие свойства композиционных материалов
- •7.2.1. Упругие свойства композита, армированного непрерывными волокнами
- •7.2.2. Упругие свойства порошковых композитов
- •7.3. Прочность композиционных материалов
- •7.3.1. Прочность композита, армированного непрерывными волокнами
- •Влияние ориентации волокон на разрушение композита.
- •7.3.2. Прочность при растяжении композита, армированного дискретными волокнами.
- •7.3.3. Вязкость разрушения композита
- •Глава 8. Адгезия и смачивание в композитах
- •8.1. Основные определения
- •8.2. Формирование межфазного контакта. Уравнения Дюпре и Юнга
- •8.3. Адгезия композиционных материалов
- •8.3.1. Взаимодействие контактирующих поверхностей при адгезии и прочность соединений
- •8.3.2. Адгезионная прочность на поверхности раздела и механические свойства композитов
- •8.4. Смачивание композиционных материалов
- •8.4.1. Смачивание и его роль в технологии и природе
- •8.4.2. Основные условия смачивания в равновесных и неравновесных системах
- •8.4.3. Смачивание различных типов материалов
- •Система жидкий металл - тугоплавкое соединение.
- •8.5. Процессы адгезии, смачивания и
- •Глава 9. Краткая характеристика и общие методы получения и обработки композитов на основе металлической матрицы
- •9.1. Примеры композитов на основе металлической матрицы
- •9.2. Общая характеристика методов получения композитов с металлической матрицей
- •9.2.1. Классификация методов получения и обработки композитов с металлической матрицей
- •9.2.2. Жидкофазные методы
- •9.2.3. Методы осаждения - напыления
- •9.3. Технологические процессы получения и обработки металлических композиционных материалов
- •9.3.1. Обработка давлением
- •9.3.2. Процессы порошковой металлургии
- •9. 4. Методы получения дисперсно-упрочненных композитов
- •9.5. Методы получения псевдосплавов
- •9.6. Методы получения эвтектических композиционных материалов
- •9.7. Низкотемпературные методы изготовления композитов с металлической матрицей
- •Глава 10. Основные виды композитов на основе металлической матрицы. Свойства, методы получения и области применения
- •10.1. Металлические волокнистые композиционные материалы
- •10.1.1. Свойства и методы получения мвкм на основе алюминия
- •10.1.2. Свойства и методы получения мвкм на основе магния
- •10.1.3. Свойства и методы получения мвкм на основе титана
- •10.1.4. Свойства и методы получения мвкм на основе никеля и кобальта
- •10.1.5. Области применения мвкм
- •10.2. Дисперсно-упрочненные композиционные материалы
- •10.2.1 Свойства и методы получения дкм на основе алюминия
- •10.2.2. Свойства и методы получения дкм на основе никеля
- •10.2.3. Свойства и методы получения дкм на основе хрома
- •10.2.4. Свойства и методы получения дкм на основе молибдена
- •10.2.5. Свойства и методы получения дкм на основе вольфрама
- •10.2. 6. Свойства и методы получения дкм на основе серебра
- •10.3. Псевдосплавы
- •10.3.1. Свойства и методы получения псевдосплавов на основе железа
- •10.3.2. Свойства и методы получения псевдосплавов на основе вольфрама и молибдена
- •10.3.3. Свойства и методы получения псевдосплавов на основе никеля
- •10.3.4. Свойства и методы получения псевдосплавов на основе титана
- •10.3.5. Области применения псевдосплавов
- •10.4. Эвтектические композиционные материалы
- •Глава 11. Композиты на основе полимерной матрицы. Свойства, методы получения и области применения
- •11.1. Состав и основные свойства полимерных композитов
- •11.1.1. Армирующие волокна для пкм
- •11.1.2. Матрицы для пкм
- •11.1.3. Наногибридные полимер-неорганические композиты
- •11.1.4. Поверхность раздела фаз в пкм
- •11.2. Методы получения полимерных композитов
- •11.2.1. Метод изготовления слоистыл и намотанных пкм
- •11.2.2. Золь-гель-методы получения наногибридных полимер-неорганических композитов
- •11.4. Дендримеры - новый вид полимеров и композиты на их основе
- •Глава 12. Жидкокристаллические композиты. Свойства, методы получения и области применения
- •12.1. Основные свойства жидких кристаллов
- •12.2. Методы получения жидкокристаллических композитов
- •12.3. Области применения жкк
- •Глава 13. Керамические и углерод-углеродные композиционные материалы. Основные свойства, методы получения и области применения
- •13.1. Керамические композиционные материалы
- •13.1.1. Основные свойства ккм
- •6 Армирование волокнами; в - «затупление» трещины на большой площади
- •13.1.2. Методы получения и области применения ккм
- •13.2. Углерод - углеродные композиционные материалы
- •13.2.1. Основные свойства уукм
- •13.2.2. Методы получения и области применения уукм
- •Глава 14. Синергетика процессов создания композитов. Новые виды материалов и технологий: нано- и биоковмпозиты
- •Послесловие
- •Задачи и упражнения
- •Литература основная
- •Литература дополнительная
- •Содержание
- •Глава 1 Классификация и критерии конструирования
- •Глава 2. Периодическая таблица Менделеева. Электронная
- •Глава 3. Фазовые переходы и их влияние на структуру
- •Глава 4. Физико-химические свойства основных компонентов
- •Глава 5. Термодинамика композиционных систем
- •Глава 6. Межфазное взаимодействие, совместимость компонентов, Стабильность границы и прочность композита................................68
- •Глава 7. Физические свойства композитов. Упругие
- •Глава 8. Адгезия и смачивание в композитах.........................................90
- •Глава 9. Краткая характеристики и общие методы получения и обработки композитов на основе металлической матрицы............................105
- •Глава 10. Основные виды композитов на основе м еталличгеской матрицы. Свойства, методы получения и области применения........................ .......... .............114
- •Глава 11. Композиты на основе полимерной матрицы. Свойства,
- •Глава 12. Жидкокрис галлические композиты. Свойства,
- •Глава 14. Синергетика процессов создания композитов.
Глава 2. Периодическая таблица Менделеева. Электронное строение элементов, типы связей и свойства веществ
Материально-технический прогресс определяется взаимосвязанным процессом открытия и использования новых энергетических ресурсов, созданием новых технологических процессов и оборудования, разработкой и применением новых материалов с комплексом необходимых свойств. Поэтому в ближайшие десятилетия следует ожидать дальнейшего расширения использования всех химических элементов периодической системы Менделеева с целью конструирования на их основе новых материалов с технически важными свойствами.
К таким материалам относятся композиты - сложные соединения разнообразных химических элементов. Развитие научных основ конструирования композитов требует квалифицированного и широкого использования Периодической системы, место каждого элемента в которой является ключом к его атомному и кристаллическому строению, ко всем физическим и химическим свойствам.
2.1. Периодический закон д.И. Менделеева и свойства элементов
Основой современной науки о химических элементах является периодический закон Д. И. Менделеева, открытый им в 1869г., и отражающая закон Периодическая система химических элементов.
В формулировке Д.И. Менделеева периодический закон гласил:
"Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов". Своим открытием Д.И. Менделеев впервые показал, что многообразие существующих в окружающем нас материальном мире элементов - не случайный набор, а единая система, периодическая по своим свойствам. Самым важным оказалось, что установленный Д.И. Менделеевым естественный ряд химических элементов, расположенных по возрастанию их атомных весов, практически совпал с рядом элементов, расположенных по увеличению зарядов их ядер, т.е. по увеличению их порядковых номеров. Таким образом, свойства элементов периодически изменяются по мере роста заряда ядер их атомов. С познанием законов микромира стало ясно, что периодичность в химических свойствах элементов обусловлена квантовой периодичностью.
В современной форме периодический закон формулируется следующим образом: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов элементов.
В привычном виде периодическая система Менделеева представлена на рис. 2.1. Она состоит из семи периодов (горизонтальные ряды, обозначены арабскими цифрами, седьмой период не завершен) и восьми групп (столбцы, обозначены римскими цифрами, каждая группа состоит из двух подгрупп, А и Б - главная и побочная подгруппы соответственно).
Свойства элементов в подгруппах (А) изменяются закономерно. Так. в подгруппе щелочных металлов (IA) увеличение атомного номера Z сопровождается повышением химической активности, тогда как в подгруппе галогенов (VIIA) наблюдается обратная зависимость. Внутри каждого периода наблюдается более или менее равномерный переход от активных металлов через менее активные металлы и слабоактивные неметаллы к очень активным неметаллам и, наконец, к инертным газам.
Каждый период представляет собой совокупность химических элементов, в атомах которых происходит постепенное заполнение одного и того же электронного слоя, начиная от элемента щелочного металла и заканчивая элементом благородного газа (кроме первого периода, состоящего из двух элементов - водорода и гелия). Номер периода совпадает со значением главного квантового числа п внешнего энергетического уровня. Различие в последовательности заполнения электронных слоев объясняет причину различий в длине периодов.
Структура
периодической таблицы соответствует
порядку заполнения электронных
оболочек и слоев в атомах. Состояние
электрона в атоме определяют четырьмя
квантовыми числами: главное квантовое
число п
=1,2,3,...; орбитальное (азимутальное)
квантовое число l
= 0,1, 2,...,n-1,
магнитное квантовое число
![]() ;
спиновое квантовое число
;
спиновое квантовое число
![]() .
Каждому значению l
соответствует 2l+1
значений
.
Каждому значению l
соответствует 2l+1
значений
![]() ,
а каждому
-
два значения
,
а каждому
-
два значения
![]() .
Таким образом, замкнутая оболочка,
характеризуемая определенными значениями
п
и l,
содержит 2(2l+1)
состояний электронов, равное числу
комбинаций значений
и
.
.
Таким образом, замкнутая оболочка,
характеризуемая определенными значениями
п
и l,
содержит 2(2l+1)
состояний электронов, равное числу
комбинаций значений
и
.
Состояния с заданными значениями n и l принято обозначать 1s, 2s, 2р, 3s,..., где цифры указывают значение n, а буквы s, p, a, f соответствуют l=0,1,2,3.... Максимальное число электронов в слое с определенным п:



Таким образом, замкнутая s-оболочка (l=0) содержит два электрона, p-оболочка (l=1)- шесть электронов, d-оболочка (l=2) - десять электронов. Число же электронов в слоях с п =1,2,3,4 составляет 2,8,18,32....
Свойства атомов элементов определяются числом электронов во внешней электронной оболочке, поэтому элементы, имеющие одинаковое строение внешней оболочки принадлежат к одной группе.
Все
электроны с заданным п
образуют электронный слой, содержащий
2п2
электронов. Поскольку по принципe
Паули на орбите может находиться не
более двух электронов с противоположно
направленными спинами (спин-собственный
момент количества движения электрона,
m![]() =+1/2
и m
=-1/2).
число орбит в слое с определенным
значением п
равно п2
. Слои с п
=1,2,3,4,5,..., согласно терминологии, принятой
для рентгеновских спектров, часто
называют К-,
L-,
М-, N-,
Р- слоями и
т.д. Максимальное распределение электронов
по атомным слоям представлено в табл.
2.1.
=+1/2
и m
=-1/2).
число орбит в слое с определенным
значением п
равно п2
. Слои с п
=1,2,3,4,5,..., согласно терминологии, принятой
для рентгеновских спектров, часто
называют К-,
L-,
М-, N-,
Р- слоями и
т.д. Максимальное распределение электронов
по атомным слоям представлено в табл.
2.1.
Таблица 2.1. Распределение электронов по атомным слоям
K-cлой(s)
|
L-слой(p)
|
М-слой (d)
|
N-cлой(f)
|
N=1
|
n=2
|
n=3
|
n=4
|
L=0
|
l=0,1
|
l=0,1,2
|
l=0,1,2,3
|
|
|
|
|
2 электрона
|
2+6=8
|
2+6+10=18
|
2+6+10+14=32
|
1 орбита
|
4 орбиты
|
9 орбит
|
16 орбит
|
Периоды начинаются s-элементом и заканчиваются p-элементом, что соответствует последовательному заполнению электронных оболочек с возрастающими значениями n и l. Ядро с зарядом Z присоединяет электроны в порядке уменьшения прочности их связи. Для элементов первого периода происходит сначала заполнение оболочки 1s, для элементов второго и третьего периодов - оболочек 2s, 2р и 3s, Зр. Однако, начиная с четвертого периода, последовательность заполнения оболочек нарушается вследствие конкуренции близких по энергии связи электронов. При этом прочнее связанными могут оказаться электроны с большим п, но меньшим l (например, электроны 4s прочнее связаны, чем 3d).
Распределение
электронов в атоме по оболочкам определяет
его электронную конфигурацию, для
указания которой пишут в ряд символы
заполненных электронных состояний
оболочек, начиная с самой близкой к
ядру. Например, электронную структуру
А1
(Z=13)
можно записать![]() .
.
При заполнении 3d,4d,5f- оболочек получаются группы переходных металлов при заполнении 4f и 5f -оболочек - группа лантаноидов (первая группа редкоземельных элементов) и группа актиноидов (вторая группа редкоземельных элементов). Только для переходных металлов, внутренние электронные оболочки которых (d или f) не полностью завершены, возникает магнитоупорядоченное состояние (ферро -, анти-ферро-, ферримагнитного типов).
Большинство химических элементов составляют металлы - их свыше 85. К неметаллам относятся элементы подгрупп VIIIA, VI1A, VIA, VA, IVA за исключением полония, висмута и свинца. Ряд элементов в свободном состоянии занимают промежуточное положение между металлами и неметаллами - это бор, кремний, германий, мышьяк и сурьма.
Свойства элементов в Периодической системе изменяются по трем направлениям: горизонтальному, вертикальному и диагональному.
Если исключить переходные d- и f-элементы, которые являются типичными металлами, то в периодах от щелочных металлов до благородных газов металлические свойства убывают, а по группам с ростом порядкового номера они увеличиваются. Самым типичным металлом является Fr(87), a практически Cs(55) (поскольку Fr радиоактивен и не имеет стабильных долгоживущих изотопов), а самым типичным неметаллом - F(9). Положение водорода в системе неопределенно - он имеет некоторые общие свойства как со щелочными металлами, так и с галогенами. Поэтому некоторые ученые относят его к подгруппе IA, а другие к подгруппе VIIA.
Так как у элементов одного периода электроны заполняют оболочку с одним и тем же главным квантовым числом, атомные (а также ковалентные и ионные) радиусы при переходе от щелочного металла к благородному газу уменьшаются, а в группах (особенно в подгруппах А) с ростом порядкового номера увеличиваются. Таким образом, по диагонали Периодической системы встречаются атомы элементов с примерно одинаковыми атомными радиусами, а значит со сходными свойствами. Периодичность в изменении химических свойств элементов объясняется периодичностью повторения сходных электронных конфигураций с ростом заряда ядра или порядкового номера элемента, например, периодически изменяется электроотрицательность - условная величина, характеризующая способность атома в молекуле к притяжению валентных электронов. В табл. 2.2 приведены значения электроотрицательностей химических элементов. Как видно, для элементов подгрупп А электроотрицательность растет в периодах и падает в группах с увеличением порядкового номера. Периодически меняются и магнитные свойства переходных металлов.
Магнетизм является следствием взаимодействия элементарных носителей магнитного момента с внешним магнитным полем Н и друг с другом. Элементарными носителями магнитного момента являются частицы, из которых состоят атомы. Это - электроны с моментом е и атомные ядра с моментом я. Последняя величина представляет собой сумму магнитных моментов i всех (i) частиц, входящих в состав ядра. Поскольку то
весь
магнетизм атома приписывают магнетизму
электронов. Из классической физики
можно объяснить существование магнитного
момента электрона, исходя из механического
момента его движения (L*)
по орбите ядра радиуса (r).
L*=mvr,
где m-масса
электрона, v-линейная
скорость. Орбиту электрона можно
рассматривать как виток с током I=ev,
где е-заряд
электрона, v
- частота обращения электрона по орбите,
то есть
![]() .
Электрический ток
в круговом витке создает орбитальный
магнитный момент электрона: e=IS*,
где S*
— площадь
орбиты. Помимо вращения по орбите
электрон вращается еще вокруг своей
оси и обладает еще одним механическим
моментом - спином s
, а значит и
вторым магнитным моментом s
-спиновым.
Суммарный магнитный момент электрона:
=e+s.
Таковы классические представления
о магнетизме отдельного электрона. Но
все атомы, кроме водорода, многоэлектронные
и у них полный магнитный момент атома
(J)
определяется выражением: J=Li+Si=L+S,
где L
и S
-суммарные орбитальный и спиновый
магнитные моменты атома.
.
Электрический ток
в круговом витке создает орбитальный
магнитный момент электрона: e=IS*,
где S*
— площадь
орбиты. Помимо вращения по орбите
электрон вращается еще вокруг своей
оси и обладает еще одним механическим
моментом - спином s
, а значит и
вторым магнитным моментом s
-спиновым.
Суммарный магнитный момент электрона:
=e+s.
Таковы классические представления
о магнетизме отдельного электрона. Но
все атомы, кроме водорода, многоэлектронные
и у них полный магнитный момент атома
(J)
определяется выражением: J=Li+Si=L+S,
где L
и S
-суммарные орбитальный и спиновый
магнитные моменты атома.
Переходные
металлы группы железа имеют электронную
конфигурацию общего вида
![]() .
Электроны незаполненной 3d-оболочки,
располагающейся близко к периферии
атома, подвержены сильному влиянию
электростатического поля окружающих
ионов (кристаллическое поле). Поскольку
энергия взаимодействия кристаллического
поля с орбитальным магнитным моментом
атома L
существенно превышает энергию
спин-орбитального взаимодействия,
орбитальный момент приобретает
фиксированную пространственную
ориентацию ("замораживается")
и внешнее магнитное поле не изменяет
его направление. Поскольку среднее
значение проекции орбитального момента
электронов на направление поля равно
нулю, магнитный момент атома J
определяется почти полностью его
спиновым магнитным моментом S,
так что суммарный магнитный момент
атома 3d-металлов
будет J=S
.
.
Электроны незаполненной 3d-оболочки,
располагающейся близко к периферии
атома, подвержены сильному влиянию
электростатического поля окружающих
ионов (кристаллическое поле). Поскольку
энергия взаимодействия кристаллического
поля с орбитальным магнитным моментом
атома L
существенно превышает энергию
спин-орбитального взаимодействия,
орбитальный момент приобретает
фиксированную пространственную
ориентацию ("замораживается")
и внешнее магнитное поле не изменяет
его направление. Поскольку среднее
значение проекции орбитального момента
электронов на направление поля равно
нулю, магнитный момент атома J
определяется почти полностью его
спиновым магнитным моментом S,
так что суммарный магнитный момент
атома 3d-металлов
будет J=S
.
К
первой группе редкоземельных металлов
(РЗМ) относят элементы с атомными номерами
от 57 до 71: La,
Се, Pr,
Nd,
Pm,
Sm,
Eu,
Gd,
Tb,
Dy,
Ho,
Er,
Tm,
Yb,
Lu.
Элементы от La
до Eu
причисляют к легким, а от Gd до Lu
- к тяжелым редкоземельным элементам.
РЗМ имеют электронную конфигурацию
общего вида
![]() .
"Магнитная" 4f-оболочка
последовательно заполняется с
увеличением атомного номера РЗМ от 57
(k=0)
у La
до 71 (k=
14) у Lu. Расположенная в глубине атома
незастроенная 4f-оболочка
экранирована от влияния кристаллического
поля и "замораживания" орбитального
момента атома не происходит. Поэтому
магнитный момент в атомах РЗМ определяется
как спиновым, так и орбитальным магнитными
моментами 4/-электронов. Для легких РЗМ,
4f-оболочка
которых заполнена менее чем наполовину,
орбитальный и спиновый магнитные моменты
устанавливаются антипараллельно и
полный момент атома J=L-S.
У гадолиния (n=7)
орбитальные моменты электронов
скомпенсированы (L=0)
и соответственно J=S.
Для тяжелых
РЗМ, у которых 4f-оболочка
заполнена более чем наполовину,
орбитальный и спиновый магнитные моменты
устанавливаются параллельно и полный
момент атома J=L+S.
.
"Магнитная" 4f-оболочка
последовательно заполняется с
увеличением атомного номера РЗМ от 57
(k=0)
у La
до 71 (k=
14) у Lu. Расположенная в глубине атома
незастроенная 4f-оболочка
экранирована от влияния кристаллического
поля и "замораживания" орбитального
момента атома не происходит. Поэтому
магнитный момент в атомах РЗМ определяется
как спиновым, так и орбитальным магнитными
моментами 4/-электронов. Для легких РЗМ,
4f-оболочка
которых заполнена менее чем наполовину,
орбитальный и спиновый магнитные моменты
устанавливаются антипараллельно и
полный момент атома J=L-S.
У гадолиния (n=7)
орбитальные моменты электронов
скомпенсированы (L=0)
и соответственно J=S.
Для тяжелых
РЗМ, у которых 4f-оболочка
заполнена более чем наполовину,
орбитальный и спиновый магнитные моменты
устанавливаются параллельно и полный
момент атома J=L+S.
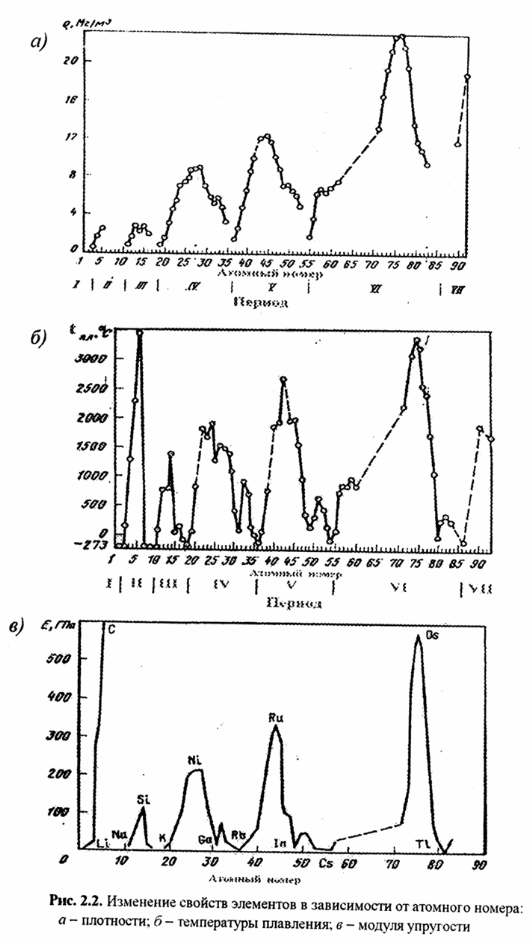
На рис. 2.2, 2.3 показаны периодические изменение плотности, температуры плавления, модуля упругости и сдвига простых веществ в зависимости от положения в таблице Менделеева.
Таблица 2.2. Электроотрицательность элементов периодической системы по данным Полинга (1), Горди (2) и Гайсинского (3) [5]
№ группы
|
Элемент
|
Электроотрицательность по данным
|
№ группы
|
Элемент
|
Электроотрицательность по данным
|
||||
|
|
[1]
|
[2]
|
[3]
|
|
|
[1]
|
[2]
|
[3]
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
IA
|
Li
|
1,0
|
1,0
|
1,0
|
IB
|
Сu
|
2,0
|
1,9
|
2,0
|
|
Na
|
0,9
|
0,9
|
0,9
|
|
Ag
|
1,9 |
1,8
|
1,8
|
|
К
|
0,8
|
0,8
|
0,8
|
|
Au
|
2,4
|
2,1
|
2,3
|
|
Rb
|
0,8
|
0,8
|
0,8
|
|
|
|
|
|
|
Cs
|
0,7
|
0,7
|
0,7
|
IIB
|
Zn
|
1,6
|
1,5
|
1,5
|
|
Fr
|
0,7
|
|
~0,7
|
|
Cd
|
1,7
|
1,5
|
1,5
|
|
|
|
|
|
|
Hg
|
1,9
|
1,8
|
1,9
|
IIА
|
Be
|
1,5
|
1,5
|
1,5
|
|
|
|
|
|
|
Mg
|
1,2
|
1,2
|
1,2
|
IIIB
|
В
|
2,0
|
2,0
|
2,0
|
|
Ca
|
1,0
|
1,0
|
1,0
|
|
AI
|
1,5
|
1,5
|
1,5
|
|
Sr |
1,0
|
1,0
|
1.0
|
|
Ga
|
1,6
|
1,6
|
1,6
|
|
Ba |
0,9
|
0,9
|
0,85
|
|
In
|
1,7
|
1,6
|
1,6
|
|
Ra |
0,7
|
|
0,8
|
|
Tl
|
1,8
|
1,7
|
1,5
|
IIIA
|
Sc |
1,3
|
|
1,3
|
IVB
|
С
|
2,5
|
2,5
|
2,5
|
|
Y |
1,2
|
|
1,2
|
|
Si
|
1,8
|
1,8
|
1,8
|
|
La-Lu |
1,1-1
|
1,1
|
1,1
|
|
Ge
|
1,8
|
1,8
|
1,7
|
|
Ac
|
1,1
|
|
~1,0
|
|
Sn
|
1,8
|
1,7
|
1,65
|
|
Ce |
|
1,1
|
1,05
|
|
Pb
|
1,8
|
1,7
|
1,6
|
|
Pr |
|
1,1
|
1,1
|
|
|
|
|
|
|
|
|
|
|
VB
|
N
|
3,0
|
3,0
|
3,0
|
IVA
|
Ti
|
1,5
|
1,6
|
1,6
|
|
P
|
2,1
|
2,1
|
2,1
|
|
Zr |
1,4
|
1,4
|
1,4
|
|
As
|
2,0
|
2,0
|
2,0
|
|
Hf |
1,3
|
1,4
|
~1,3
|
|
Sb
|
1,9
|
1,8
|
1,8
|
|
Th |
1,3
|
1,1
|
1,1
|
|
Bi
|
1,9
|
1,8
|
1,8
|
VA
|
V |
1,6 |
1,6 |
1,35 |
VIB |
O |
3,5 |
|
3,5 |
|
Nb |
1,6 1,6 1,6
|
1,6
|
~1,6
|
|
S
|
2,5
|
2,5
|
2.5
|
|
Та
|
1,5 ,5 1,4
|
1,4
|
~1,4
|
|
Se
|
2,4
|
2,3
|
2,3
|
|
Pa |
1,5 ,5
|
|
~1,4
|
|
Те
|
2,1
|
2,1
|
2,1
|
|
|
|
|
|
|
Po
|
2,0
|
|
2,0
|
VIA
|
Cr
|
1,6 ,6
|
1,6
|
~2,1
|
|
|
|
|
|
|
Mo
|
1,8 ,8
|
1,6
|
~2,1
|
VIIB
|
H
|
-
|
-
|
2,1
|
|
W |
1,7 ,7
|
1,7
|
2,1
|
|
F
|
4,0
|
|
4,0
|
|
U |
1,7 ,7
|
1,3
|
1,3
|
|
Cl
|
3,0
|
|
3,0
|
|
|
|
|
|
|
Br
|
2,8
|
|
2,8
|
VIIA
|
Mn |
1,5 ,5
|
1,7
|
~2,3
|
|
I
|
2,5
|
|
2,6
|
|
Tc |
1,9 ,9
|
|
|
|
At
|
2,2
|
|
-
|
|
Re |
1,9 ,9
|
1,9
|
|
|
|
|
|
|
|
|
|
|
|
VIIIB
|
Fe
|
1,9
|
1,7
|
1,8
|
|
|
|
|
|
|
Co
|
1,8
|
1,7
|
1,7
|
|
|
|
|
|
|
Ni
|
1,8
|
1,7
|
1,7
|
|
|
|
|
|
|
Ru
|
2,2
|
2,0
|
2,05
|
|
|
|
|
|
|
Rh
|
2,2
|
2,1
|
2,1
|
|
|
|
|
|
|
Pd
|
2,2
|
2,0
|
2,0
|
|
|
|
|
|
|
Os
|
2,2
|
2,1
|
~2,1
|
|
|
|
|
|
|
Ir
|
2,2
|
2,1
|
2,1
|
|
|
|
|
|
|
Pt
|
2,2
|
2,1
|
2,1
|

мов. На основании анализа Периодической системы Менделеева можно сделать следующие заключения.
• В каждой подгруппе (А) по мере увеличения Z наблюдается усиление металлических свойств.
• В каждом периоде с увеличением Z наблюдается ослабление металлических и усиление неметаллических свойств (ослабление энергии связи внешних электронов с ядром при переходе от периода к периоду).
• Взаимное расположение элементов s,p,d,f подгрупп в каждой группе отвечает повышению электроотрицательности элементов слева направо.
• Все неметаллы, кроме Н, Не - p-элементы.
