
- •Методичні вказівки
- •Зміст модуля II
- •7. Розчини
- •7.1 Загальна характеристика розчинів
- •7.2 Концентрація розчиненої речовини
- •7.3 Властивості розчинів
- •7.3. Питання та задачі для самоконтролю
- •8.Розчини електролітів
- •8.1. Загальна характеристика розчинів електролітів
- •8.2.Реакції в розчинах електролітів
- •8.3. Запитання для самоконтролю
- •8.4. Задачі для самоконтролю
- •9. Комплексні сполуки
- •9.1.Загальна характеристика комплексних сполук
- •9.2.Номенклатура комплексних сполук
- •9.3.Природа координаційного зв’язку
- •9.4.Класифікація комплексних сполук.
- •9.5.Дисоціація комплексних сполук у розчинах. Стійкість комплексних іонів.
- •9.6.Ізомерія комплексних сполук
- •9.7.Властивості комплексних сполук
- •9.8.Основні способи одержання комплексних сполук.
- •9.9.Значення та застосування комплексних сполук
- •9.10.Запитання та задачі для самоконтролю
- •8. Номенклатура комплексних сполук.
- •10. Окисно-відновні реакції
- •10.1.Загальна характеристика процесів окислення та відновлення
- •10.2.Складання рівнянь окисно-відновних реакцій
- •10.3. Запитання та задачі для самоконтролю
- •11. Загальні та електрохімічні властивості металів
- •11.1. Загальні властивості металів
- •11.2. Гальванічні елементи. Корозія металів
- •11.3. Електроліз
- •11.4. Запитання та задачі для самоконтролю
- •Список рекомендованої літератури
10.2.Складання рівнянь окисно-відновних реакцій
При складанні рівнянь окисно-відновних реакцій використовують, переважно, два методи:
метод електронного балансу, який базується на законах збереження числа атомів і загальної кількості електронів, які віддаються та приймаються при зміні ступеню окиснення;
метод іонно-електронного балансу, який ґрунтується на складанні йонних рівнянь для процесу окислення і процесу відновлення з наступним складанням загального рівняння.
Стехіометричні коефіцієнти в рівняннях окислювально-відновних реакцій знаходять з урахуванням числа відданих і прийнятих електронів. Треба пам’ятати, що загальна кількість електронів, яку віддає відновник, дорівнює загальній кількості електронів, яку приєднує окислювач.
Наприклад, схема реакції:
H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2О Визначимо ступені окислення елементів і виявимо ті елементи, які його змінили:
+1 –2 +1 +6 -2 0 +3
H2S + K2Cr2O7 +H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O
Випишемо ці елементи та напишемо напівреакції:
-
3

- процес окиснення
6
2
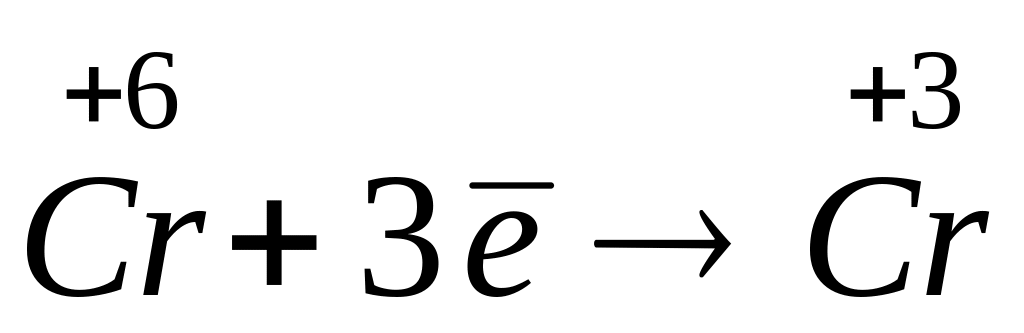
- процес відновлення
Коефіцієнти 3 та 2 поставимо в рівняння реакції відповідно в лівій та в правій його частині:
3H2S + K2Cr2O7 + H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + H2O
Кількість атомів калію в лівій та правій частинах рівняння однакова. Підрахувавши кількість іонів SO42- (3+1 = 4 ), ставимо перед сульфатною кислотою коефіцієнт 4. Підраховуємо кількість атомів гідрогену в лівій частині:
3×2 + 4×2 = 14, тоді перед молекулою води в правій частині рівняння треба поставити коефіцієнт 7, щоб в правій частині рівняння теж було 14 атомів гідрогену. Завершене рівняння буде мати вигляд:
3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + K2SO4 + 7H2O
Визначити можливість перебігу окислювально-відновних реакцій і їх напрямок можна на основі стандартних окислювально-відновних потенціалів .
Потенціал, що
виникає на межі поділу інертного
електрода з розчином, в якому є окислена
й відновлена форми речовини, називають
рівноважним окислювально-відновним
потенціалом ().
Значення ,
виміряні за стандартних умов (концентрація
іонів у розчині дорівнює одиниці і
температура 298 К), називають стандартними
окислювально-відновними потенціалами
і позначають
![]() .
Стандартні окислювально-відновні
потенціали
кількісно характеризують здатність
різних систем приєднувати або віддавати
електрони.
.
Стандартні окислювально-відновні
потенціали
кількісно характеризують здатність
різних систем приєднувати або віддавати
електрони.
Усі речовини, іони й атоми, що мають більш додатні значення в окисно-відновних реакціях є окисниками.
Отже, за допомогою окислювально-відновних потенціалів можна визначити напрямок перебігу будь-якої окислювально-відновної реакції, наприклад, визначимо можливий напрямок перебігу реакції
2Fe3++2I-=2Fe2++I2
![]() В;
В;
![]() В
В
Порівнюючи ці величини, можна зробити висновок, що іони Fe3+ будуть окислювачем, а іони I- - відновниками. Реакція проходитиме прямо (зліва направо), тому що електрорушійна сила (ЕРС) такої системи буде позитивною.
![]() В
В
Якщо ми візьмемо реакцію 2Fe3++2Br-=2Fe2++Br2, то ця реакція самовільно проходитиме у зворотному напрямку, тому що Br2 сильніший окислювач, ніж іони Fe3+
![]() B;
B.
B;
B.
Наведені приклади показують, що використовуючи значення стандартних окислювально-відновних потенціалів, можна визначити силу окислювача і відновника, напрямок перебігу окислювально-відновного процесу.
