
- •Методичні вказівки
- •12. Хімія неметалічних елементів
- •12.1. Загальна характеристика неметалів
- •12.2. Карбон та його неорганічні сполуки
- •12.3. Силіцій та його сполуки
- •12.4. Запитання та задачі для самоконтролю
- •13. Твердість води
- •13.1. Магній, Кальцій та їхні сполуки
- •13.2. Твердість води та методи її усунення
- •13.3. Запитання та задачі для самоконтролю
- •14. Неорганічні в'яжучі речовини
- •14.1. Загальні властивості
- •14.2. Гіпсові в'яжучі речовини
- •14.3. Вапняні в'яжучі речовини
- •14.4. Портландцемент
- •14.5. Корозія бетону. Методи захисту бетону від корозії
- •14.6. Запитання та задачі для самоконтролю.
- •15. Органічні сполуки
- •15.1. Загальна характеристика
- •15.2. Теорія хімічної будови органічних сполук о.М.Бутлерова
- •5.3.Класифікація
- •15.4. Номенклатура
- •15.5. Органічні полімерні матеріали в будівництві
- •15.5.1. Загальна характеристика
- •15.5.2. Класифікація
- •15.5.3. Методи одержання полімерів
- •15.5.4. Будова і властивості полімерів
- •15.5.5. Bикористання полімерних матеріалів у будівництві
- •15.6. Запитання та завдання для самоконтролю
- •Література
12.3. Силіцій та його сполуки
Поширення у природі. За поширенням у земній корі Силіцій посідає друге місце після Оксигену. Масова частка Силіцію в земній корі становить 27,6%. У природі Силіцій зустрічається лише у вигляді сполук. Карбон – головний елемент живої природи, а Силіцій — неживої. Більшість гірських порід утворені силікатами – сполуками Силіцію. Сполуки Силіцію входять до складу рослин, містяться також у живих організмах.
Кремній – кристалічна речовина сіро-стального кольору з металічним блиском. Структура кремнію аналогічна структурі алмазу. В його кристалі кожний атом кремнію зв'язаний з іншими чотирма ковалентними зв'язками, які напрямлені до вершин тетраедра. Ці зв'язки слабші, ніж у алмазі.
Кремній одержують внаслідок відновлення оксиду Силіцію (IV) коксом або магнієм, алюмінієм за високих температур:
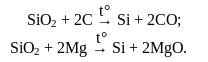
Кремній високої чистоти одержують термічним розкладанням йодиду Силіцію(IV) на танталовій стрічці за температури 1000°С:
![]()
Хімічні властивості. Кремній належить до головної підгрупи четвертої групи періодичної системи. Електронна конфігурація зовнішнього рівня 3s2Зр2. В незбудженому стані кремній, як і вуглець, має на р-підрівні зовнішнього рівня два неспарених електрони та вільну р-орбіталь, на яку під час збудження атома може переходити розпарований електрон s-підрівня, внаслідок чого утворюється чотири неспарених електрони. У відповідності до такої електронної будови атома кремній у своїх сполуках може виявляти ступені окиснення - 4 +2, +4. Найбільш типовий ступінь окиснення кремнію — (+4).
Кремній має слабші неметалічні властивості, ніж вуглець, тому що радіус його атома більший і зовнішні електрони знаходяться далі від ядра.
Відновні властивості. Під час сильного нагрівання кремній горить на повітрі
Si + О2 → SiO2.
Зі фтором кремній взаємодіє за звичайних умов, з іншими галогенами –під час нагрівання:

Фторид кремнію SiF4y водних розчинах гідролізує
SiF4 + ЗН2О → H2SiO3 + 4HF.
Фтороводень HF, що утворюється при цьому, взаємодіє з SiF4, утворюючи гексафтороіфемнієвую кислоту H2SiF6
SiF4 + 2HF → H2SiF6.
Розчинні солі цієї кислоти (фторосилікати магнію, цинку, алюмінію) застосовують у будівництві для обробки поверхні будівельного каменю, щоб зробити її водонепроникною.ї
За високої температури кремній взаємодіє з вуглецем з утворенням карбіду кремнію (карборунду)
![]()
Карборунд має алмазоподібні кристалічні ґратки, в яких кожний атом кремнію оточений чотирма атомами вуглецю і навпаки, а ковалентні зв'язки дуже міцні. Тому за твердістю карборунд наближається до алмазу. З карборунду виготовляють шліфувальні та точильні камені.
Кремній реагує з розплавами або з розчинами лугів
Si + 2NaOH + Н2О -+ Na2SiO3 + 2Н2↑.
Кремній не взаємодіє з кислотами (окрім суміші плавикової HF та азотної HNO3)
3Si + 4HNO3 + 12HF → 3SiF4 +4NO+ 8Н2О.
Окисні властивості. Під час нагрівання кремній взаємодіє з багатьма металами, утворюючи силіциди, в яких кремній виявляє ступінь окиснення (-4).
З воднем кремній безпосередньо не реагує, але внаслідок дії кислот на силіциди металів утворюються кремневодні, або силани:
![]()
Силан - безбарвний газ з неприємним запахом, дуже отруйний. Він є сильним відновником, який самозаймається на повітрі
SiН4 +2О2 → SiO2 + 2Н2О.
Використання. Кремній використовують для одержання різних сплавів. Сталь з масовою часткою кремнію 4% (електротехнічна сталь) використовується для виготовлення трансформаторів, двигунів, генераторів завдяки тому, що вона легко намагнічується та розмагнічується. Зі сталі з масовою часткою кремнію 16% і більше (кислотостійка) виготовляють апарати для хімічної промисловості.
Кристалічний кремній як напівпровідник використовується в радіо та електротехніці. З кремнію виготовляють сонячні батареї.
Кисневі сполуки кремнію. Оксид кремнію (IV) SiO2 (діоксид кремнію, кремнезем) - тверда тугоплавка речовина, широко розповсюджена в природі в двох видозмінах: 1) кристалічний кремнезем - мінерал кварц і його різновиди (гірський кришталь, агат, пісок, кремінь); 2) аморфний кремнезем - мінерал опал, діатоміт, трепел, або інфузорна земля.
Різка відмінність фізичних властивостей оксиду кремнію (IV) SiO2 від оксиду вуглецю (IV) СО2 поясняються різною будовою кристалічних решіток. СО2 кристалізується в молекулярних решітках, a SiO2 - в атомних. Структуру SiO2B площинному зображенні можна подати у вигляді:
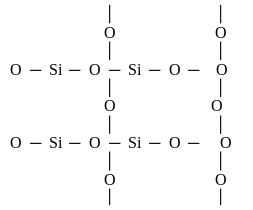
Кожний атом кремнію знаходиться в центрі тетраедра, а в вершинах тетраедра розташовані атоми кисню Окремі тетраедри з'єднуються один з одним вершинами за допомогою спільних атомів кисню. Всю масу кремнезему можна розглядати як кристал, формула якого (SiO2)n. Така будова SiO2 зумовлює його високу твердість та тугоплавкість. Тетраедри SiO4 можуть по-різному розміщуватися в просторі, утворюючи різноманітні кристалічні структури SiO2. Ці кристалічні модифікації SiO2 можуть в значній або в незначній мірі відрізнятися між собою за фізичними та хімічними властивостями і за певних температур можуть переходити з однієї в іншу.
Оксид кремнію (IV) є кислотним. Під час його сплавлення з лугами, карбонатами лужних металів або основними оксидами утворюються солі кремнієвої кислоти - силікати
SiO2 + 2NaOH → Na2SiO3 + Н2О;
SiO2 + Na2CO3 → Na2SiO3 + CO2;
SiO2 + CaO → CaSiO3.
Кислоти, крім фтороводневої, не діють на оксид кремнію (IV). Під час взаємодії фтороводневої кислоти з SiO2 утворюється газоподібний фторид кремнію SiF4
SiO2 + 4HF → SiF4 + 2Н2О.
Цю реакцію використовують для нанесення надписів на склі.
SiO2 у воді за звичайних умов практично не розчиняється і хімічно з нею не взаємодіє. Тому кремнієві кислоти отримують непрямим шляхом. Наприклад, метакремнієву кислоту отримують дією іншої кислоти на її солі
Na2SiO3.+ 2НС1 → NaCl + H2SiO3↓.
Загальна формула кремнієвих кислот - ySiO2∙zH2O.
У вільному стані існують такі кислоти:
ортокремнієва кислота H4SiO4 або SiO2∙2H2O;
метакремнієва кислота H2Si03 або SiO2∙H2O;
двометакремнієва кислота H2Si2O5 або 2SiO2∙H2O.
Кремнієві кислоти — слабкі малостійкі сполуки. Наприклад, для метакремнієвої кислоти константи дисоціації мають значення
Н2SіO3 ⇄ H+ +НSіO3; K1 = 2 ∙ 10-10
HSiO3 ⇄ H+ + SiO32; К2 = 1 ∙ 10-12
Метакремнієва кислота розчиняється в лугах, утворюючи солі
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O.
Під час нагрівання метасилікатна кислота легко розкладається на оксид Силіцію (IV) та воду:
![]()
Силікатні кислоти нестійкі і в водних розчинах вони поліконденсуються з утворенням полісилікатних кислот. Схематично цей складний процес зображується схемою:
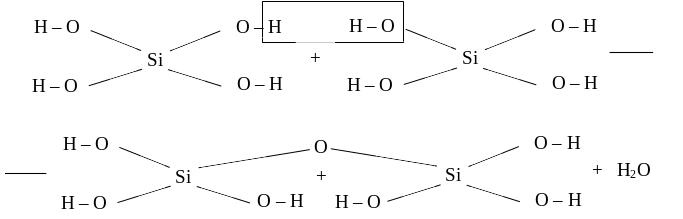
Полісилікатні кислоти у воді практично не розчиняються і легко утворюють колоїдні розчини — золі. Будову міцели золя полісилікатної кислоти зображують формулою:
{[m(ySіО2 ·zН2О) ]nНSіO3- ∙ (n-х)Н+}x- х H+.
Стійкість золей полісилікатних кислот дуже залежить від рН середовища. Вони найбільш стійкі в лужному середовищі. В кислому середовищі золі порівняно швидко можуть переходити в гель змінного складу загальної формули SiO2∙xH2O. Висушені гелі називаються силікагелями. Вони характеризуються дуже розвиненою внутрішньою поверхнею і широко використовуються для поглинання пари органічних розчинників, для освітлення рідин.
Солі силікатних кислот. Солі силікатних кислот – силікати. У воді розчиняються лише силікати лужних металів. Враховуючи складність структури силікатів, їх зображують у вигляді сполук оксидів елементів:
Na2SiO3 — Na2O ∙ SiO2;
CaSiO3 — CaO ∙ SiO2-.
Розчини силікатів натрію та калію називають рідким склом, яке одержують сплавленням кварцового піску з содою, або обробкою аморфного кремнезему концентрованим розчином лугу:
SiO2 + Na2CO3 → Na2SiO3 + СО2;
SiO2 + 2NaOH → Na2SiO3 + H2O.
Рідке скло застосовують як зв’язуючий матеріал при виготовленні кислототривких бетонів, замазок, конторського клею. Його також використовують для просочення тканини, дерева, паперу для надання їм вогнестійкості та водонепроникності.
Природні силікати та алюмосилікати. Більшість природних силікатів є солями полі силікатних кислот і мають складну будову. Вони схильні взаємодіяти з водою, утворюючи гідросилікати. Вода може входити до кристалічних решіток у вигляді молекул або іонів ОН-. За звичайних умов гідратовані силікати більш стійкі, ніж безводні. Найбільш поширені в природі силікати мають в своєму складі алюміній, причому, алюміній може знаходитись в силікатах у двох формах: у вигляді катіону (силікати алюмінію) або заміщувати собою атом Силіцію в тетраедрі SiO4, тобто входити до складу аніону — це алюмосилікати.
За структурою силікати можна поділити на 3 класи:
1) Мінерали з решітчатою структурою. Вони мають тетраедричну решітчату структуру в основному з ковалентними зв'язками. До мінералів цієї групи належать польові шпати, які складають більше половини маси земної кори:
ортоклаз K2O ∙ Al2O3 ∙ 6SiO2;
альбіт Na2O ∙ Al2O3 ∙ 6SiO2;
анортіт CaO ∙ Al2O3 ∙ 2SiO2.
У мінералах цього типу тетраедрична решітка простягається на весь кристал, надаючи йому твердість та термостійкість.
2) Мінерали з шаруватою структурою. Вони утворюють шари складної будови, які складаються з тетраедрів та октаедрів. До них належать:
тальк 3MgO ∙ 4SiO2 ∙ H2O;
слюда K2O ∙ 3Al2O3 ∙ 6SiO2 ∙ 2H2O;
каолініт Al2O3 ∙ 2SiO2 ∙ 2H2O.
Тальк та каолініт складаються з електронейтральних шарів, що вільно накладаються один на інший. Такі шари легко ковзаються один відносно одного, чим пояснюються характерні для цих мінералів властивості (мала твердість, сипкість). В слюді, на відміну від перших двох мінералів, шари заряджені негативно і цей заряд нейтралізується розташованими між шарами іонами калію. Електростатична взаємодія між іонами калію та негативно зарядженими шарами надають слюді деякої твердості. Але іонні зв'язки між шарами більш слабкі, ніж ковалентні зв'язки всередині кожного шару, а тому слюда легко розщеплюється на дуже тоненькі пластини.
3) Мінерали з волокнистою структурою. До мінералів цієї групи належать азбести 3MgО∙2SiO2∙2H2O. Вони складаються з довгих ланцюгів сполучених між собою тетраедрів. Ланцюги розміщуються паралельно, а тому ці мінерали легко розділяються на волокна, які характеризуються великою міцністю,
На поверхні землі мінерали й гірські породи, що стикаються з атмосферою, зазнають механічних і хімічних дій води й повітря і поступово змінюються та руйнуються. Руйнування, зумовлене одночасною дією води й повітря, називається вивітрюванням. Розкладання польового шпату (ортоклазу) можна виразити рівнянням:
![]()
Каолініт є головною складовою частиною білої глини. Отже, внаслідок вивітрювання гірських порід утворюються поклади глини, піску та солей.
Використання. Сполуки Силіцію відіграють важливу роль у народному господарстві: кремнезем у вигляді піску широко застосовується в будівництві, для виготовлений скла, кераміки. Ряд силікатних порід, наприклад, граніти, застосовуються як будівельні матеріалу. Слюду й азбест використовують як електроізоляційні матеріали. З силікатів виготовляють наповнювачі для паперу, гуми, фарб.
Штучні силікати. Зі штучних силікатів найбільше значення мають скло, кераміка, цемент.
Скло. Звичайне віконне або пляшкове скло виробляють, сплавляючи оксид Силіцію (IV) у вигляді кварцу або піску з карбонатом кальцію (вапняк, мармур) і карбонатом натрію (сода)
6SiO2 + СаСОз + Na2CO3 → Na2O ∙ CaO ∙ 6SiО2 + 2CО2↑.
Якщо замість карбонату натрію взяти карбонат калію (поташ), утвориться міцне тугоплавке скло, яке застосовують для виготовлення хімічного посаду.
З розплавленого кварцу виготовляють кварцове скло, яке пропускає ультрафіолетове випромінювання і має малий коефіцієнт розширення. Кварцове скло витримує дію високих температур. Його використовують для виготовлення ртутних ламп та лабораторного посуду.
Внаслідок сплавлення оксиду Силіцію (IV) з поташем та оксидом свинцю (II) РbО одержують кришталь — важке скло, яке дуже заломлює світло.
Якщо частково замінити SiO2 на оксид бору (В2О3), утворюється боросилікатне скло, яке характеризується більшою стійкістю і меншою чутливістю до різкої зміни температур.
Кольорове скло виготовляють, додаючи до вихідної суміші різи: речовини. Невелика кількість оксиду кобальту (II) СоО забарвлює його в синій колір, оксиду хрому (III) Сr2О3 - у зелений, оксиду заліза (II) - у брудно-зелений, оксиду міді (І) Сu2О - у червоний. Внаслідок додавання до вихідної суміші золота утворюється рубінове скло, яке пропускає тільки червоні промені.
Скло стійке до дії води та кислот, але при тривалій дії на звичайне скло вода частково вимиває з поверхні іони натрію. Луги при тривалій дії помітно роз'їдають скло. Плавикова кислота руйнує скло.
Скло має близький коефіцієнт термічного розширення до металів, тому може застосовуватись у збірних конструкціях з металами.
Із скляних волокон виготовляють тканини, які використовують для тепло та електроізоляції, а також як кислототривкий матеріал.
Приклад 1. Які загальнофізичні і хімічні властивості характерні для неметалічних елементів?
Розв’язання. До неметалів відносяться B, C, Si, Ge, N, P, As, S, Sb, O, Se, а також р-елементи груп періодичної системи Д.І. Менделєєва. Для простих речовин – неметалів характерний ковалентний зв'язок. Молекули інертних газів одноатомні, що обумовлено завершеністю їх електронної структури (ns2 чи ns2np6).
Найменші температури правління і кипіння мають прості речовини з молекулярною структурою. Неметали в твердому стані є діелектриками. Ряд р-елементів III та IV А груп (В, Gа, Si, Ge, As, Se ) виявляє напівпровідникові властивості.
Хімічна активність неметалів визначається умовами протікання реакцій. При збільшенні атомного номера відновна активність збільшується, а окислювальна - зменшується. Неметали стійкі до дії розчинів кислот – не окисників, так як є кислотоутворюючими елементами. У водних розчинах лугів вони диспропорціонують. Неметалічні елементи в сполуках з негативним ступенем окислення виявляють відновну активність.
Внаслідок сплавлення оксиду силіцію(IV) з поташем та оксидом свинцю (II) РbО одержують кришталь — важке скло, яке дуже заломлює світло.
Якщо частково замінити SiO2 на оксид бору (В2О3), утворюється боросилікатне скло, яке характеризується більшою стійкістю і меншою чутливістю до різкої зміни температур.
Кольорове скло виготовляють, додаючи до вихідної суміші різи: речовини. Невелика кількість оксиду кобальту (II) СоО забарвлює його в синій колір, оксиду хрому (III) Сr2О3 - у зелений, оксиду заліза (II) - у брудно-зелений, оксиду міді (І) Сu2О - у червоний. Внаслідок додавання до вихідної суміші золота утворюється рубінове скло, яке пропускає тільки червоні промені.
Скло стійке до дії води та кислот, але при тривалій дії на звичайне скло вода частково вимиває з поверхні іони натрію. Луги при тривалій дії помітно роз'їдають скло. Плавикова кислота руйнує скло.
Скло має близький коефіцієнт термічного розширення до металів, тому може застосовуватись у збірних конструкціях з металами.
Із скляних волокон виготовляють тканини, які використовують для теплота електроізоляції, а також як кислототривкий матеріал.
Приклад 1. Які загальнофізичні і хімічні властивості характерні для неметалічних елементів?
Розв’язання. До неметалів відносяться B, C, Si, Ge, N, P, As, S, Sb, O, Se, а також р-елементи груп періодичної системи Д.І. Менделєєва. Для простих речовин – неметалів характерний ковалентний зв'язок. Молекули інертних газів одноатомні, що обумовлено завершеністю їх електронної структури (ns2 чи ns2np6).
Найменші температури правління і кипіння мають прості речовини з молекулярною структурою. Неметали в твердому стані є діелектриками. Ряд р-елементів III та IV А груп (В, Gа, Si, Ge, As, Se ) виявляє напівпровідникові властивості.
Хімічна активність неметалів визначається умовами протікання реакцій. При збільшенні атомного номера відновна активність збільшується, а окислювальна - зменшується. Неметали стійкі до дії розчинів кислот – не окисників, так як є кислотоутворюючими елементами. У водних розчинах лугів вони диспропорціонують. Неметалічні елементи в сполуках з негативним ступенем окислення виявляють відновну активність.
Приклад 2. Масова доля натрію в інтерметалічнії сполуці з оловом 20,5%. Визначте формулу сполуки.
Розв’язання. Вміст натрію в інтерметалічнії сполуці з оловом 100 -20,5 =79,5 %.
Кількість речовин n(Na) та m(Sn) моль, визначаємо із врахуванням відносної атомної маси:
![]()
![]()
Відношення кількостей речовин Na і Sn, що входять в склад інтерметалу n(Na):m(Sn) = 0,89:0,67. Розділивши праву частину рівності на 0,67, отримуємо
n(Na):m(Sn) = 1,33:1
Перейшовши до цілих чисел маємо n(Na):m(Sn) = 4:3.
Отже, формула інтерметалічної сполуки Na4Sn6.
