- •Методичні вказівки
- •12. Хімія неметалічних елементів
- •12.1. Загальна характеристика неметалів
- •12.2. Карбон та його неорганічні сполуки
- •12.3. Силіцій та його сполуки
- •12.4. Запитання та задачі для самоконтролю
- •13. Твердість води
- •13.1. Магній, Кальцій та їхні сполуки
- •13.2. Твердість води та методи її усунення
- •13.3. Запитання та задачі для самоконтролю
- •14. Неорганічні в'яжучі речовини
- •14.1. Загальні властивості
- •14.2. Гіпсові в'яжучі речовини
- •14.3. Вапняні в'яжучі речовини
- •14.4. Портландцемент
- •14.5. Корозія бетону. Методи захисту бетону від корозії
- •14.6. Запитання та задачі для самоконтролю.
- •15. Органічні сполуки
- •15.1. Загальна характеристика
- •15.2. Теорія хімічної будови органічних сполук о.М.Бутлерова
- •5.3.Класифікація
- •15.4. Номенклатура
- •15.5. Органічні полімерні матеріали в будівництві
- •15.5.1. Загальна характеристика
- •15.5.2. Класифікація
- •15.5.3. Методи одержання полімерів
- •15.5.4. Будова і властивості полімерів
- •15.5.5. Bикористання полімерних матеріалів у будівництві
- •15.6. Запитання та завдання для самоконтролю
- •Література
15.2. Теорія хімічної будови органічних сполук о.М.Бутлерова
Науковим фундаментом сучасної теорії будови хімічних сполук стала структурна теорія (або теорія будови органічних сполук), яка була розроблена в другій половиш XIX століття і в яку величезний внесок зробила наукова школа російського хіміка О.М.Бутлерова.
Суть цієї теорії зводиться до таких основних положень:
1. Атоми розташовані в молекулах не безладно, а сполучені один із одним хімічними зв'язками в певній послідовності відповідно до їхніх валентностей.
Ця послідовність називається хімічною будовою. Хімічну будову можна зобразити структурною формулою, в якій хімічні зв'язки між атомами зображуються рисками.
2. Властивості речовин залежать не тільки від їхнього якісного та кількісного складу, але й від хімічної будови молекул.
Це означає, що ізомери (речовини з однаковим складом, але різною будовою) мають різні властивості. Наприклад, етанол та диметиловий ефір.
СН3 — CH2 — OH СН3 — О — СН3
Етанол диметиловий ефір
3. За властивостями даної речовини можна визначити будову її молекули, а за будовою молекули передбачити її властивості.
4. Атоми або групи атомів у молекулах взаємно впливають один на одного, безпосередньо або через інші атоми. Так, у молекулі оцтової кислоти СН3СООН атом водню в групі СООН може відщеплюватися в водному розчині в вигляді іону Н+, а атом водню в групі СН3 міцно зв'язаний з атомом-вуглецю і не може відщеплюватися у вигляді іона.
Квантово-механічні уявлення про будову атомів і молекул блискуче підтвердили і поглибили основні положення цієї теорії.
Вуглець в усіх органічних сполуках чотиривалентний. Відповідно до сучасних електронних уявлень хімічний зв'язок виникає за рахунок неспарених електронів атома. Атом вуглецю при утворенні органічної сполуки переходить у збуджений стан:
C(1s22s22p2)→C*(1s22s12p3).
Чотири орбіталі атома вуглецю, що мають неспарені електрони, дають можливість атому утворити чотири ковалентні зв'язки, тобто бути чотиривалентним в сполуках. Усі чотири зв'язки, які утворює вуглець, абсолютно рівноцінні. Це пояснюється тим, що в момент утворення зв’язків відбувається гібридизація (змішування та вирівнювання орбіталей за формою і енергією) атомних s- і р- орбіталей з утворенням чотирьох однакових гібридних орбіталей.
Для атома вуглецю можливі три валентних стани з різними типами гібридизації: sp3 -, sp2 -, sp - гібридизація.
Атоми вуглецю здатні з'єднуватися один із одним одинарним зв'язком (— C — C —; sp3- гібридизація, валентні кути 109°28'); подвійним (— С = С —; sp2 - гібридизація, валентні кути 120°) і потрійним зв'язком (— С ≡ С —; sp- гібридизація, валентний кут 180°), утворюючи прямі, розгалужені і замкнуті ланцюги.
5.3.Класифікація
Залежно від будови вуглецевого ланцюга органічні сполуки поділяють на ациклічні й циклічні.
Ациклічними є сполуки, молекули яких складаються з відкритих (незамкнених) вуглецевих ланцюгів - прямих або розгалужених:

прямий ланцюг розгалужений ланцюг
Ациклічні сполуки називають аліфатичними або сполуками жирного ряду. їх поділяють на насичені та ненасичені. Сполуки з простими (одинарними) δ-зв'язками (С — С) є насиченими, а з кратними δ+π-зв'язками (С = С, С ≡ С) - ненасиченими.
Циклічними
називають сполуки, молекули яких
складаються з замкнених у кільця
вуглецевих ланцюгів. Циклічні сполуки
поділяють на карбоциклічні (цикли
містять тільки атоми вуглецю) і
гетероциклічні (цикли містять, крім
атомів вуглецю, атоми інших елементів
— кисню, азоту, сірки тощо:).
карбоциклічна сполука гетероциклічна сполука
Ациклічні й циклічні сполуки поділяють на класи за функціональними групами. Функціональними називають групи атомів що надають речовинам певних хімічних властивостей. Вихідним класом при такій класифікації є сполуки вуглецю з воднем - вуглеводні. Шляхом заміщення водневого атому в вуглеводнях на функціональну групу можна перейти до будь-якого класу сполук.
Будь-який клас органічних сполук можна зобразити загальною формулою R-X, де X - функціональна група, R - радикал (залишок вуглеводня, який утворюється, якщо від молекули відняти один атом водню).
Наприклад: СН4 - метан; СН3 - радикал «метил»; С2Н6 - етан; С2Н5 - радикал «етил». Найважливіші класи органічних сполук наведені в таблиці 15.1.
Таблиця 15.1.
Найважливіші класи органічних сполук
Клас сполук |
Функціональні групи |
|||
Назва |
Загальна формула |
Приклад сполук |
Назва |
Формули |
Вуглеводні |
СnHm або R·N |
CH4, C2H6, C2H2, C6H6 |
— |
— |
Галагенопо-хідні вуглеводнів |
R - нal |
CH3Сl, C2H4Cl |
Галогени |
-F, -CL, -Br, -I |
Спирти феноли |
R - OH |
CH3OH |
Гідрок-сильна (гідроксил) |
-OH |
Альдегіди |
|
|
Альдегідна |
|
Кетони |
|
|
Корональна (карбоніл) |
|
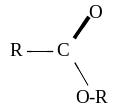
Карбонові кислоти |
|
|
Карбо ксильна (карбо ксил) |
|
Складні ефіри |
|
|
Складно ефірна |
|
Нітросполу-ки |
R – NO2 |
CH3 – NO2 C6H5 – NH2 |
Нітро група |
-NO2 |
Аміни (первинні) |
R – NH2 |
CH3 – NH2 C6H5 – NH2 |
Аміно група |
-NH2 |
Сульфо-кислоти |
R – SO3H |
CH3 – SO3H C6H5 – SO3H |
Сульфо група |
-SO3H |
Кожний клас сполук утворює гомологічні ради. Гомологічний ряд - це ряд сполук, у якому кожний наступний представник відрізняється від попереднього на групу атомів - СН2, яка називається гомологічною різницею. Гомологічний рад кожного класу зображується загальною формулою. Наприклад, насичені вуглеводні мають загальну формулу CnH2n+2.
СН4 - метан; С6Н14 - гексан;
С2Н6 - етан; С7Н16 - гептан;
С3Н8 - пропан; С8Н18 - октан;
С4Н10 - бутан; С9Н20 - нонан;
С5Н12 - пентан; С10Н22 - декан.
Ізомерія. Усі класи органічних сполук утворюють ізомери. Розрізняють структурну і просторову ізомерію. Структурна ізомерія може бути обумовлена:
а)різним порядком сполучення атомів вуглецю (ізомерія вуглецевого скелету)

б) різним положенням кратного зв'язку або функціональної групи (ізомерія положення)
![]()
в) належністю сполук до різних класів (міжгрупова ізомерія)

Просторова ізомерія обумовлена неоднаковим просторовим положенням різних замісників відносно подвійного зв'язку (геометрична або цис-транс-ізомерія). Вона характерна для сполук з подвійним зв'язком. Якщо одинакові замісники знаходяться по один бік подвійного зв'язку - це цис-ізомер, якщо по різні - це транс-ізомер.