- •Глава 2. Курс лекций
- •2.1. Оптические методы анализа
- •2.2. Рефрактометрический и поляриметрический методы анализа
- •2.3. Фотоколориметрические методы анализа
- •Люминесцентный анализ
- •Эмиссионный спектральный анализ
- •Методы атомной спектроскопии
- •1. Электрохимические и полярографические методы
- •2. Кондуктометрические методы исследований
- •Физико-химические методы разделения и концентрирования
Глава 2. Курс лекций
ВВЕДЕНИЕ
Физико-химические методы анализа – определение, цели и задачи. Предмет и объекты изучения. Классификация.
Все более нарастающий темп научно-технического прогресса, способствует увеличению энергетических вложений в технологические процессы производства продукции. Это способствует вовлечению в производство большое количество разнообразных компонентов, с различными физическими и химическими свойствами, которые в свою очередь воздействуют на конечный продукт.
Используемые новые интенсивные технологии возделывания культурных растений основаны, предполагают, эффективное использование минеральных удобрений, химических средств защиты растений и других материально-технических ресурсов, с четким соблюдением технологической дисциплины. При этом большое внимание уделяют организации производства на базе технологических процессов и схем, не нарушающих экологического равновесия в природе. Для выполнения контроля над всеми перечисленными выше факторами используется специальная аппаратура, требующая умелого обращения. Поэтому успех и широкое использование физико-химических методов анализа зависит от степени подготовки специалистов сельскохозяйственных вузов.
Физико-химические методы анализа это методы, объединяющие большое число количественных методов, основанных на измерении различных физических свойств химических соединений или простых веществ с использованием соответствующих приборов.
Собственно появление физико-химических методов как отдельной науки было заложено, трудами Д.И. Менделеева, Я.Х. Вант-Гофа, Н.С. Курнакова и других ученых, заключающихся в изучении соотношений между составом и свойствами химически равновесных систем.
Преимущество физико-химических методов анализа:
Селективность (выбор нужного компонента);
Спектральный, полярографический, масс-спекторомтерический и другие методы позволяют одновременно качественно определять десятки компонентов;
Возможность автоматизировать аналитический процесс;
Выполнять аналитический процесс не разрушая исследуемый объект даже в живом растении;
Значительно большая чувствительность и точность по сравнению с химическими.
Классификация физико-химических методов анализа
При рассмотрении классификации физико-химических методов анализа, следует детально остановиться на используемых физических свойств химических веществ. В зависимости от используемых свойств различают следующие группы физико-химических методов, детальная характеристика которых будет дана в соответствующих главах.
Оптические методы – это методы основанные на исследовании оптических свойств анализируемых систем, — фотометрические (колориметрия, фотоколориметрия, нефелометрия, турбидиметрия и др.), рефрактометрический, поляриметрический, люминесцентный, спектральный (эмиссионный спектральный анализ, атомно-абсорбционная фотометрия и др.);
Электрохимические методы– это методы основанные на исследовании электрохимических свойств анализируемых систем, — электролитический, кондуктометрический, потенциометрический, полярографические (полярография, инверсионная хронопотенциометрия, амперметрическое титрование и др.);
Физико-химические методы разделения и концентрирования – это методы основанные на разделении веществ, за счет физических свойств различных анализируемых систем экстракция, ионный обмен, хроматография, диализ, электрофорез и др.
Для получения более достоверных данных в технологических условиях производства сельскохозяйственной продукции особое значение приобретает чистота веществ, чистота химических реактивов и метрологические особенности используемых приборов и инструментов в физико-химических методах анализа.
Чистота вещества и ее значение для результатов анализа
В данном разделе студент должен уяснить для себя, что при анализе объекта на содержание микроэлементов, следов и микроследов веществ первостепенное значение приобретает чистота используемых реактивов. Чистые вещества имеют одинаковый состав и проявляют одинаковые свойства независимо от происхождения и тем самым отличаются от смесей. Вещества, используемые в химических лабораториях, имеют различную чистоту, студент обязан свободно оперировать своими знаниями при определении химической чистоты реактивов.
Примеси, входящие в состав реактивов, принято разделять на три группы:
микроконцентрации, к которым относят содержание примеси в пределах 10-2...l0-5% (от 100000 до 100 частей на миллиард, или ppb, по международной системе единиц);
ультрамикроконцентрации, которым отвечает диапазон 10-5...10-8% (100...0,1 ppb, по международной системе единиц);
субмикроконцентрации, содержание 10-8...10-11% примеси (0,1...10-4 ppb, по международной системе единиц).
В первом случае обычно определяют количество примеси в микрограммах (1 мкг=10 -6г), во втором — в нанограммах (1 нг = = 10 -9 г), в третьем — в пикограммах (1 пг=10 -12г).
В последнее время установился термин следы, что соответствует количеству примесей 10-1...10-3%, микроследы — 10-3...10-6%; ультрамикроследы — 10-6...10-9% и субмикроследы — менее 10-9%. Вещества с содержанием -примесей 10-7...10-9%, по предложению Б. Д. Степина, называют особо чистыми веществами.
Наряду с прежней классификацией веществ и реактивов по маркам Ч. - чистые, Ч.Д.А. – чистые для анализов, Х.Ч.- химически чистые, О.Ч. –очищенные, ОС.Ч. - особо чистые, В.ОЧ. – высшей очистки применяют классификацию их по классам. По современной классификации особо чистых материалов вещества делят на три класса: А, В и С, которые, в свою очередь, делят на подклассы. Например, вещество подкласса А 1 содержит 99,9% основного вещества, а подкласса А 2 — 99,99%. Таким образом, цифра после буквы обозначает число девяток после занятой. Вещества класса В делят на четыре подкласса: 3, 4, 5 и 6 с содержанием примесей соответственно 10-3...10-6%. Материалы класса С содержат 10-7...10-10%- примесей, и их также подразделяют на четыре подкласса.
Классификация чистых веществ базируется на использовании для их анализа групп аналитических методов, различающихся чувствительностью. В класс А входят вещества, в которых можно непосредственно определять содержание основного компонента (основы), а примеси анализировать химическими методами. В классе В представлены вещества, в которых непосредственно определяют только примеси, причем спектральными или физико-химическими методами. Анализ же примесей в веществе класса С возможен лишь при помощи методов высшей чувствительности: электрических измерений, радиоактивационного, кинетического анализа и др.
Количества вещества, содержащего основу и примеси, связаны с массой. По международной системе единиц СИ (The International System of Units, SI), принятой в СССР с 1 января 1963 г., единица массы — килограмм. В аналитической химии массу обычно выражают в граммах или миллиграммах (1 мг = 10-3 г). Для меньших частей применяют десятичные приставки: микрограмм (1 мкг = 10-6 г), нанограмм (1 нг = 10-9 г).
Чувствительность аналитических методов
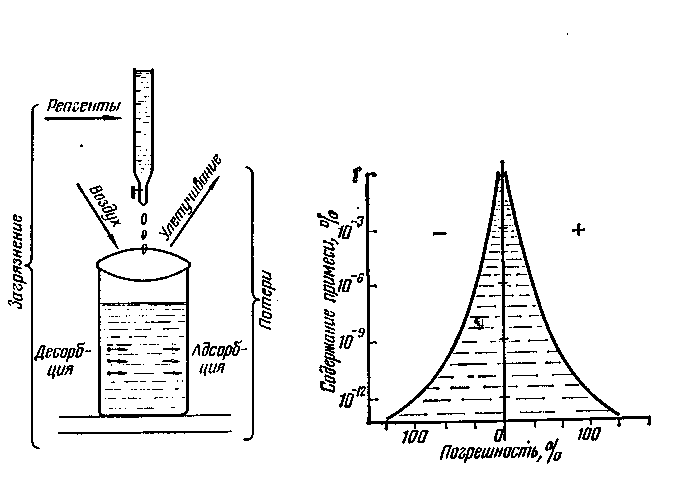
При выборе метода обнаружения и количественного определения малых количеств примесей, следует знать чувствительность используемого метода, которая показывает минимальные пределы содержания элемента на единицу массы анализируемого вещества или на единицу объема раствора. Чувствительность аналитического метода нередко лимитирует величина поправки в контрольном (холостом) опыте, которая зависит от содержания примесей в применяемых реагентах, от примесей, попадающих в контрольное вещество из окружающей среды, а также от потерь в ходе анализа. Наиболее типичные пути загрязнения при анализах: внесение примеси с реагентами. Адсорбирующимися из воздуха и десорбирующимися со стенок лабораторной посуды. Наиболее наглядно степень загрязнения и потери при проведении анализа показаны на рисунке 1.
Для получения достоверных результатов особое значение имеют методы отбора и подготовки проб к анализу. Методы пробподготовки должны быть подобраны с учетом используемого метода и чувствительности выбранного метода. Следует перед началом проведения анализа тщательно очистить посуду, реагенты и вещества, применяемые в анализе. Чтобы устранить возможность попадания загрязнения извне, анализы выполняются в вытяжных или химических шкафах герметично закрытых.
|
Рис. 1. |
Достигаемая чувствительность зависит также от квалификации аналитика и качества измерительной аппаратуры. Каждый прибор имеет свой собственный фон, который может повлиять на достоверность опыта, его следует принять во внимание. При несоблюдении данных правил при анализе веществ могут возникнуть различные погрешности, которые повлияют на достоверность полученных данных.
Виды, источники и характеристики погрешностей.
Оценка воспроизводимости и правильности анализа – необходимый этап при решении задач физико-химическими методами. Эти показатели существенно зависят от различных видов погрешностей при анализах.
В зависимости от источника и метода используемых при проведении анализа погрешности (ошибки) подразделяются на грубые (промахи), систематические и случайные.
Грубые ошибки возникают, как правило из-за невнимания и усталости исследователя. Обычно такие ошибки проявляются при записи измеренной величины на фоне результатов анализов других проб, например ошибка в порядке числа при определении фосфора (Р2 О5) в растительных образцах на КФК – 2, записано 27 вместо 0,27 и пр. Для устранения грубых погрешностей требуются повторные измерения. Еще одна разновидность грубой погрешности это промахи, которые допускаются из-за некомпетентности аналитика. Типичный пример промаха – ошибочный отбор аликвотной пробы в объемном анализе, когда пипетка, градуированная в двух сечениях, используется как пипетка, градуированная на полное вытекание (рис. 2).
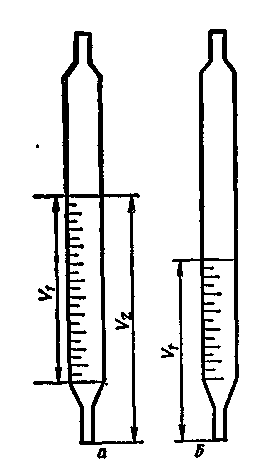
Рис. 2 Два способа градуировки пипеток:
V1 – правильно измеряемый объем;
V2 – не правильно взятый объем;
а - пипетка, градуированная в двух сечениях;
б - пипетка, градуированная на полное вытекание жидкости.
Систематические погрешности – это односторонние (по знаку) погрешности, вызванные неисправностью измерительного прибора и недостатком метода. Если величина систематической погрешности известна, то исключение ее не представляет трудности. Причины систематических погрешностей можно установить при детальном рассмотрении процедуры анализа. Например, при определении нитратного азота в растительных образцах был неправильно откалиброван прибор (иономер), это привело к заниженным показаниям нитратного азота в продукции.
Случайные погрешности в отличие от систематических не имеют видимой причины. Точнее говоря, причины их столь многочисленны и каждая из них столь незначительно влияет на общий результат анализа, что отдельно их не рассматривают.
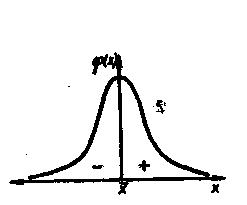
Общая случайная погрешность непостоянная ни по абсолютному значению, ни по знаку, но появление существенной случайной ошибки вероятно для каждого анализа. Но случайные погрешности подчиняются статистическому закону «нормальный закон распределения» (К. Гаусс). Из закона следует: чем больше ошибка, тем реже она встречается, а положительные ошибки также вероятны, как и отрицательные (рис. 3)
|
Рис. 3 Кривая плотности вероятности нормального распределенной случайной величины: х- среднее значение; φ(х) – относительная вероятность измерения х |
Для характеристики качества анализа рекомендуется использовать количественно определяемые понятия правильность и воспроизводимость, а термин точность оставлен как качественное понятие, характеризующее и правильность
Случайные погрешности нельзя устранить. Их только можно и нужно свести к минимуму. Чем больше случайный разброс данных при анализе, тем больше должно быть определений. Усреднение последних даст результат измерений, наиболее близкий к истинному, и соответственно меньше будет вероятность близости единичного результата измерений к истинному значению. Погрешности могут возникнуть на всех этапах выполнения анализа. При отборе пробы, например, появляются случайные погрешности, связанные с негомогенностью вещества (гетерогенные фазы) или градиентом концентраций (гомогенные фазы). Перечисленных погрешностей нельзя полностью избежать даже при правильном отборе пробы.
Различают три вида систематических погрешностей. Аддитивные погрешности возникают, если, например, не учитывают расход реагентов на холостую пробу и др. Причиной появления погрешностей другого вида — мультипликативных — служит, например, неверный титр, неправильно проведенная градуировка. К третьем виду относятся погрешности, нелинейно связанные с изменяемой величиной. Причины их появления многообразны и должны быть определены в каждом конкретном случае.
Точность метода анализа — довольно сложная его характеристика, в которой необходимо различать две стороны: воспроизводимость и правильность. Воспроизводимость измеряют отклонением отдельных результатов от среднего значения, правильность — отклонением среднего значения содержания от истинного. Все приведенные виды погрешностей определенным образом влияют на достоверность полученных данных, и усложняют их статистическую обработку.
ОФОРМЛЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА
Статистическая обработка результатов наблюдений.
Осуществление любых поставленных задач перед аналитиком, в том числе и определений физико-химическими методами, почти всегда предполагает не одно, а ряд повторных исследований, результаты которых будут пригодны для дальнейшей статистической обработки. Отдельные измерения всегда отличаются друг от друга, и разброс их определяет точность анализа и характеризуется случайной погрешностью наблюдения. Среднее значение полученного результата по разным причинам может отличаться от истинного. Разница между ними определяет правильность определения и представляет собой систематическую погрешность, которая повторяется от опыта к опыту. Поэтому проводимые исследования должны быть воспроизводимыми для проверки и подтверждения данных.
Оценка воспроизводимости результатов измерений
Предполагается, что выборка имеет приближенно нормальный закон распределения. Отклонение от гауссовского (закон Гаусса) распределения могут иметь место, особенно при определении следовых содержаний компонентов. При этом возможно логарифмическое нормальное распределение. При необходимости следует провести проверку нормальности распределения.
Среднее выборки. Пусть х1, х2, ..., хn обозначают n результатов измерений величины, истинное значение которой μ. Предполагается, что все измерения проделаны одним методом и с одинаковой тщательностью. Такие измерения называют равноточными.
В теории ошибок доказывается, что при условии выполнения нормального закона (закона распределения Гаусса) при n измерениях одинаковой точности среднее арифметическое из результатов, полученных при всех измерениях, является наиболее вероятным и наилучшим значением измеряемой величины:
__ х = |
х1+х2+…+хi+…+хn |
= |
1 |
|
n |
n |
Это среднее значение принимают за приближенное и пишут х ≈ μ.
_ εi = хi - х |
Алгебраическая сумма единичных отклонений равна нулю:
![]() εi
= 0
εi
= 0
Дисперсия, стандартное отклонение, относительное стандартное отклонение. Рассеяние результатов измерений относительно среднего значения принято характеризовать дисперсией s2:
s2 = (хi – х*)2 /(n - 1),
или стандартным отклонением (средним квадратическим отклонением — СКО) - s:
s
=
![]() (
хi
– х*)2
/(n
- 1),
(
хi
– х*)2
/(n
- 1),
которое обычно и приводят при представлении результатов измерений (анализа) и которым характеризуют их воспроизводимость. Стандартное отклонение, деленное на среднее выборки, называют относительным стандартным отклонением:
sr = s / x*
В общем случае метод (методика) анализа оптимален в тон области содержаний, в которой и абсолютное (s), и относительное (sr) стандартные отклонения имеют минимальные значения.
Дисперсия среднего арифметического (выборки), стандартное отклонение среднего арифметического (выборки). При оценке воспроизводимости полученных результатов вычисляют также дисперсию среднего арифметического:
s2x*= (хi – х*)2 /[ n (n - 1)],
и стандартное отклонение среднего арифметического:
s
= s/![]() (
хi
– х*)2
/[ n
(n
- 1)],
(
хi
– х*)2
/[ n
(n
- 1)],
Оценка правильности результатов измерений (определений)
После того как осуществлена проверка погрешностей (в случае подозрительных результатов измерений) и их исключение, производят оценку доверительного интервала (М) для среднего значения х, интервальных значений х±.&х и при необходимости — оценку правильности результатов. V
Доверительный интервал (Дх). Если воспроизводимость результатов измерений (методики анализа) характеризуют стандартным отклонением, то сами результаты измерений (определений) характеризуют доверительным интервалом среднего значения AJc, который рассчитывают Доспехов
Графическая обработка результатов.
При обработке результатов физико-химических измерений широко применяют методы графического изображения и анализа.
Графический метод дает более наглядное представление о взаимной связи между изучаемыми величинами и позволяет непосредственно осуществлять измерительные и вычислительные операции (интерполяция, экстраполяция, дифференцирование, интегрирование). Причем можно сделать это (зачастую с достаточно высокой точностью), не прибегая к расчетам, которые могут оказаться сложными и трудоемкими, а подчас и невозможными из-за того, что некоторые зависимости не всегда можно выразить в математической форме. Чертежи облегчают сравнение величин, помогают непосредственно обнаружить точки перегиба (например, при титровании), максимумы и минимумы, условия наибольших и наименьших скоростей изменения величин, периодичность и другие особенности, которые ускользают при записи результатов в уравнениях и недостаточно отчетливо проявляются в таблицах.
Известно, например, что исторически метод физико-химического анализа основан именно на построении диаграмм. Которые позволяют, в частности, установить степень устойчивости химического соединения, величину и характер отклонения свойств раствора от идеального и т. д. Кроме того, при помощи графика часто можно определить, существует ли какая-либо зависимость между измеренными величинами, а при ее наличии иногда найти и математическое выражение такой зависимости. Рассмотрим сущность графического метода обработки опытных данных для двух переменных, т. е. для зависимости
y = f (x)
иллюстрируя его на ряде примеров, взятых из материалов физико-химических измерений.
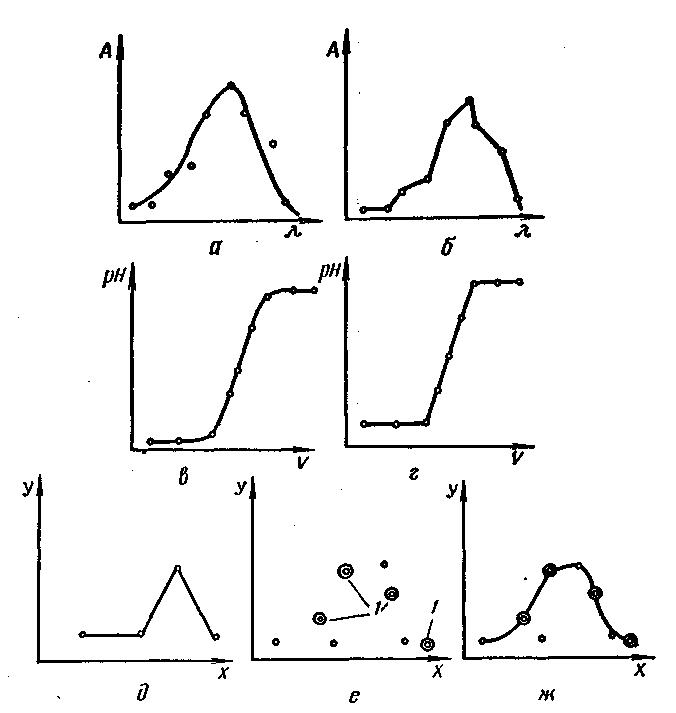
При графической обработке экспериментальных данных обычно применяют прямоугольную систему координат. На график наносят совокупность значений х и у (х1 и у1, x2 и y2, x3 и y3 и т. д.), причем по оси абсцисс — значения независимой переменной х, а по оси ординат — значение функции у. Через полученные таким образом точки проводят плавную кривую, для чего обычно используют лекало. Если на один график наносят несколько кривых, то точки на каждой из них (особенно, если эти кривые накладываются друг на друга) целесообразно пометить различными значками (рис. 4).
Так как результаты опыта в той или иной степени неточны, всегда будет наблюдаться разброс точек. В связи с этим кривую следует проводить так, чтобы она проходила возможно ближе ко всем нанесенным точкам (рис. 4,а, б). Цели координаты точек на концах кривой выходят за пределы надежности измерений или примененного метода, их отклонение от кривой может оказаться значительным; в подобных случаях конечные точки учитывают меньше остальных. При обнаружении точек, значительно удаленных от кривой, эксперимент в этой области х и у необходимо повторить. Если повторение дает результаты, соответствующие точкам, лежащим вблизи кривой, то первоначально полученные данные считают ошибочными. Если найденные данные подтвердятся, это будет свидетельствовать об изменении характера зависимости в повторно исследованной области.
|
Рис. 4. Проведение кривых через экспериментальные точки: а, в, ж – правильно; б, г, д, е – неправильно; ● – дополнительные точки, полученные при эксперименте. |
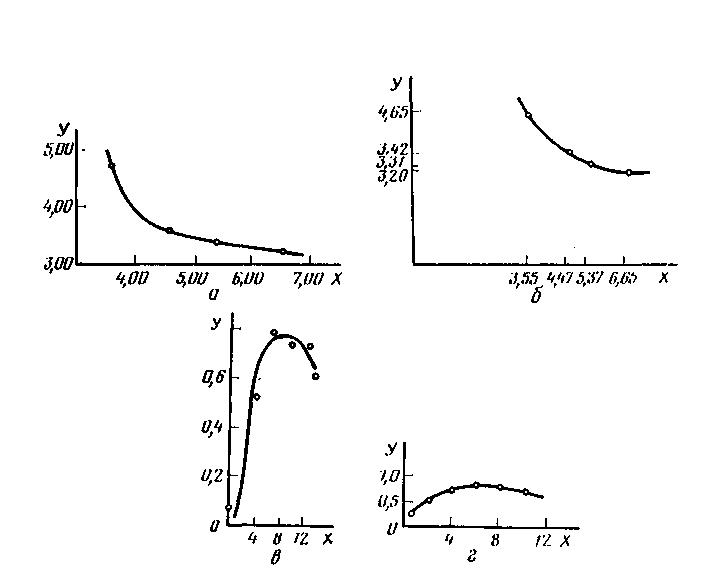
Соотношение в масштабах по координатным осям выбирают так, чтобы кривая не была очень крутой или же очень пологой, т.е. слишком сжатой по одной оси и излишне растянутой по другой (рис. 5). При несоблюдении этого условия изображенные на этом графики зависимости окажутся менее наглядными (в частности, менее отчетливыми будут экстремальные участки кривых), уменьшиться точность отсчета по чертежу (в частности небольшая ошибка в значении одной из величин может привести к большей погрешности в другой), уменьшиться надежность различных вычислительных операций.
|
Рис. 5. Примеры правильно (а) и неправильно (б, в, г) выбранных масштабов |
|
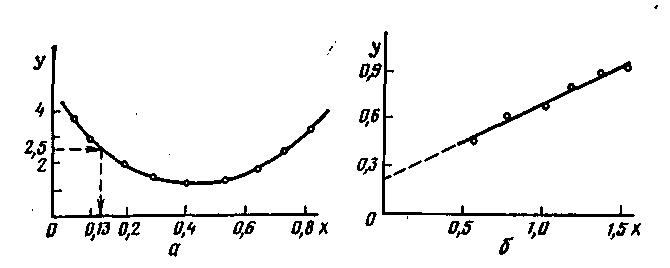
Рис. 6 Примеры графической интерполяции (а) и экстраполяции (б) |
Во всех случаях, кроме тех, когда точность, определяемая масштабами на осях координат, резко различается, желательно, чтобы линия графика была наклонена к оси абсцисс под углом, близким к 45○. При этом условии отклонение нанесенных точек от линии графика будут наиболее заметны и ее можно будет провести через эти точки наиболее точно. Обычно по оси абсцисс откладывают величины количественного состава вещества, а на оси ординат показания прибора.
При обработке данных графическим методом используют геометрические действия интерполяция и экстраполяция.
Графически интерполируют (рис. 6, а), непосредственно отщитывая по чертежу (с учетом его масштаба) значения y при заданном значении х (или х при данном y) в тех пределах, в которых произведены измерения.
Экстраполяцию проводят посредством продолжения кривой за пределы опытных данных (рис. 6, б). Надежный результат получается, если можно считать, что изученная зависимость справедлива и вне области произведенных измерений.
Примером графической экстраполяции служит нахождение точки нейтрализации при кондуктометрическом титровании.