Учебник Органическая химия Щеголев 2016
.pdf
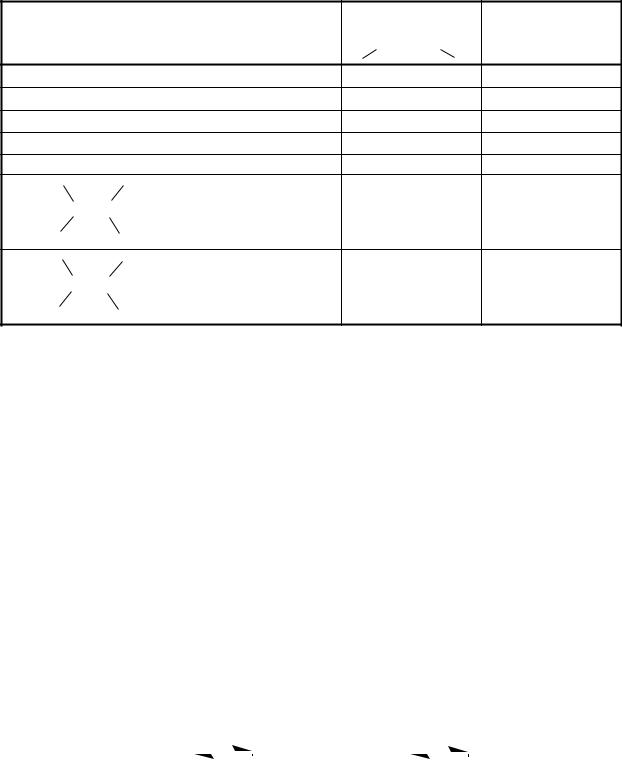
Таблица 6.4 Тривиальные названия непредельных монокарбоновых кислот и их производных
|
|
|
Название |
Название ацила |
Название |
|
Формула кислоты |
O |
ацилата |
||||
кислоты |
||||||
|
|
|
R C |
- |
||
|
|
|
|
R-CОО |
||
|
|
|
|
|
||
СH2=СН-COOH |
акриловая |
акрилоил |
акрилат |
|||
CH3 |
метакриловая |
метакрилоил |
метакрилат |
|||
|
|
|
||||
CH2=C-COOH |
||||||
|
|
|
||||
H3C |
H |
|
|
|
||
C=C |
кротоновая |
кротоноил |
кротоноат |
|||
H |
COOH |
|
|
|
||
H |
H |
|
|
|
||
C=C |
изокротоновая |
изокротонил |
изокротонат |
|||
H3C |
COOH |
|
|
|
||
CH C-COOH |
пропиоловая |
пропиоил |
пропиолат |
|||
H |
H |
|
|
|
||
C=C |
|
|
|
|||
(H2C)7 |
(CH2)7-COOH |
олеиновая |
олеил |
олеат |
||
|
|
|
||||
CH3 |
|
|
|
|
||
CH3 |
|
|
|
|||
(H2C)7 H |
элаидиновая |
элаидиноил |
элаидиноат |
|||
C=C |
||||||
|
|
|
||||
H |
(CH2)7-COOH |
|
|
|
||
H |
H |
|
|
|
||
C=C
(CH2)7-COOH
H2C линолевая линолеил линолеат
(CH2)4-CH3
|
|
|
C=C |
|
|
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
C=C |
|
|
|
|
|
|
|
|
|
H |
C |
CH2 |
(CH2)7-COOH |
|
|
|
||||||
|
|
|
|
|
|
|
|
линоленовая |
линоленоил |
линоленоат |
||
|
|
|
|
|
|
|
|
|
|
|||
|
C |
CH2 |
C H |
|
|
|
|
|
|
|
||
H |
|
|
5 |
|
|
|
|
|
|
|||
|
|
C=C |
2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
C=C |
|
|
|
|
|
|
|
|
|
H |
|
CH |
(CH2)3-COOH |
|
|
|
||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
C |
|
H3C-(H2C)4 H |
арахидоновая |
арахидоноил |
арахидоноат |
||||||
|
|
|
|
|||||||||
H |
C |
CH2 |
|
|
C |
|
|
|
||||
|
|
|
|
|
|
|
|
|||||
|
|
CH |
|
C |
|
|
|
|||||
|
|
|
C=C |
2 |
|
|
H |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
301 |
|
|

6.5.2.СТРОЕНИЕ
Вмолекуле акриловой кислоты
|
|
|
|
O |
||
CH2 |
= CH |
|
C |
= |
|
|
|
O |
|
H |
|||
|
|
|
|
|
||
|
|
|
|
, |
||
так же, как и в молекулах других , -ненасыщенных карбоновых кислот (например, метакриловой, кротоновой, пропиоловой), имеется - -сопря- жѐнная система. За счѐт этого происходит поляризация C=С-связи. У непредельных кислот, в которых кратная углерод-углеродная связь отделена от карбоксильной группы насыщенным атомом углерода, сопряжения не происходит, и взаимодействие C=С-связи и СООН-группы возможно только посредством индуктивного эффекта.
6.5.3. ХИМИЧЕСКИЕ СВОЙСТВА
Непредельные кислоты, в которых кратная связь удалена от карбоксильной группы, обладают всеми свойствами алкенов (алкинов) и карбоновых кислот. Наличие сопряжѐнного фрагмента в молекулах , -не- насыщенных кислот приводит к некоторым особенностям химического поведения таких соединений.
6.5.3.1. Кислотность
Кислоты с - -сопряжѐнным фрагментом являются более сильными кислотами по сравнению с насыщенными. Значение рКа для акриловой кислоты 4.25 (сравните: для пропионовой — 4.87, для уксусной — 4.76). Это объясняется устойчивостью аниона кислотного остатка непредельной кислоты, в котором отрицательный заряд делокализован с участием -электронов двойной (или тройной) углерод-углеродной связи:
|
|
|
|
|
|
|
1/2- |
|
|
|
|
O . |
|
|
|
O |
|
|
|
|
O |
|
|
|
- |
|
|
|
= |
|
|
|
|
|
- |
|
|
|
|
||
CH =CH |
|
C |
|
CH =CH |
|
C |
1/2 |
|
|
CH |
CH=C |
O . |
|
|
|
|
|
||||||||||
2 |
|
O- |
2 |
|
|
O |
|
2 |
|
||||
6.5.3.2. Реакции присоединения
Реакции присоединения непредельных кислоты аналогичны непредельным альдегидам и идѐт преимущественно по нуклеофильному пути, хотя реакция может начинаться при электрофильном содействии протона. Таким
302
образом, они легко взаимодействуют со многими полярными системами, при этом отрицательная часть реагента присоединяется к -углеродному атому. Например:
|
|
|
|
HBr |
|
O |
|
|
O |
|
= |
||
|
|
|
|
BrCH2-CH2-C |
|
|
|
|
= |
|
|
|
|
CH2=CH |
|
C |
|
|
|
OH |
|
|
|
||||
|
|
OH |
|
|
|
|
|
|
|
|
H2O |
|
O |
|
|
|
|
|
= |
|
|
|
|
|
|
HO-CH2-CH2-C |
|
|
|
|
|
|
|
OH |
|
|
|
|
C2H5OH |
|
O |
|
|
|
|
|
= |
|
|
|
|
|
|
C2H5O-CH2-CH2-C |
|
|
|
|
|
|
|
OH |
|
|
|
|
NH3 |
|
O |
|
|
|
|
|
|
= |
|
|
|
|
|
H2N-CH2-CH2-C |
|
|
|
|
|
|
|
OH |
6.5.3.3. Реакции радикального замещения
В реакции радикального замещения должны легко вступать полиненасыщенные карбоновые кислоты, в молекулах которых двойные (или тройные) связи разделены одним насыщенным атомом углерода. К таким соединениям относятся и некоторые высшие непредельные кислоты, имеющие очень большое значение для жизнедеятельности организмов, такие как линолевая, линоленовая, арахидоновая (табл. 6.4). В результате отрыва атома водорода от метиленовой группы, расположенной между двойными связями, образуется свободный радикал, стабилизированный -р- -сопряжением (подчѐркнуто). Например:
CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH + X
CH3-(CH2)4-CH=CH-ĊH-CH=CH-(CH2)7-COOH + HX
Образование таких радикалов связано с регулированием биологического окисления в организмах.
6.5.4. СПОСОБЫ ПОЛУЧЕНИЯ
Для получения ненасыщенных карбоновых кислот можно использовать такие же способы, что и для насыщенных кислот, а также способы образования кратной связи в молекулах насыщенных соединений.
303
Акриловая кислота и еѐ производные применяются в промышленности полимерных материалов, в частности, полиакрилонитрил — основа волокна нитрон, используемого для производства лечебного белья
-CH2-CH- CN n
полиакрилонитрил,
а также как исходные вещества для разнообразных органических синтезов. Метакриловая кислота — бесцветная жидкость с температурой кипе-
ния 160 С.
Впромышленности метакриловую кислоту и еѐ производные получают присоединением циановодорода к ацетону.
Впромышленности полимерных материалов применяется еѐ метиловый эфир для получения полиметилметакрилата (плексигласа). Полиметилметакрилат — прозрачный пластический материал, обладающий значительной механической прочностью и устойчивостью к действию химических реагентов. Его мировое производство превышает 1 млн т в год и будет в дальнейшем существенно расти.
Олеиновая кислота — маслянистая бесцветная жидкость с температу-
рой кипения 223 С при 13.3 кПа; в виде сложных эфиров глицерина входит в состав растительных масел (особенно много в оливковом).
Получают гидролизом растительных масел.
Сложные эфиры олеиновой кислоты используют в производстве лаков и красок.
Линолевая кислота — бесцветная маслянистая жидкость с температурой кипения 230 С при 2.13 кПа; в виде сложных эфиров глицерина входит в состав растительных масел (в соевое и конопляное).
Получают гидролизом растительных масел.
Сложные эфиры линолевой кислоты используют в производстве лаков, красок, эмалей.
Линоленовая кислота — бесцветная маслянистая жидкость с температурой кипения 503 К при 2.27 кПа; в виде сложных эфиров глицерина входит в состав растительных масел (в льняное).
Получают гидролизом растительных масел.
Сложные эфиры линоленовой кислоты используют в производстве лаков и красок.
6.5.6. ОМЫЛЯЕМЫЕ ЛИПИДЫ
Липиды — большая группа веществ природного происхождения, не растворимых в воде и растворимых в малополярных растворителях. Липиды
305
играют большую роль в жизнедеятельности различных организмов: они являются основной составной частью клеточных мембран, играют защитную роль и служат формой, в виде которой организм запасает энергию.
По способности к гидролизу липиды делят на омыляемые и неомыляемые. Неомыляемые липиды являются представителями негидролизующихся классов соединений: стероидов (гл. 8.7), терпенов и каротиноидов (гл. 8.5).
Омыляемые липиды могут быть простыми и сложными в зависимости от структурного состава их молекул. Простые омыляемые липиды представляют собой сложные эфиры высших карбоновых кислот и либо высших одноатомных спиртов (вóски), либо глицерина (жиры). Сложные липиды в своѐм составе могут содержать структурные компоненты фосфорной кислоты, аминоспиртов и некоторых других соединений.
Воски — смесь сложных эфиров с общей формулой R-COO-R , где R =
от С15Н31 до С35Н71, R = С12Н25 до С46Н93. Это пчелиный воск, шерстяной (шерстный) воск, ланолин, спермацет и др. Они образуют защитную смазку
на коже человека и животных и предохраняют растения от высыхания. Жиры представляют собой смесь сложных эфиров предельных и не-
предельных карбоновых кислот и глицерина, общая формула таких триацилглицеринов
O
CH2 O C R
O
HC O C R'
O
CH2 O C R"
Вжирах животного происхождения преобладают остатки насыщенных кислот (главным образом пальмитиновой и стеариновой). Они, как правило, являются твѐрдыми веществами. Напротив, растительные жиры (их чаще называют маслами) содержат в основном остатки ненасыщенных кислот (олеиновой, линолевой, линоленовой и арахидоновой). Однако в состав природных жиров и масел могут входить остатки карбоновых кислот с более короткой цепью (табл. 6.5).
Всистематических названиях жиров допускается использование тривиальных названий остатков карбоновых кислот и глицерина, например, глицерин-1-олеат-2,3-дипальмитат. Применяются также и полутривиальные названия жиров как триацилглицеринов, например, 1-олеил-2,3- дипальмитилглицерин.
306
Таблица 6.5 Содержание высших карбоновых кислот в природных жирах
|
|
|
Кислоты (масс. доля, %) |
|
||
Жиры и масла |
пальми- |
стеарино- |
олеиновая |
линолевая |
линоле- |
другие |
|
тиновая |
вая |
новая |
|||
|
|
|
|
|||
Говяжий |
24–29 |
21–25 |
41–42 |
2–5 |
< 1 |
5–6 |
Бараний |
23–30 |
20–32 |
35–41 |
3–4 |
— |
14–16 |
Свиной |
27–30 |
13–18 |
37–44 |
6–9 |
1 |
2 |
Сливочное |
24–29 |
9–13 |
10–34 |
2–5 |
— |
12–21 |
Подсолнечное |
4–9 |
2–5 |
24–40 |
46–72 |
1 |
2 |
Оливковое |
7–20 |
2–3 |
54–81 |
7–15 |
— |
0,5 |
Кукурузное |
7–11 |
2–5 |
44–45 |
40–56 |
— |
до 2 |
Соевое |
2–7 |
4–7 |
20–30 |
44–60 |
3–6 |
до 12 |
Льняное |
6–10 |
— |
13–29 |
15–30 |
44–61 |
— |
Конопляное |
6–10 |
2–6 |
6–16 |
36–60 |
15–28 |
— |
Кедровое |
— |
— |
11–22 |
53–59 |
17–25 |
— |
Хлопковое |
20–25 |
2 |
30–35 |
40–48 |
— |
1 |
Пальмовое |
39–47 |
— |
37–43 |
5–18 |
— |
— |
Жирам присущи все химические свойства сложных эфиров, а при наличии в их молекулах остатков ненасыщенных кислот — и свойства непредельных соединений. Своеобразным показателем ненасыщенности природных жиров является йодное число — масса йода, способного присоединиться
к100 г вещества.
Всвязи с тем, что твѐрдых жиров не хватает для пищевых и технических целей, большое промышленное значение приобрело каталитическое гидрирование (гидрогенизация) ненасыщенных связей более дешѐвых жид-
ких жиров (никелевый катализатор, 160 200 С, 0.2 1.5 МПа). При этом жидкие ненасыщенные жиры переходят в твѐрдые насыщенные. Например, остаток линолевой кислоты превращается во фрагмент стеариновой:
|
|
|
|
|
|
|
|
|
|
O |
|
|
||
|
CH2 |
O |
|
|
C |
|
(CH2)7-CH=CH-CH2-CH=CH-(CH2)4-CH3 |
|
|
|||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
O |
+ 2H2 |
/ p, T |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
HC |
|
O |
|
C |
|
|
|
R' |
||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
||
|
|
|
|
|
C R" |
|
|
|||||||
CH2 |
O |
|
|
|
||||||||||
|
|
|
||||||||||||
O
CH2 O C (CH2)16-CH3
O
HC O C R'
O
CH2 O C R"
307
Реакция гидрирования сопровождается изомеризацией цис-изомерных природных ненасыщенных кислот в транс-изомеры (например, олеиновой кислоты в элаидиновую), а также миграцией двойной связи, приводящей к превращению, например, олеиновой кислоты в изоолеиновые кислоты:
СН3-(СН2)10-СН=СН-(СН2)4-СООН
октадец-6-еновая кислота
СН3-(СН2)5-СН=СН-(СН2)9-СООН
октадец-11-еновая кислота
Продукты гидрогенизации жиров (саломасы) представляют собой смеси твѐрдых триглицеридов насыщенных и ненасыщенных кислот. В небольших количествах саломасы содержат в себе свободные высшие карбоновые кислоты, продукты их распада, моно- и диглицериды, неомыляемые вещества и др. Пищевые саломасы применяют для выработки маргаринов, кондитерских и кулинарных жиров; технические — для получения туалетного и хозяйственного мыла, стеарина и др.
Омыляемые сложные липиды представлены тремя большими группами: фосфолипиды, сфинголипиды и гликолипиды.
Фосфолипиды — это главным образом глицерофосфолипиды, т.е. производные 1,2-диацилглицеро-3-фосфата (природные глицерофосфолипиды имеют L-конфигурацию). Как правило, в природных глицерофосфолипидах в положении 1 глицериновой цепи находится остаток насыщенной, в положении 2 — остаток ненасыщенной кислот, а один из гидроксилов фосфорной кислоты этерифицирован многоатомным спиртом или аминоспиртом (X — спиртовый остаток). Природными фосфолипидами являются фосфатидилэ-
таноламин (кефалин), фосфатидилхолин (лецитин), фосфатидилсерин и не-
которые другие:
|
|
|
|
1 |
|
|
|
O |
|
|
|
X = -CH2CH2NH2 |
|
— кефалин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
O H2C |
O |
|
C |
|
R |
|
|
|
— лецитин |
||||
|
|
|
|
||||||||||||
|
|
|
O |
2 |
* |
H O |
|
|
|
-CH CH N(CH |
|
||||
R' |
|
C |
3 |
|
O |
X |
2 2 |
3 |
|
||||||
|
|
|
H2C |
O P |
-CH2-CH-NH2 |
|
— фосфатидилсе- |
||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
HO |
|
|
|
COOH |
|
рин |
|||
Они являются главным липидным компонентом клеточных мембран.
В результате межмолекулярных взаимодействий, удерживающих друг возле друга углеводородные радикалы, образуется внутренний гидрофобный слой мембраны. Гидрофильные фрагменты, расположенные на внешней поверхности мембраны, образуют гидрофильный слой.
308

Сфинголипиды — структурные аналоги глицерофосфолипидов, в молекулы которых вместо глицерина входит сфингозин — ненасыщенный двухатомный аминоспирт.
|
CH2OH |
|
H |
|
NH2 |
|
||
H |
|
OH |
|
||
|
CH=CH-(CH2)12-CH3 |
|
|
|
сфингозин |
Гликолипиды содержат остатки углеводов и не содержат фосфорную кислоту.
Некоторые сфинголипиды и гликолипиды (такие, как сфингомиелины, цереброзиды, ганглиозиды) входят в состав нервных тканей.
6.6. ДИКАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
Молекулы карбоновых кислот могут содержать несколько карбоксильных групп. Количество карбоксильных групп определяет их основность. Встречаются одно-, двух-, трѐх- и т.д. основные кислоты.
В молекулах дикарбоновых кислот имеется две карбоксильные группы. Их общую формулу можно представить следующим образом:
HООC-R-CООH
где R — двухвалентный углеводородный радикал
Поэтому эти соединения могут образовывать два ряда производных: как по одной, так и по другой карбоксильной группе.
В табл. 6.6 приведены тривиальные названия нескольких первых представителей дикарбоновых кислот, а также названия ацилов и ацилатов, использующиеся для составления названий производных кислот.
Малеиновая и фумаровая кислоты являются геометрическими изомерами и заметно различаются по своим физическим и химическим свойствам.
Заместительная номенклатура дикарбоновых кислот аналогична номенклатуре монокарбоновых кислот. Однако необходимо учитывать старшинство функциональных групп (гл. 1.5.1) при названии смешанных производных (соли, кислые и средние, называются аналогично неорганическим солям). Например:
HООC–СН2–CООNa — 3-гидрокси-3-оксопропаноат натрия (или пропандиоат натрия-водорода),
HООC–СН2–СН2–CОCl — 4-оксо-4-хлорбутановая кислота.
309