- •1. Высокоэффективная газовая хроматография Введение
- •1.1. Особенности капиллярной колонки. Уравнение Голея
- •1.2. Получение капилляров для кварцевых колонок
- •1.3. Типы капиллярных колонок
- •1.4. Устойчивость и эффективность нанесения неподвижных фаз. Эксплуатация и хранение колонок
- •1.5. Ввод пробы в капиллярную колонку
- •1.5.1. Ввод пробы с делением потока
- •1.5.2. Ввод пробы без деления потока
- •1.5.3. Непосредственный ввод пробы в колонку
- •Рекомендации по непосредственному вводу пробы в колонку:
- •1.5.4. Прямой ввод пробы в колонку
- •1.5.5. Ввод пробы с программированием температуры испарителя
- •1. 6. Детекторы
- •1.7. Качественный и количественный анализ
- •1.8. Гибридные методы
- •2. Высокоэффетивная жидкостная хроматография
- •2.1. Общие сведения о высокоэффективной жидкостной хроматографии и классификация ее видов
- •2.2. Причины размывания хроматографических зон в вэжх
- •2.3. Сорбенты
- •2.4. Растворители
- •2.4.1. Общая характеристика
- •2.4.2. Физические свойства
- •2.4.3. Элюирующая сила и селективность
- •2.4.4. Классификация растворителей
- •2.5. Основные варианты вэжх
- •2.5.1. Хроматография на силикагеле.
- •2.5.2. Обращенно-фазовая хроматография
- •2.5.3. Хроматография с динамическим модифицированием.
- •2.5.4. Лиганднообменная хроматография.
- •2.5.5. Аффинная хроматография
- •2.5.6. Жидкостная хроматография хелатов
- •2.5.7. Эксклюзионная хроматография
- •2.5.8. Ионоэксклюзионная хроматография
- •2.5.9. Гидродинамическая хроматография
- •Основы ионной хроматографии.
- •Равновесие ионного обмена в условиях ионной хроматографии
- •Удерживание катионов
- •Удерживание анионов
- •Анионообменники
- •3.1. Зерно поверхностно-модифицированного анионообменника
- •Катионообменники
- •Комплексообразующше сорбенты
- •Практика выбора сорбента
- •Элюенты двухколоночная ионная хроматография
- •Определение анионов
- •Определение катионов
- •Одноколоночный вариант
- •Определение анионов
- •Определение катионов
- •Практика выбора элюента
- •Концентрация
- •Влияние на элюирующую силу величины рН
- •Устранение посторонних пиков
- •Использование комплексообразования
- •Введение органических добавок
- •Аминокислоты как элюенты
- •7. Приборы для жидкостной хроматографии
- •7.1. Насосы
- •1,3 Плунжеры; 2 привод двигателя; 4 дополнительный плунжер; 5 камера насоса;
- •6,8 Поток элюента; 7 шариковые клапаны
- •7.2. Системы ввода пробы
- •7.3. Блоки контроля температуры
- •Детекторы
- •7. 4.1. Оптические детекторы
- •1,6 Фотоприемники; 2 кварцевые окна; 3 проточная ячейка; 4 источник уф- излучения; 5 фильтр
- •1 Источник уф-излучения; 2 диафрагма; 3 конденсор; 4 проточная ячейка; 5 дифракционная решетка; 6 фотодиод; 7 фотодиодная матрица
- •7.4.2. Электрохимические детекторы
- •7.4.4. Кондуктометрический детектор
- •7.4. Другие типы детекторов
2.4.4. Классификация растворителей
Целью классификации растворителей с точки зрения их хроматографических свойств является создание стройной системы, позволяющей оценивать их силу и селективность, осуществлять целенаправленный выбор состава подвижных фаз.
Элюотропные ряды являются простейшей формой оценки силы индивидуальных растворителей. Они дают количественную оценку адсорбционной способности растворителей в тех или иных режимах хроматографического разделения. Элюотропный ряд - это перечень растворителей, расположенных в порядке возрастания элюирующей способности, которая может быть охарактеризована различными параметрами.
Параметр адсорбционной силы растворителя 0 с физической точки зрения представляет собой относительную энергию взаимодействия молекул подвижной фазы с поверхностью адсорбента. Он предложен Снайдером для адсорбционной хроматографии на основе т.н. “конкурентной модели”. Согласно нее твердая поверхность покрыта молекулами подвижной фазы и молекулы образца вынуждены конкурировать с молекулами, расположенными в этом адсорбированном слое, за временное связывание с центрами адсорбции. Сильно адсорбирующиеся на поверхности растворители трудно заместить, и поэтому их относят к “сильным растворителям” снижающим время удерживание сорбата. В то же время растворители, слабо взаимодействующие с неподвижной фазой, заместить легко, и поэтому они выступают в качестве “слабых растворителей”.
В жидко-твердофазной хроматографии (ЖТХ) образец распределяется между жидкой подвижной фазой и твердой поверхностью, а коэффициент распределения можно определить так же, как в газо-адсорбционной хроматографии;
![]() ,
(2.11)
,
(2.11)
где K,i - коэффициент адсорбции (л/г), Ci,s - концентрация образца в неподвижной фазе (моль/г), Ci,m - концентрация образца в объеме подвижной фазы (моль/л).
Снайдер вывел уравнение для количественного описания упомянутого эффекта конкурирования:
![]() .
(2.12)
.
(2.12)
В этом уравнении :
V - объем адсорбированного растворителя в расчете на грамм адсорбента (V можно считать компенсационным коэффициентом для размерности K,i , поскольку отношение Ka,i/Va - величина безразмерная);
- активность адсорбента;
Si0 - энергия адсорбции образца на стандартном адсорбенте;
Ai - площадь, занятая адсорбированной молекулой образца;
0 -удельная энергия адсорбции растворителя (энергия адсорбции, отнесенная к единице площади поверхности) на том же стандартном адсорбенте, которую обычно называют силой растворителя или элюирующей силой.
“Конкурентный фактор” (выражение в скобках уравнения) можно записать как
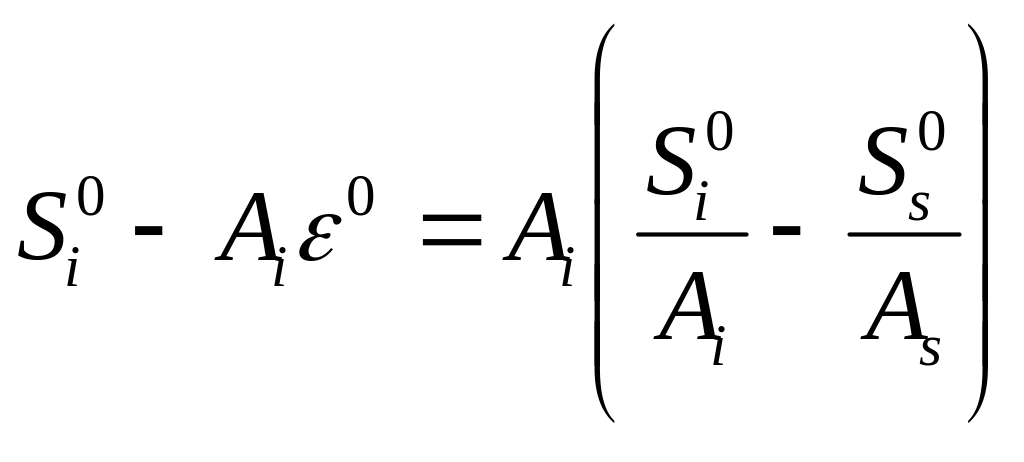 .
(2.13)
.
(2.13)
Это выражение более четко демонстрирует, что “конкурентноспособность” определяется разностью энергий адсорбции образца и растворителя.
Для сопоставления элюирующей способности различных растворителей Снайдером были приняты следующиее стандартные условия: стандартный адсорбент (=1) - сухой оксид алюминия, стандартный растворитель ( 0=0) - н-пентан, стандартная площадь, занимаемая молекулой образца (Ai =6), равна площади молекулы бензола. Это условие подразумевает, что одной единице Ai соответствует площадь приблизительно 8,5 А2.
Используя эти условия в качестве стандартных, экспериментальным путем можно определить значения (различные адсорбенты), 0 (различные растворители), Ai и Si0 (различные образцы).
Уравнение Снайдера описывает удерживание в ЖТХ через параметры адсорбента (V, ), образца (Ai, Si0 ) и растворителя 0. По изменению параметра 0 легко оценить, что даст замена растворителя для данного сорбата и конкретной НФ. Как таковое оно оказало неоценимую помощь в интерпретации явлений удерживания и селективности в ЖТХ. Например, по изменению параметра 0 легко оценить, что даст замена растворителя для данного сорбата и конкретной неподвижной фазы.
К сожалению это уравнение непригодно для каких-либо оценок и предсказаний в том случае, если одновременно меняется несколько параметров. Например, как выяснилось, величина 0 зависит не только от растворителя, но и от адсорбента. Поэтому для различных адсорбентов приводятся различные значения 0. Некоторые из значений 0, полученных для распространенных растворителей, приведены в табл. 2.
Как видно, для полярных сорбентов силикагеля и оксида алюминия значения 0 различны. Они значительно отличаются и от значений, характерных для неполярного угля. Точно также значения параметров Ai и Si0 , характеризующих сорбат, различаются для разных адсорбентов. Таким образом, уравнение дает адекватное описание только для одной конкретной НФ. Для каждого нового адсорбента необходимо установить значения нового набора параметров. При этом условии влияние растворителя на удерживание сорбата хорошо описывается параметром силы растворителя 0. Увеличение 0 приводит к уменьшению коэффициента емкости.
Табл. 2. Параметр адсорбционной силы 0 растворителей.
Растворитель |
Сорбент |
||
|
Селикагель |
Оксид алюминия |
Сажа |
Гексан |
0,01 |
0,01 |
0,10 |
Бензол |
|
0,32 |
0,20 |
Хлористый бутил |
0,20 |
0,26 |
0,13 |
Хлороформ |
0,26 |
0,40 |
0,18 |
Метиленхлорид |
0,32 |
0,42 |
0,13 |
Изопропиловый эфир |
0,34 |
0,28 |
|
Этилацетат |
0,38 |
0,58 |
0,13 |
Тетрагидрофуран |
0,44 |
0,57 |
0,14 |
Ацетонитрил |
0,50 |
0,65 |
0,04 |
Метанол |
0,70 |
0,95 |
0,00 |
В ЖТХ в качестве подвижных фаз наряду с чистыми растворителями часто применяют смеси растворителей. Для бинарных смесей выведено уравнение, связывающие силу растворителя (0) и состав элюента (NБ - мольная доля сильного растворителя Б):
![]() ,
(2.14)
,
(2.14)
где nБ - размер молекулы растворителя В, а - активность неподвижной фазы.
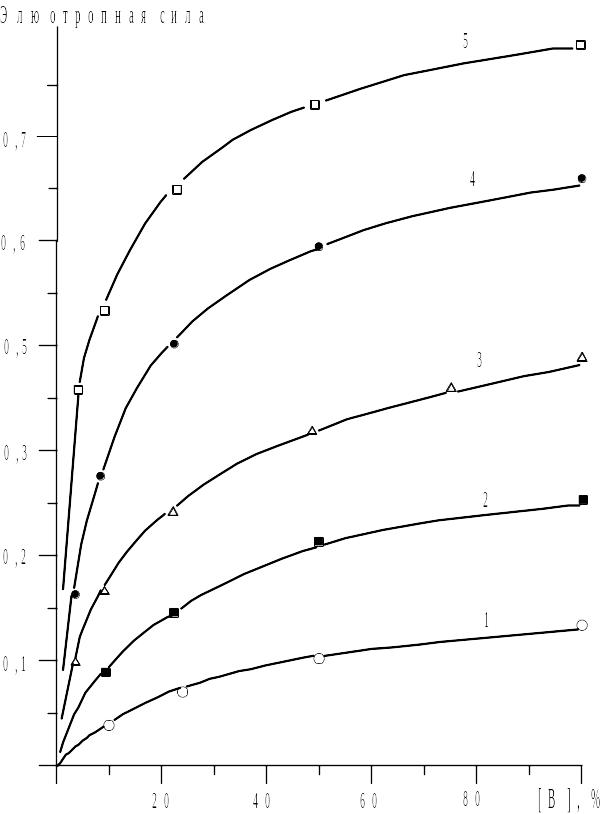
На рис. 2.6. показано изменение 0AБ в зависимости от состава для ряда бинарных смесей, в которых н-пентан - более слабый растворитель. Экспериментальные данные, приведенные на этом рисунке, хорошо описываются приведенным выше уравнением.
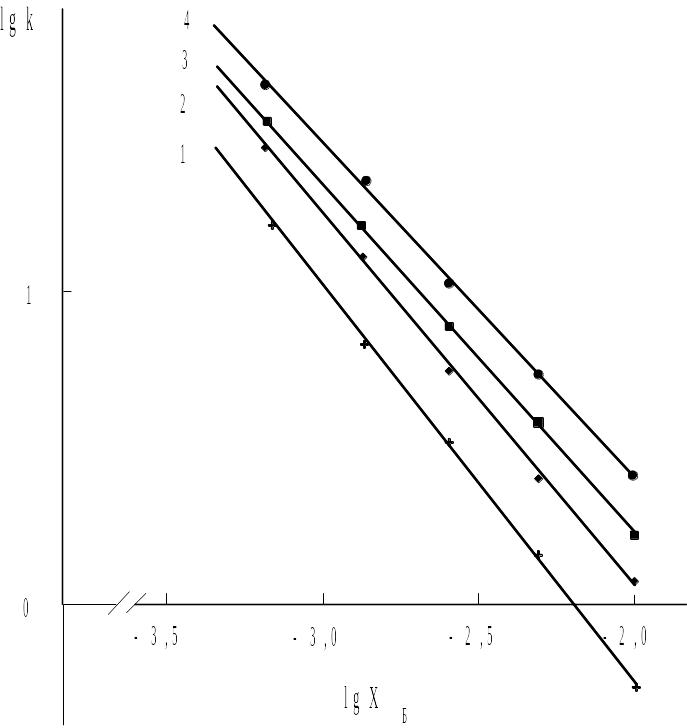
На практике часто можно наблюдать более простую связь между удерживанием и составом, а именно зависимость lnk от lnXБ (XБ - мольная доля более сильного растворителя Б) представляет собой прямую:
lnk =с - n lnXБ, (2.15)
где с и n – константы.
На рис. 2.7 приведены примеры линейного, в соответствии с уравнением (2.15), изменения удерживания в зависимости от состава элюента. Использование этих экспериментально найденных зависимостей значительно облегчает и упрощает исследования по подбору состава элюента и оптимизации процесса хроматографирования. Достаточно найти емкость колонки хотя бы для двух бинарных элюентов, отличающихся соотношением компонентов, чтобы оценить элюирующую силу любой смеси этих веществ.
Как следует из рис. 2.6, небольшие добавки сильных растворителей (так называемых модуляторов) приводят к радикальному изменению величины 0. Это особенно характерно для самого полярного из всех растворителей - воды. Поэтому содержание воды в подвижной фазе и степень покрытия водой НФ являются очень важными параметрами в ЖТХ. Помимо значительного уменьшения времени удерживания, следствием добавления к подвижной фазе может быть также улучшение формы пика. В результате этого может возрасти эффективность колонки и улучшиться воспроизводимость результатов.
|
|
Рис. 2.6. Зависимость элюотропной силы (0АБ) подвижной фазы от состава. Слабый растворитель (А): н-пентан. Сильные растворители: 1 - четыреххлористый углерод; 2 - 1-хлорпропан; 3 - хлористый метилен; 4 - ацетон; 5 - пиридин.
|
Рис. 2.7. Зависимость удерживания от состава подвижной фазы, описываемая упрошенным уравнением (2.15). Неподвижная фаза: оксид алюминия. Подвижная фаза: н-пропанол (Б) в н-гексане (А), - объемная доля н-пропанола. Хроматографируемые соединения: 1 - люмистерин; 2 - тахистерин; 3 - кальциферин; 4 - эргостерин. |
Изоэлютропные смеси. Рис.8 представляет собой графическое отображение элюирующей силы растворителей в ЖТХ. На верхней оси этой номограммы отложены значения параметра силы растворителя 0. Все остальные горизонтальные отрезки отвечают конкретным бинарным смесям указанного состава. Ясно, что масштаб на этих отрезках в соответствии с уравнением (2.15) нелинейный.
Вертикальная штриховая линия показывает, как найти состав изоэлюотропных смесей. Смеси, содержащие 75 % хлористого метилена в н-гексане, 49 % диэтилового эфира в гексане, 1,5 % ацетонитрила в 2-хлорпропане, 50 % хлористого метилена в 2-хлорпропане, 46 % диэтилового эфира в н-гексане и 0,1% метанола в 2-хлорпропане, имеют одинаковую элюирующую способность (0 = 0,3).
Следует ожидать, что для этих изоэлюотропных смесей значения коэффициентов емкости будут близки, но в зависимости от типа образца они могут вызывать различные специфические взаимодействия, что может быть использовано для улучшения разделения.
Не все из многочисленных теоретически возможных изоэлюотропных смесей в равной степени пригодны для практического применения. Кроме того, чтобы обеспечить приемлемую эффективность поиска оптимальных условий, необходимо ограничиться лишь небольшими числом растворителей. В прямофазной хроматографии наиболее часто используют в качестве модификаторов н-гексана хлористый метилен, метил-трет-бутиловый эфир и ацетонитрил.
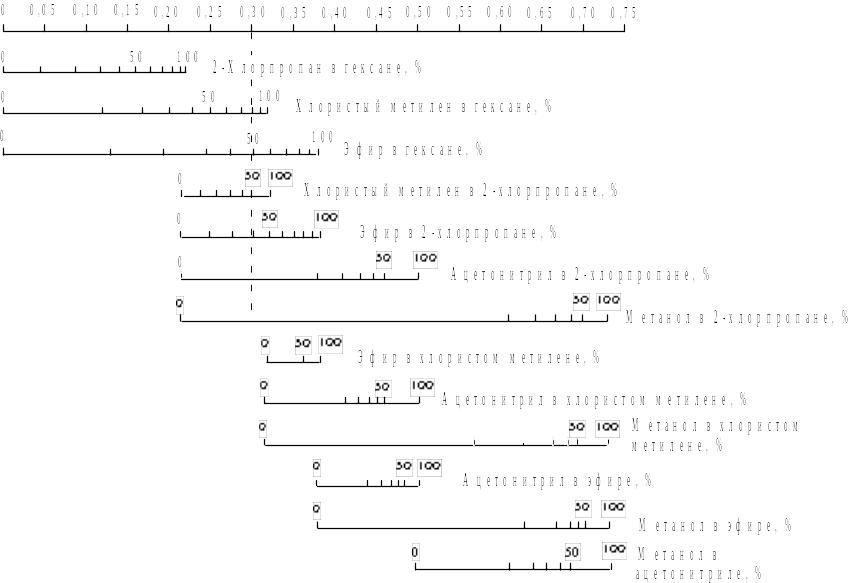
Рис. 2.8. Номограмма, позволяющая определить элюирующую силу бинарных смесей растворителей для ЖТХ на силикагеле. Вертикальная штриховая линия соединяет изоэлюотропные смеси растворителей. Содержание растворителя в смеси приведено в объемных процентах
Параметр растворимости T. Полярность - важнейшее понятие в хроматографии, однако не существует его однозначного трактования. Так в газовой хроматографии, согласно Роршнайдеру, полярность НФ можно оценить по способности последней удерживать полярные соединения.
Объективная и количественная мера полярности соединений, в том чиcле и элюента, крайне необходима и в ЖХ. Такой количественной характеристикой может служить параметр растворимости T, введенный Гильдебрантом.
Cогласно определению, параметр растворимости - это квадратный корень из значения плотности энергии когезии
![]() ,
(2.16)
,
(2.16)
где Е - энергия когезии, - молярный объем.
Все силы взаимодействия между молекулами образца вносят свой вклад в энергию когезии. Таким образом, сильно взаимодействующие молекулы приводят к высоким значениям Е. Энергия когезии (по отношению к идеальной газовой фазе) величина отрицательная. В табл. 3 приведены некоторые примеры параметров растворимости соединений, представляющих интерес для хроматографистов, в том числе и наиболее типичных растворителей и наиболее типичных НФ.
Обычно T измеряется в кал1/2.см-3/2. Одна такая единица соответствует 2,05.103 Па1/2. В дальнейшем для удобства единицы измерения параметра растворимости будут опускаться.
Таблица 3. Параметры растворимости ряда соединений, используемых в хроматографии.
Соединения |
Параметр растворимости и парциальная полярность, кал1/2.см-3/2. |
|
T d o ind a b
|
|
|
Вода |
25,52 7,2 ? ? 21,7 14,2 |
Оксид алюминия |
16 10,8 9,8 ? 11,4 2,5 |
Метанол |
15,85 7,2 3,9 0,1 17,1 5,4 |
Пироуглерод |
14 14 Мала Мала Мала Мала |
Ацетонитрил |
13,14 7,3 5,8 0,2 10 4 |
Хлористый метилен |
10,68 8,0 4,38 1,0 4 1 |
1,4-Диоксан |
10,65 8,10 1,2 3,4 Мала 2,0 |
Тетрагидрофуран |
9,88 8,0 3,3 0,3 6,2 1,5 |
Толуол |
9,57 8,5 0,8 0,7 8 0,4 |
Этилацетат |
9,53 7,6 3,6 1,4 3,5 1 |
Алканы |
7 7 0 0 0 0 |
Перфторалканы |
5 5 0 0 0 0 |
В таблице находят отражение интуитивные представления химика: так, вода, будучи самым полярным растворителем, расположена вверху, а алканы как обычные неполярные растворители - внизу таблицы. Согласно модели параметров растворимости, только перфторированные алканы менее полярны, чем алканы. Особого внимания заслуживает чрезвычайно высокая полярность воды
Помимо того что табл. 3 демонстрирует применимость параметров растворимости для количественной оценки полярности, она также иллюстрирует недостатки модели. Основываясь лишь на параметре растворимости, можно сделать вывод, что хлористый метилен будет вести себя почти так же, как диоксан, а толуол - как этилацетат. Однако на практике между этими растворителями наблюдаются значительные различия. Например, диоксан смешивается с водой в любых соотношениях, в то время как хлористый метилен практически нерастворим в воде. Очевидно, что объяснения различий в поведении веществ близкой полярности необходимо уточнение модели.
С целью такого уточнения необходимо учитывать различные взаимодействия, составляющие в сумме общую энергию когезии. Эти виды взаимодействий можно подразделить на дисперсионные, ориентационные (диполь-дипольные), индуцированные диполь-дипольные и кислотно-основные. Различные типы взаимодействий, возможных в трех различных видах смесей, перечислены в табл. 4. К неполярным относятся такие вещества, в энергию когезии которых вносит вклад только дисперсионное взаимодействие. Очевидно, что взаимодействия, наблюдаемые в чистых неполярных соединениях, равноценны таковым в смеси двух таких соединений.
Таблица 4. Специфические взаимодействия в различных видах смесей
Типы взаимодействий |
Имеет место (+) или не имеет (-) место данный тип взаимодействия между молекулами неполярных полярного и полярных соединений неполярного соединений соединения |
Дисперсионные Ориентационные Индукционные Кислотно-основные |
+ + + - - + - + + - - +
|
Общую плотность энергии когезии можно выразить как сумму вкладов всех указанных выше взаимодействий:
T2 = d2 + o2 + 2ind d + 2ab, (2.17)
где буквенные индексы соответствуют общему (Т), дисперсионному (d), ориентационному (o), индукционному (ind), кислотному (a) и щелолчному (b) взаимодействию.
В уравнении (2.17) встречаются два различных вида членов. Дисперсионное и ориентационное взаимодействия представлены квадратными членами, а значения, отвечающие кислотно-основному и индукционному взаимодействию, выражены в виде удвоенных произведений. Первые два типа взаимодействий называют симметричными, поскольку две участвующие в них молекулы одинаковы. В двух других типах взаимодействия различные молекулы играют различную роль. Либо одна молекула активно индуцирует диполь в другой, пассивной молекуле, либо первая ведет себя как кислота, а вторая как основание.
В табл. 3 приведены значения парциальных полярностей, отвечающие вкладу каждого типа взаимодействий в общую полярность T. Исходя из приведенных данных можно провести различие между молекулами с близкими значениями общей полярности. Большая часть энергии толуола обусловлена дисперсионными взаимодействиями, в то время как для этилацетата более важную роль играет ориентация диполей. Ориентационные взаимодействия свойственнее хлористому метилену, чем диоксану, более расположенному к индукционным взаимодействиям.
Важное практическое значение параметра растворимости заключается в возможности осознанного выбора фазовых систем в ЖХ (фазовая система представляет собой комбинацию подвижной и неподвижной фаз), основанного на значениях T. Существует очень простое эмпирическое правило выбора оптимальных условий элюирования, заключающееся в том, что полярность сорбата (i) должна быть примерно равна половине суммы полярностей подвижной (m) и неподвижной (s ) фаз:
i (m + s ) / 2. (2.18)
Это правило иллюстрирует рис. 2.9, на котором три горизонтальные оси (сверху вниз) представляют собой параметры растворимости неподвижной фазы, образца и подвижной фазы. Каждая негоризонтальная линия обозначает фазовую систему, для которой соблюдается уравнение (2.18). Ясно, что вертикальные линии обозначают систему, в которой полярности фаз равны, т.е. полностью неселективную систему.
На рис. 2.9 изображены две линии, иллюстрирующие два примера выбора возможных фазовых систем для элюирования образца с i=12,5 кал1/2.см-3/2. Линия с положительным наклоном соединяет подвижную фазу средней полярности (m =9) с полярной неподвижной фазой (s =16) и соответствует прямофазному варианту.
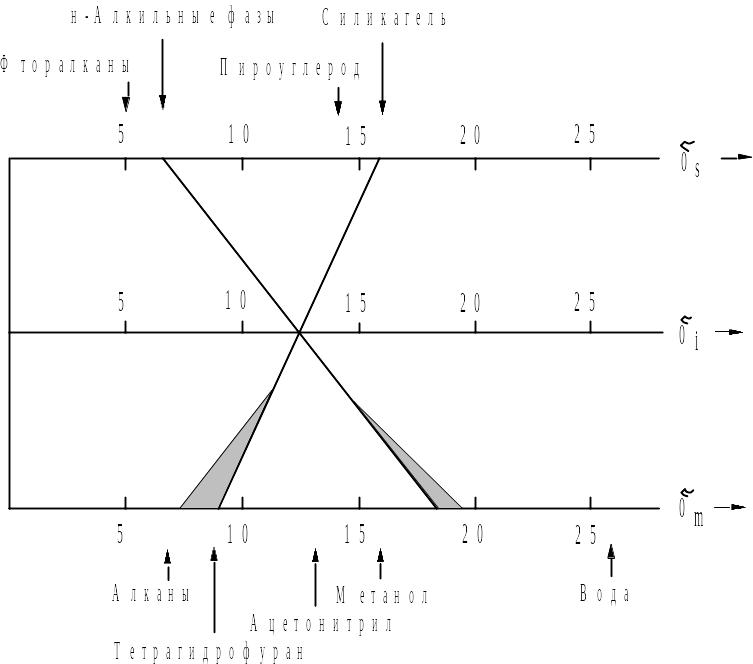
Рис. 2.9. Выбор фазовых систем для ЖХ в соответствии с уравнением (2.18).
Вещество с полярностью 12,5 (средняя шкала) можно элюировать с силикагеля ( s = 16; верхняя шкала) неполярной жидкой фазой ( m = 9; нижняя шкала), а с обращееной фазы полярным растворителем. Заштрихованные участки области допустимых изменений полярности выбираемых фаз.
Для прямой с отрицательным наклоном (m s ) справедливо обратное, поэтому соответствующая система называется обращенно-фазовой. Эта линия соединяет типичную неполярную (алканоподобную) НФ с s =7 с полярной подвижной фазой с m = 18. Такой элюент можно, например, получить, смешав метанол с водой в нужной пропорции. Поскольку очень широкий диапазон полярности подвижной фазы можно перекрыть смешанными фазами из метанола и воды или даже тетрагидрофурана и воды, обращенно-фазовая система является очень гибкой. Не меняя колонку (неподвижную фазу), можно осуществить элюирование самых разных образцов.
Схема Снайдера классификации растворителей. Правильный выбор элюирующей силы подвижной фазы является необходимым, но не всегда достаточным условием успешного разделения. Для целенаправленного выбора или изменения состава подвижной фазы необходимо ввести рациональную классификацию растворителей по их селективности
Снайдер предложил удобную эмпирическую схему классификации растворителей для хроматографии в соответствии с их полярностью и свойственными им специфическими химическими взаимодействиями. В основе этой схемы лежат экспериментально найденные (методом газовой хроматографии) коэффициенты распределения трех эталонных веществ этанола (e), 1,4-диоксана (d) и нитрометана (n) между паровой фазой и испытуемым растворителем.
Введенный Снайдером параметр Р, который может служить мерой полярности и элюирующей силы растворителя в распределительной хроматографии, рассчитывают как сумму логарифмов коэффициентов распределения трех эталонных веществ:
![]() .
(2.19)
.
(2.19)
Экспериментально найденные коэффициенты распределения (Kg) были приведены к молекулярной массе растворителя путем умножения на его молярный объем (s):
![]() .
(2.20)
.
(2.20)
Для более детального описания поведения растворителей Снайдер ввел еще три классификационных параметра селективности:
1) параметр донора протонов
![]() ;
(2.21)
;
(2.21)
2) параметр акцептора протонов
![]() ;
(2.22)
;
(2.22)
3) параметр “сильного дипольного взаимодействия”
![]() ;
(2.23)
;
(2.23)
В табл. 5 приведены значения Р и x для ряда растворителей, применяемых в хроматографии. В начале таблицы приведены данные для трех растворителей, которые служили эталонами.
Схема Снайдера дает хорошие результаты при классификации химически родственных растворителей. Например, все представленные в таблице алифатические спирты имеют практически одинаковые параметры селективности, несмотря на то , что значения Р меняются от 3,4 до 5,1. Аналогичным образом можно прийти к заключению, что бензол, хлорбензол и толуол, по-видимому, имеют одинаковую селективность и относятся к одному классу растворителей. В нижней части табл. 5 приведены растворители, представляющие особый интерес для жидкостной хроматографии. Видно, что вода имеет очень высокую полярность Р, а гексан - минимальную.
Таблица 5. Параметры для классификации растворителей по Снайдеру.
Растворителей |
Параметры P xe xd xn |
Группа |
Этанол Диоксан Нитрометан Метанол н-Пропанол Изопропанол нБутанол трет-Бутанол Изопентанол н-Октанол Бензол Толуол Хлорбензол н-Гексан Изопропилловый эфир Дихлорметан Тетрагидрофуран Хлороформ Ацеетонитрил Вода |
4,3 0,52 0,19 0,29 4,8 0,36 0,24 0,40 6,0 0,28 0,31 0,40 5,1 0,48 0,22 0,31 4,0 0,54 0,19 0,27 3,9 0,55 0,19 0,27 3,9 0,59 0,19 0,25 4,1 0,56 0,20 0,24 3,7 0,56 0,19 0,26 3,4 0,56 0,18 0,25 2,7 0,23 0,32 0,45 2,4 0,25 0,28 0,47 2,7 0,23 0,33 0,44 0,1 2,4 0,48 0,14 0,38 3,1 0,29 0,18 0,53 4,0 0,38 0,20 0,42 4,1 0,25 0,41 0,33 5,8 0,31 0,27 0,42 10,2 0,37 0,37 0,25 |
II Via VII II II II II II II II VII VII VII I V III Viб VIII |
Величины бессмысленны из-за низкого значения Р.
Близко к группе VIII.____________________________________________________
Схема Снайдера предназначена в основном для классификации селективности растворителей. Из табл. 5 видно, что химически родственные растворители имеют близкие параметры селективности xe, xd и x n. Очевидно, что сумма трех параметров селективности для каждого растворителя должна равняться единице
xe + xd + x n = 1. (2.24)
.Поэтому значения полярности Р и двух любых параметров селективности достаточно полно характеризуют хроматографическое поведение растворителя.
Значения селективности можно соответствующим образом разместить внутри двумерной фигуры. Обычно в этих целях используют треугольные диаграммы, как показано на рис. 2.10. Дополнительная схема, приведенная в верхнем левом углу, поясняет построение данной диаграммы. Для произвольной точки в треугольнике показано, как определить значения селективности. Следует подчеркнуть, что вершинам треугольника селективности соответствуют гипотетические растворители, способные только к протонодонорным (ПД), протоноакцепторным (ПА) или диполь-дипольным (ДД) взаимодействиям.
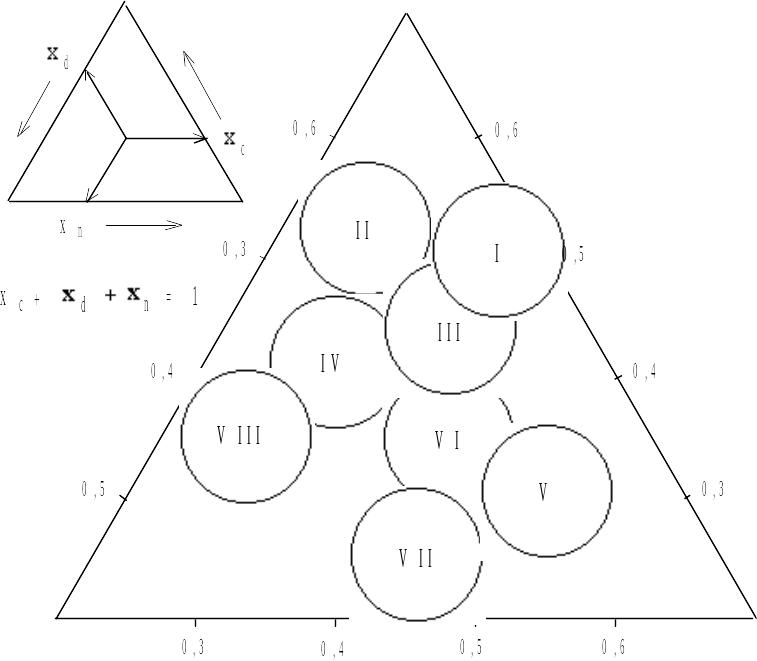
Рис. 2.10. Классификация растворителей по Снайдеру. В левом верхнем углу показано, как положение растворителя в треугольнике связано с значениями параметров селективности xe, xd и xn. Отнесение растворителей к определенным классам см. в табл. 6.
В соответствии с данными табл. 5 все распространенные растворители группируются в ограниченной области треугольника. Изображенные на рис. 10 восемь частично перекрывающихся окружностей отражают разбивку 81 исследованного растворителя на восемь классов. Эти классы были пронумерованы Снайдером. Принадлежность различных веществ к различным классам приведена в табл. 6.
Таблица 6. Классификация растворителей по Снайдеру.
Группа |
Растворители. |
I II III IV V VI a VI б VII
VIII |
Алифатические простые эфиры Алифатические спирты Производные пиридина, тетрагидрофуран, сульфоксиды Гликоли, уксусная кислота Дихлорметан, 1,2-дихлорэтан Алифатические кетоны и сложные эфиры, диоксан Сульфоны, нитрилы Ароматическиеуглеводороды, галогензамещенные ароматические углеводороды, нитросоединения, ароматические сложные эфиры Фторалканолы, вода |
Как следует из таблицы, классификация Снайдера дает возможность сгруппировать большое количество растворителей в небольшое число классов. Химически подобные соединения, например гомологи, входят в один класс, но в то же время группироваться могут и соединения, сильно различающиеся по химической структуре, примером этого является VII группа. Из всех изученных растворителей вне обозначенных на рис. 8 окружностей выпадают только хлороформ, фигуративная точка которого расположена несколько ниже окружности группы VIII, и триэтиламин, находящийся вне окружности группы I.
Важное практическое значение приведенной классификации состоит в том, что если какой-то растворитель, например толуол, не обеспечивает достаточной хроматографической селективности, то маловероятно, что какой-либо растворитель из той же группы сможет ее обеспечить. Следовательно, в данном случае можно даже и не пытаться проверять нитрометан. Таким образом, схема классификации Снайдера облегчает задачу выбора растворителя для ЖХ.
Особая шкала элюируюшей силы предложена для обращенно-фазовой хроматографии. Она основана на том, что для этого режима характерна зависимость
![]() ,
(2.25)
,
(2.25)
где kw - коэффициент емкости, если элюентом является чистая вода;
ФВ - объемная доля органического растворителя в подвижной фазе;
S - коэффициент, характеризующий элюирующую силу органического растворителя.
Набор значений S для некоторых растворителей, применяемых в обращенно-фазовой хроматографии, приведен в табл. 7. Здесь же для сопоставления указана полярность P по Снайдеру для тех же веществ.
Таблица 7. Элюирующая сила (параметры S и P) растворителей, используемых в обращенно-фазовой хроматографии
Растворитель |
S |
P |
Вода Метанол Ацетонитрил Этанол Ацетон Диоксан Пропанол-2 Тетрагидрофуран |
0,0 3,0 3,1 3,6 3,4 3,5 4,2 4,4 |
10,2 5,1 5,8 4,3 5,1 4,8 3,9 4,0 |
Эти данные в целом отражают сравнительное влияние растворителй на скорость перемещения зон в обращенно-фазовой хроматографии. Следует, однако, с осторожностью относиться к абсолютным величинам S, так как они неодинаковы для различных сорбатов и, кроме того могут зависеть от концентрации органического растворителя.
Сравнение величин S и P, приведенных в табл. 7, показывает, что они аналогично демонстрируют лишь общую картину, в отношении же конкретных растворителей нетрудно заметить противоречия. В то же время наблюдаемая линейная зависимость логарифма коэффициента емкости от объемной доли органического растворителя в элюенте в значительной степени облегчает выбор состава подвижной фазы с оптимальной элюирующей силой.