
- •Лабораторна робота №2 хімічні властивості сульфатної кислоти. Виявлення сульфат-іону.
- •Лабораторна робота № 1 добування амоніаку. Вивчення його влативостей. Солі амонію.
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота № 3 добування карбон (іv) оксиду і вивчення його властивостей. Взаємоперетворення карбонатів та гідрогенкарбонатів.
- •Попередні вказівки:
- •Хід виконання роботи
- •Лабораторна робота № 4 розпізнавання сполук неметалічних елементів
- •Попередні вказівки
- •Хід виконання роботи
- •Хімічні властивості металів
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота №6 розвязування експериментальних задач
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота №9 властивості полімерів
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота № 7 хімічні властивості оксигенвмісних сполук
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота №8 розвязування експериментальних задач
- •Попередні вказівки
- •Хід виконання роботи
- •Лабораторна робота № 10 порівняння властивостей мила тасинтетичних миючих засобів. Видалення забруднень з поверхні тканин.
- •Попередні вказівки:
- •Хід виконання роботи
Лабораторна робота № 1 добування амоніаку. Вивчення його влативостей. Солі амонію.
Мета роботи: засвоїти лабораторний спосіб отримання амоніаку та вивчити властивості сполук азоту та фосфору.
В результаті виконання роботи учні повинні:
знати електронну та просторову будову молекули аміаку та витікаючи звідси його властивості;
вміти складати рівняння реакцій властивих амоніаку та фосфору у молекулярній та іонній формах для реакцій іонного обміну, складати електронний баланс для ОВР, визначати окисник та відновник.
Прилади та реактиви: штатив з зажимом - 2 шт, штатив з пробірками, ступка з товчанкою, скляна паличка, амоній хлорид, гашене вапно, розчини: амоніаку, натрій (І) гідроксиду, амоній хлориду та амоній сульфату, барій(ІІ) хлориду, хлоридна кислота, лакмусовий папір, фенолфталеїн.
Завдання:
Отримати амоніак лабораторним способом.
Вивчити основні властивості розчину аміаку.
Провести реакція нейтралізації амоній гідроксиду.
Попередні вказівки
За звичайних умов амоніак NH3 – безбарвний газ із специфічним запахом, добре розчиняється у воді (водний розчин амоніаку називають нашатирним спиртом). Водний розчин амоніаку NH4OH – це слабка основа, яка дисоціює на йони лише частково. Амоній гідроксид - NH4OH - легко розкладається на воду й амоніак, добре взаємодіє з кислотами, солі амонію легко розкладаються при нагріванні.
Хід виконання роботи
Завдання 1. Отримання аміаку лабораторним способом.
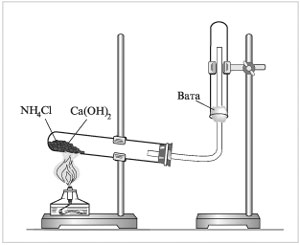 Насипати
в ступку ¼ чайної ложки амоній хлориду.
Понюхати. Всипати вапно, також понюхати.
У фарфоровій ступці перетерти гашене
вапно та амоній хлорид. Звернути увагу
на запах, що виникає. Всипати отриману
суміш у пробірку, закрити пробкою з
газовідвідною трубкою. Зібрати прилад
як показано на рис.1. Пробірку закріпити
з невеликим нахилом у бік пробки.
Газовідвідну трубку помістити в
закріплену догори дном пробірку. Обережно
нагріти пробірку з сумішшю. До отвору
іншої пробірки піднести зволожений
лакмусовий папірець. Спостерігати, що
відбувається.
Насипати
в ступку ¼ чайної ложки амоній хлориду.
Понюхати. Всипати вапно, також понюхати.
У фарфоровій ступці перетерти гашене
вапно та амоній хлорид. Звернути увагу
на запах, що виникає. Всипати отриману
суміш у пробірку, закрити пробкою з
газовідвідною трубкою. Зібрати прилад
як показано на рис.1. Пробірку закріпити
з невеликим нахилом у бік пробки.
Газовідвідну трубку помістити в
закріплену догори дном пробірку. Обережно
нагріти пробірку з сумішшю. До отвору
іншої пробірки піднести зволожений
лакмусовий папірець. Спостерігати, що
відбувається.
Рис.1.
Завдання 2. Вивчення основних властивостей розчину аміаку.
Налити в пробірку 2-3 краплі розчину амоніаку, додати 1 краплю фенолфталеїну. Записати спостереження. Кип’ятити розчин в пробірці до тих пір, доки розчин не стане безбарвним. Визначити реакцію рідини лакмусовим папірцем. Чи змінився колір паперу? Поясніть це явище.
Завдання 3. Проведення реакції нейтралізації амоній гідроксиду.
1) налити у пробірку 3-4 краплі розчину амоніаку і до нього по краплях додати розведену хлоридну кислоту. Реакцію рідини перевірити: перенести краплю рідини скляною паличкою на лакмусовий папірець. Спостереження записати.
2) в пробірку налити 4-5 крапель розчину амоній хлориду, додати таку ж кількість розчину натрій (І) гідроксиду і нагріти до кипіння. В пару, що виділяється, внести лакмусовий папір змочений водою. Записати та пояснити спостереження.
Контрольні запитання:
1. Які фізичні властивості амоніаку Ви знаєте?
2. Яким способом можна отримати амоніак?
3. В лабораторії гази часто осушують шляхом пропускання їх через концентровану сульфатну кислоту. Чому цей засіб не застосовується для осушення аміаку?
4. Визначте ступінь окислення нітрогену в наступних сполуках: NH3, N2O, NO, NO2, НNO3, NH4OH .
5. Чим зумовлена висока розчинність амоніаку у воді?
6. Як називається розчин амоніаку у воді?
7. До якого класу сполук відноситься нашатирний спирт? Як це довести? Який процес при цьому проходить?
8. Які загальні фізичні властивості мають солі амонію?
9. Що відбувається із солями амонію при нагріванні?
10. Чи можна газоподібний аміак та його розчин зберігати у відкритому посуді?
11. Що таке зворотна реакція? Вкажіть цю реакцію в лабораторній роботі.
Матеріали до звіту:
1. Оформити титульний лист.
2.Написати рівняння реакції:
до завдання 1: взаємодія амоній хлориду з кальцій (ІІ) гідроксидом;
до завдання 2: електролітичної дисоціації амоній гідроксиду;
до завдання 3: 1) взаємодія амоній гідроксиду з хлоридною кислотою;
2) взаємодія амоній хлориду з натрій (І) гідроксидом (в молекулярній та іонній формах).
3. Записати спостереження.
4. Зробити висновки.
Література:
1. Романова Н.В. Загальна та неорганічна хімія – К.; Ірпінь: „Перун”, 1998. с.255-258.
2. Буринська Н.М., Величко Л.П. Хімія, 10кл. – К.; Ірпінь: „Перун”, 2000. с.47-55.
3. Астахов А.И.. Касьяненко А.И. Химия – К.: ВШ, 1988. с.73-78.
4. Ярошенко О.Г. Хімія: Підручник для 10 кл. – К.: Грамота, 2010. с. 46-58.
