
- •Ю.С. Рыбаков процессы и аппараты защиты окружающей среды
- •280202 – Инженерная защита окружающей среды Екатеринбург
- •Оглавление
- •Глава 1. Научные основы технологических процессов . . . 10
- •1.2.1. Теплопроводность . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
- •1.4. Процессы разделения неоднородных и гетерогенных систем . . . . . . . . . 35
- •Глава 2. Защита атмосферного воздуха от загрязнения . . . 61
- •Глава 3. Защита водного бассейна от загрязнения . . . . . . . . . 102
- •Глава 4. Утилизация и ликвидация бытовых
- •Глава 5. Защита окружающей среды от энергетического
- •Предисловие
- •Введение
- •Глава 1. Научные основы технологических процессов
- •1.1. Основные понятия и законы природоохранных технологий
- •1.1.1. Два вида переноса вещества и энергии
- •Это уравнение будем называть материальным балансом. Из уравнения (1.1) видно, что в процессе производства происходит перенос массы из одних компонентов, входящих в аппарат, в другие.
- •1.1.2. Движущая сила технологического процесса
- •1.1.3. Закономерности переноса массы и энергии
- •1.1.4. Классификация и принципы оптимизации основных
- •Классификация основных процессов природоохранных технологий
- •1.2. Теплообменные процессы
- •1.2.1. Теплопроводность
- •1.2.2. Конвекция
- •1.2.3. Тепловое излучение
- •1.2.4. Теплоносители и их свойства
- •1.2.5. Теплоотдача при конденсации пара
- •1.2.6. Теплопередача при кипении жидкостей
- •1.2.7. Процессы выпаривания
- •1.3. Массообменные процессы
- •1.3.1. Массопередача, массоотдача и массопроводность
- •1.3.2. Абсорбция
- •1.3.3. Ректификация
- •1.3.4. Адсорбция
- •1.3.5. Ионный обмен
- •1.3.6. Экстракция
- •1.3.7. Сушка
- •1.3.8. Кристаллизация
- •1.4. Процессы разделения неоднородных и гетерогенных систем
- •1.4.1. Классификация неоднородных и гетерогенных систем
- •Классификация неоднородных и гетерогенных систем
- •1.4.2. Процессы осаждения под действием силы тяжести
- •1.4.3. Фильтрование
- •1.4.4. Коагуляция и флокуляция
- •1.4.5. Флотация
- •1.5. Химические и биохимические процессы, протекающие при очистке вод
- •1.5.1. Химические процессы
- •1.5.2. Сущность отдельных химических процессов и их роль
- •1.5.3. Биохимические процессы
- •1.6. Воздействие транспорта на окружающую среду
- •1.6.1. Влияние предприятий железнодорожного транспорта
- •1.6.2. Основные процессы, протекающие при воздействии
- •1.6.3. Характеристика топлив, используемых на объектах транспорта
- •1.6.4. Характеристика основных токсичных веществ, содержащихся
- •Глава 2. Защита атмосферного воздуха от загрязнения
- •2.1. Общие вопросы защиты атмосферы от загрязнения
- •2.1.1. Источники загрязнения атмосферы
- •2.1.2. Нормирование качества атмосферного воздуха
- •Предельно допустимые концентрации некоторых веществ в воздухе, мг/м3
- •2.1.3. Классификация источников загрязнения
- •2.2. Пассивные методы защиты атмосферы от загрязнения
- •2.2.1. Стадия проектирования предприятия
- •2.2.2. Инвентаризация и расчет предельно допустимых выбросов
- •2.2.3. Установление санитарно-защитной зоны вокруг предприятия
- •2.2.4. Расчет высоты трубы для рассеивания газовоздушных выбросов
- •2.3. Методы очистки отходящих газов от аэрозолей
- •2.3.1. Сухие пылеуловители
- •2.3.2. Мокрые пылеуловители
- •2.3.3. Электрофильтры
- •2.3.4. Фильтры
- •3.6. Туманоуловители
- •2.4. Очистка промышленных выбросов от токсичных газовых примесей
- •2.4.1. Метод абсорбции
- •2.4.2. Метод хемосорбции
- •2.4.3. Адсорбционные методы
- •2.4.4. Методы каталитической очистки газов
- •2.4.5. Метод термической очистки газов
- •2.5. Методы и устройства для очистки выхлопных газов карбюраторных и дизельных двигателей
- •2.5.1. Нейтрализаторы отработавших газов
- •2.5.2. Фильтры для улавливания дисперсных частиц
- •2.5.3. Использование новых рабочих процессов и видов энергоресурсов
- •2.5.4. Очистка отработавших газов при реостатных
- •Глава 3. Защита водного бассейна от загрязнения
- •3.1. Общие вопросы защиты водных объектов от загрязнения
- •3.1.1. Характеристика водопользования и водопотребления
- •3.1.2. Критерии качества воды
- •Критерии оценки загрязненности воды по пдк вредных веществ
- •3.1.3. Качество вод, используемых в промышленности
- •3.2. Пассивные методы защиты гидросферы от загрязнения
- •3.2.1. Особенности канализования сточных вод
- •3.2.2. Условия выпуска производственных сточных вод
- •3.2.3. Расчет предельно допустимого сброса вредных веществ
- •3.2.4. Установление водоохранных зон и прибрежных защитных полос
- •3.3. Классификация сточных вод
- •3.3.1. Классификация по принципу допустимости
- •3.3.2. Классификация сточных вод по дисперсному составу примесей
- •3.3.3. Классификация сточных вод в зависимости
- •4. Механические (физические) методы очистки сточных вод
- •3.4.1. Процеживание и отстаивание примесей
- •4.2. Осветление сточных вод, улавливание жиров и нефтепродуктов
- •4.3. Фильтрование
- •4.4. Гидроциклонирование
- •3.5. Химические, физико-химические и биологические методы очистки и обезвреживания сточных вод
- •3.5.1. Химическая очистка сточных вод
- •3.5.2. Физико-химические методы очистки
- •3.5.3. Методы биологической очистки сточных вод
- •3.5.4. Методы биологической очистки сточных вод
- •3.5.5. Доочистка сточных вод
- •Глава 4. Утилизация и ликвидация твердых отходов
- •4.1. Опасность отходов для окружающей природной среды
- •4.1.1. Источники возникновения твердых отходов
- •4.1.2. Классификация отходов
- •4.1.3. Нормирование допустимого количества отходов
- •Классификация опасности отходов производства
- •4.2. Основные технологические принципы утилизации, обезвреживания и захоронения отходов
- •2.1. Размещение отходов
- •4.2.2. Переработка отходов на месте складирования
- •4.2.3. Переработка отходов пластических масс
- •4.2.4. Сжигание отходов
- •4.2.5. Обезвреживание и захоронение радиоактивных отходов
- •4.3. Утилизация и ликвидация осадков сточных вод
- •4.3.1. Технологический цикл обработки осадков сточных вод
- •4.3.2. Уплотнение, стабилизация и кондиционирование осадков
- •4.3.3. Обезвоживание и ликвидация осадков сточных вод
- •Глава 5. Защита окружающей среды от энергетического воздействия
- •5.1. Защита окружающей среды от шума и вибраций
- •5.1.1. Шум и его характеристики
- •5.1.2. Нормирование шума
- •5.1.3. Расчет шумовых характеристик
- •5.1.4. Меры борьбы с шумовым загрязнением
- •5.2. Защита от электромагнитного загрязнения
- •5.2.1. Электромагнитное загрязнение среды и его источники
- •5.2.2. Предельно допустимые уровни электромагнитных полей
- •5.2.3. Защита от электромагнитных полей
- •Заключение
- •Библиографический список
- •620034, Екатеринбург, ул. Колмогорова, 66 УрГупс
- •Ю.С. Рыбаков
- •Процессы и аппараты защиты
- •Окружающей среды
- •Екатеринбург
1.4.5. Флотация
Флотация – процесс прилипания частиц флотируемого материала к поверхности раздела двух фаз, обычно газа (чаще воздуха) и жидкости, обусловленный избытком свободной энергии поверхностных пограничных слоев [1].
Процесс очистки сточных вод, содержащих ПАВ, нефть, нефтепродукты, масла, волокнистые материалы, методом флотации заключается в образовании комплексов «частицы-пузырьки», всплывании этих комплексов и удалении образовавшегося пенного слоя с поверхности обрабатываемой жидкости. Прилипание частицы к поверхности газового пузырька возможно только тогда, когда наблюдается несмачивание или плохое смачивание частицы жидкостью.
Смачивающая способность жидкости зависит от ее полярности, с возрастанием которой способность смачивать твердые тела уменьшается. Внешним проявлением способности жидкости к смачиванию является величина поверхностного натяжения ее на границе с газовой фазой, а также разность полярностей на границе жидкой и твердой фаз. Процесс флотации идет эффективно при поверхностном натяжении воды не более 60-65 мН/м. Степень смачиваемости водой твердых или газовых частиц, взвешенных в воде, характеризуется величиной краевого угла Θ. (рис. 1.15, 1.16).

Рис. 1.15. Условия смачиваемости и несмачиваемости твердых частиц
Чем больше этот угол, тем более гидрофобна поверхность частицы, то есть увеличивается вероятность прилипания к ней и прочность удержания на ее поверхности воздушных пузырьков. Такие частицы обладают малой смачиваемостью и легко флотируются. Большое значение при флотации имеет размер, количество и равномерность распределения воздушных пузырьков в сточной воде. Оптимальные размеры воздушных пузырьков – 15-30 мкм, а максимальные – 100-200 мкм.
Также используются и другие методы очистки жидкостей и газов: промывные или мокрые способы очистки газов, абсорбционные, адсорбционные, экстракционные, каталитические, электростатические и т.д.
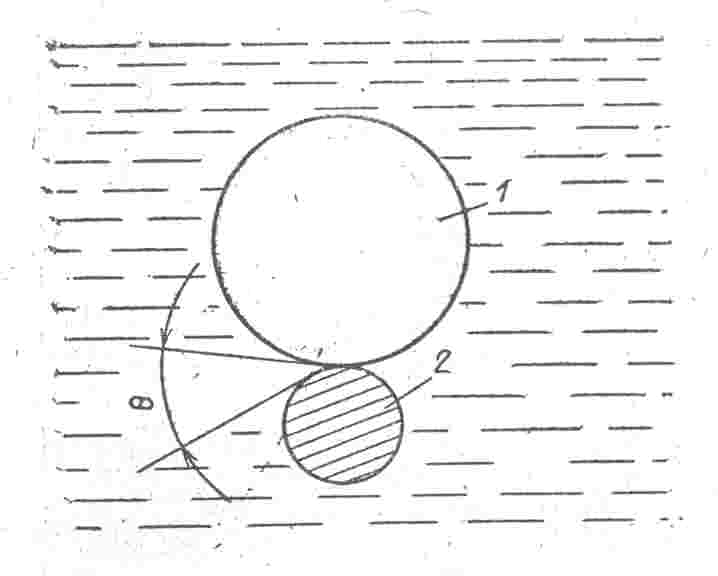
Рис. 1.16. Схема прилипания пузырька воздуха (1) к взвешенной
в воде частице (2)
1.5. Химические и биохимические процессы, протекающие при очистке вод
1.5.1. Химические процессы
В основе ряда природоохранных технологий лежат химические превращения. Большое значение в химических процессах имеет скорость протекания реакции. Основные факторы, влияющие на нее, – это концентрация реагирующих веществ, температура, наличие катализатора.
Увеличение концентрации взаимодействующих веществ – один из самых распространенных приемов интенсификации химического процесса. Зависимость скорости химических реакций от концентрации определяется законом действия масс. Согласно этому закону скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой вещества в уравнении реакции:
v= K CanCbm, (1.56)
где К – константа скорости реакции; Ca и Cb - концентрации веществ а и b, участвующих в химической реакции; n и m – стехиометрические коэффициенты.
Константа скорости реакции численно равна скорости реакции при концентрации реагирующих веществ, равной единице. Она зависит от природы реагирующих веществ, температуры, наличия катализаторов и не зависит от концентрации этих веществ. Для определения этих констант выведены соответствующие формулы, основанные на экспериментальных данных.
Влияние температуры. Известно, что с повышением температуры скорость реакции возрастает, что связано с увеличением константы скорости реакции. Согласно правилу Вант-Гоффа, повышение температуры на 10оС увеличивает скорость реакции в 2-4 раза. Это правило является приблизительным и применимо к реакциям, протекающим в интервале температур от 0 до 300оС.
Более точно влияние температуры на скорость химических реакций выражается соотношением, полученным экспериментальным путем:
 (1.57)
(1.57)
где b и a – постоянные для данной реакции, Т – температура, К.
Характер влияния температуры и концентрации реагирующих веществ на скорость протекания химических реакций можно объяснить теорией активных столкновений. Молекулы, обладающие определенной энергией, избыточной по сравнению со средней, способной разорвать химические связи, называются активными. Избыточная энергия при этом называется энергией активации и зависит от природы вступающих в реакцию веществ. При повышении температуры количество активных молекул увеличивается, число столкновений между ними возрастает, в результате чего растет скорость реакции. С увеличением концентрации реагирующих веществ общее число столкновений, в том числе эффективных, также возрастет, в результате увеличивается скорость реакции.
Влияние катализаторов. Катализатор – это вещество, которое, фактически не вступая в химическую реакцию, резко изменяет ее скорость. В присутствии катализатора реакции ускоряются в тысячи раз, могут протекать при более низких температурах, что экономически выгодно.
Неорганическими катализаторами преимущественно служат металлы в чистом виде (никель, кобальт, железо, платина), в виде оксидов или солей (оксиды ванадия, алюминия, соединения железа, магния, кальция, меди и т.п.). Неорганические катализаторы термостабильны, и реакции с ними протекают при сравнительно высоких температурах.
К катализаторам также относятся витамины, ускоряющие химические процессы в тысячи – десятки тысяч раз, а также ферменты, ускоряющие эти процессы в миллионы раз.
