- •Передмова
- •1.1. Дія лугу.
- •1.3 Дія реактиву Несслера (суміш k2HgI4 з koh).
- •1.4. Дія гідратартрату натрію (NaHc4h4o6).
- •1.5. Дія гексанітрокобальтату (ііі) натрію.
- •1.6. Дія гексагідроксостибіату (V) калію.
- •1.7. Дія цинкуранілацетату (Zn(uo2)3(Ac)8 або ZnAc2∙3uo2Ac2, де Ac− − іони ch3coo− ).
- •1.8. Забарвлення полум’я.
- •2.1. Дія групового реагенту ((nh4)2co3).
- •1.2. Дія розчину аміаку.
- •Хід аналізу суміші катіонів першої та другої аналітичних груп
- •Розділ 3. Катіони третьої аналітичної групи
- •4.10.1. Виявлення хрому.
- •Хід аналізу суміші катіонів першої, другої та третої груп
- •Розділ 4. Четверта група катіонів
- •7.14. Дія сірчаної кислоти.
- •Додаток Мікрокристалоскопічні реакції на іони калію та натрію.
- •Натрій.
- •Краплинні реакції на деякі катіони третьої та четвертої аналітичних груп. Алюміній.
4.10.1. Виявлення хрому.
Окислення хрому (ІІІ) в лужному середовищі здійснюють найчастіше із застосуванням пероксиду водню. До розчину солі Cr3+ спочатку додають надлишок лугу, суміш добре перемішують. Утворюється розчин хроміту зеленого кольору. До цього розчину додають H2O2, отриману суміш кип’ятять. При цьому хроміт окилюється до хромату, який має жовтий колір:
Cr(NO3)3 + 4 NaOH = Na[Cr(OH)4] + 3 NaOH;
2 Na[Cr(OH)4] + 3 H2O2 + 2 NaOH = 2 Na2CrO4 + 8 H2O;
2 [Cr(OH)4]− − 3ē + 4 OH− = CrO42− + 4 H2O;
3 H2O2 + 2 ē + 2 H+ = 2 H2O.
Наявність хромат-іона в розчині можна виявити застосовуючи бензидин. Розчин бензидину в концентрованій сірчаній кислоті безбарвний. При окисленні хроматом утворюються продукти синього кольору. Реакція виконується на смужці фільтрувального паперу.
|
─ 2ē → |
|
бензидин |
|
бензидинова синь |
Інші окисники також окислюють бензидин з утворенням таких саме продуктів синього кольору і, отже, заважають виявленню хромат-іону.
Окислення Cr3+ до хромату в лужному середовищі можна здійснити також за допомогою гіпохлориту чи гіпоброміту натрію при нагріванні:
2Cr(NO3)3 +3NaBrO + 10 NaOH = 2 Na2CrO4 + 3 NaBr + 6 NaNO3 + 5 H2O;
2 Cr3+ − 3 ē + 8 OH− = CrO42− + 4 H2O;
3 BrO− + 2 ē + H2O = Br− + 2 OH−.
У кислому середовищі хром (ІІІ) можна окислити до Cr2O72− за допомогою перманганату калію чи персульфату амонію при нагріванні. Розчини підкислюють сірчаною або азотною кислотою.
5Cr2(SO4)3 + 6 KMnO4 + 11H2O = 5H2Cr2O7 + 6MnSO4 + 3K2SO4 + 6H2SO4;
5 2Cr3+ − 6ē + 7H2O = Cr2O72− + 14H+;
6 MnO4− +5ē + 8H+ = Mn2+ + 4 H2O.
2Cr(NO3)3 + 3(NH4)2S2O8 + 7H2O = H2Cr2O7 + 3(NH4)2SO4 + 3H2SO4 +
+ 6HNO3;
1 2Cr3+ − 6ē + 7H2O = Cr2O72− + 14H+;
3 S2O82− + 2ē = 2SO42−
Cr3+ або Cr2O72− можна виявити в розчині також за реакцією утворення надхромової кислоти. Реакцію проводять так: в пробірку вміщують по 0,5 мл розчинів H2O2, сірчаної кислоти (2 моль/л) та ефіру (або амілового спирту) і трохи збовтують. До отриманого суміші додають дві-три краплини досліджуваного розчину, що містить Cr2O72−. Біхромат-іон в кислому середовищі взаємодіє з H2O2, утворюючи пероксид хрому CrO5 синього кольору. Рівняння реакції можна записати так:
|
+ 2H+ + 4 H2O2 → |
|
+ 5 H2O |
Розчин пероксиду хрому у воді є надхромовою кислотою:
CrO5 + H2O = H2CrO6.
Надхромова кислота у водному розчині дуже нестійка, тому реакцію проводять з додаванням органічного розчинника.
4.10.2 Виявлення марганцю.
Для виявлення марганцю застосовують реакцію окислення Mn2+ до MnO4−. В лужному середовищі як окисник беруть гіпоброміт натрію NaBrO, яий при наявності каталізатора (CuSO4) та нагріванні окислює Mn2+ до MnO4− за реакцією:
2 MnSO4 + 5 NaBrO + 6 NaOH = 2 NaMnO4 + 2 Na2SO4 + 5 NaBr + 3H2O;
2 Mn2+ − 5 ē + 8 OH− = MnO4− + 4 H2O;
5 BrO− + 2 ē + H2O = Br− + 2 OH−.
Виявленню марганцю цією реакцією не заважають інші катіони. Реакцію проводять так: в пробірку вміщують одну-дві краплини (не більше!) досліджуваного розчину, дві краплини CuSO4 і додають NaOH в значному надлишку, доки густа спочатку суміш не стане вільно перемішуватись. Після цього додають розчин гіпоброміту натрію (приблизно третину пробірки), суміш перемішують і обережно нагрівають до кипіння. За наявності марганцю розчин над осадом набуває малиново-фіалкового забарвлення, характерного для MnO4−. З часом фіалкове забарвлення поступово змінюється на зелене, що належить манганат-іону MnO42−, який в лужному середовищі є досить стійким. Якщо в розчині немає каталізатора, тоді Mn2+ окислюється гіпобромітом до оксиду Mn(IV) (осад темнокоричневого кольору). Таким же чином діють в лужних розчинах хлорна та бромна вода.
Такий окисник як H2O2, в лужному середовищі окислює Mn2+ до MnO(OH)2 за реакцією
MnSO4 + H2O2 + 2 NaOH = MnO(OH)2 + Na2SO4 + H2O;
Mn2+ − 2 ē + 4 OH− = MnO(OH)2 + H2O;
H2O2 + 2 ē + 2 H+ = 2 H2O.
В кислому середовищі для виявлення марганцю застосовують такі окисники, як NaBiO3, PbO2 та (NH4)2S2O8.
Вісмутат натрію в азотнокислому середовищі при кімнатній температурі окислює Mn2+ до MnO4−. Ця реакція забезпечує виявлення марганцю в розчинах, що містять всі інші катіони. Реакцію проводять так: в пробірку вміщують одну! краплину досліджуваного розчину, чотири-п’ять мл! HNO3 і дрібочку сухого вісмутату натрію. За наявності марганцю розчин набуває малиново-фіалкового забарвлення.
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 +7H2O ;
2 Mn2+ − 5 ē + 4 H2O = MnO4− + 8 H+;
5 BiO3− + 2 ē + 6 H+ = Bi3+ + 3 H2O.
Диоксид свинцю в азотнокислому середовищі окислює Mn2+ до MnO4− за реакцією:
2Mn(NO3)2+ 5 PbO2 + 6 HNO3 = 2 HMnO4 + 5 Pb(NO3)2 + 2 H2O ;
2 Mn2+ − 5 ē + 4 H2O = MnO4− + 8 H+ ;
5 PbO2 + 2 ē +4 H+ = Pb2+ + 2 H2O .
Реакцію проводять так: в пробірку насипають трохи сухого PbO2, наливають 1 мл концентрованої HNO3 і суміш обережно нагрівають до кипіння. Потім додають 2-3 краплини досліджуваного розчину і знову нагрівають до кипіння, легко струшуючи при цьому пробірку. Після охолодження до суміші додають приблизно 0,5 мл води і проводять центрифугування (або дають відстоятись). За наявності марганцю розчин над осадом набуває малиново-фіалкового забарвлення.
Персульфат амонію в кислому розчині, що містить каталізатор (AgNO3), окислює Mn2+ до MnO4− за рівнянням:
2 MnSO4 + 5 (NH4)2S2O8 + 8 H2O = 2 HMnO4 + 5 (NH4)2SO4 + 7 H2SO4;
2 Mn2+ − 5ē + 4 H2O = MnO4− + 8 H+;
5 S2O82− + 2 ē = 2 SO42−.
Реакцію проводять так: в пробирку вміщують два-три кристалика персульфату амонію, 0,5 мл розчину HNO3 (2 моль/л) і дві-три краплини розчину AgNO3. Суміш нагрівають до 60-70оС, додають одну краплину досліджуваного розчину і перемішують. За наявності марганцю розчин набуває малиново-фіалкового забарвлення. Якщо марганцю забагато, може випасти темний осад MnO(OH)2. Якщо розчин містить багато каталізатора, суміш може набути жовтого забарвлення (пероксид срібла), і це не дозволяє зробити надійний висновок про наявність марганцю.
4.11. Дія роданіду амонію.
Роданід амонію утворює з іонами Fe3+ розчинні комплексні сполуки різного складу – від [Fe(SCN)]2+ до [Fe(SCN)6)]3−, забарвлені в червоний колір, причому, чим більше груп роданіду координовано, тим інтенсивніше забарвлення. Це одна з найбільш чутливих і характерних реакцій для Fe3+. Її можна застосувати для виялення Fe3+ в розчині, що містить всі інші катіони першої-п’ятої аналітичних груп. Заважають аніони F−, PO43−, C4H4O62− та інші, які зв’язують Fe3+ в більш стійкі безбарвні комплекси.
Роданід амонію є характерним реагентом також і для Co2+. Але реакцію треба проводити в середовищі ацетону або іншого органічного розчинника, тому що комплекс [Co(SCN)4]2−, що утворюється, нестійкий у водному розчині і повністю розкладається на іони. У водно-ацетоновому середовищі взаємодія між Co2+ та роданідом відбувається за рівнянням:
CoSO4 + 4 NH4SCN = (NH4)2[Co(SCN)4] + (NH4)2SO4
Комплекс, що утворюється, має блакитно-синій колір. Він легко екстрагується з водного розчину аміловим спиртом.
Виявленню кобальту з катіонів третьої аналітичної групи заважає лише Fe3+, який можна замаскувати додаванням до розчину фторид- або пірофосфат-іонів, які утворюють з іонами Fe3+ стійкі безбарвні комплексні сполуки.
Інші катіони третьої групи з роданід-іоном не взаємодіють.
4.12. Дія тетрароданомеркуріату амонію.
Розчин (NH4)2[Hg(SCN)4] з солями цинку утворює осад Zn[Hg(SCN)4] білого кольору, а з солями міді – осад Cu[Hg(SCN)4] жовто-зеленого кольору. Якщо ж в розчині є і Zn2+ і Cu2+, випадає осад сіро-фіалкового кольору. Цю реакцію застосовують для виявлення цинку. Реакцію виконують так: в пробірку вміщують дві-три краплини досліджуваного розчину, додають дві-три краплини розбавленої сірчаної кислоти, дві-три краплини розчину CuSO4 і чотири-п’ять краплин тетрароданомеркуріату амонію. Суміш перемішують. За наявності цинку спостерігається утворення осаду сіро-фіалкового кольору.
Для виявлення цинку можна використати також реакцію, що подібна до описаної, але замість Cu2+ додати сіль Co2+. З іонами кобальту тетрароданомеркуріат амонію утворює осад Co[Hg(SCN)4] синього кольору, а якщо в розчині є також і Zn2+, випадає осад блакитного кольору:
Zn2+ + Co2+ +2[Hg(SCN)4]2− = Zn[Hg(SCN)4]•Co[Hg(SCN)4]
Цю саму реакцію можна використати для виявлення Co2+в розчині.
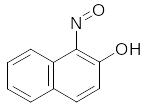
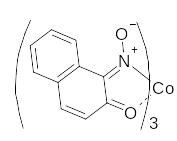
4.13. Дія 1-нітрозо-2-нафтолу.
1-нітрозо-2-нафтол (або α-нітрозо β-нафтол, реактив Ільїнського) є одним з найбільш характерних реагентів на Co2+. В кислому середовищі Co2+ окислюється до Co3+ і взаємодіє з реагентом з утворенням нерозчинної у воді та розведених мінеральних кислотах внутрішньо-комплексної сполуки червоно-бурого кольору за рівнянням:
3 |
|
+ Co2+ |
− ē → |
|
+ 3 H+ |
З 1-нітрозо-2-нафтолом взаємодіють також Fe3+, Cu2+, Hg2+ та ряд інших, проте осади, що утворюються, розчиняються в мінеральних кислотах. Перелічені вище катіони можна замаскувати фосфат-іонами.
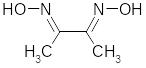
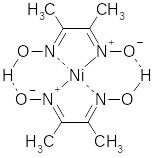
4.14. Дія диметилгліокіиму.
Диметилгліоксим (реактив Чугаєва) є характерним реагентом для Ni2+. В результаті реакції утворюється нерозчинна у воді внутрішньокомплексна сполука червоного кольору:
2 |
|
+ Ni2+ + 2 NH3 → |
|
+2NH4+ |
Осад розчиняється в сильних кислотах. Тому реакцію починають проводити в слабококислому середовищі (рН ~ 5), а потім до розчину додають аміак. Реакцію виконують так: в пробірку вміщують по дві-три краплини досліджуваного розчину, спиртового розчину диметилгліоксиму та розбавлений розчин аміаку до появи запаху. За наявності нікелю випадає яскравий червоно-рожевий осад.
Виявленню нікелю заважає Fe3+, який утворює за атких умов осад Fe(OH)3. Проте його можна замаскувати винною кислотою або фосфат-іоном.
Диметилгліоксим утворює також розчинні комплексні сполуки червоного кольору з іонами Fe2+, Co2+ та Cu2+; умови проведення реакцій такі самі, як і при утворенні диметилгліоксимату нікелю. Ці іони так само, як і Fe3+, можна замаскувати фосфат-іонами.
4.15. Дія алізарину.
Алізарин є характерним реагентом для Al3+, утворюючи з ним комплексну сполуку червоного кольору (“алізариновий лак”), яка не розчиняється в розведеній оцтовій кислоті.
-
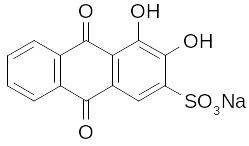
+ AlCl3 + 3NH4OH =
= 3NH4Cl + 2H2O +
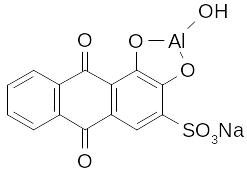
Реакція проводиться в слабкокислому середовищі (рН ~ 5), де сам алізарин має жовтий колір. В розчинах з рН > 5 алізарин має червоно-фіолетовий колір і тому заважає виявленню Al3+.
Алізарин не є специфічним реагентом для виявлення алюмінію; з алізарином в подібних умовах реагують всі катіони, що утворюють малорозчинні гідроксиди; та і зовнішні характеристики осадів схожі (різняться лише відтінками). Тому, щоб уникнути помилок при визначенні алюмінію, необхідно створити спеціфічні умови проведення реакції: іони хрому (ІІІ) переводять в хромат-іони, а інші катіони – зв’язують з K4[Fe(CN)6].
При тренуванні реакцію виконують так: до невеликої кількості розчину солі алюмінію додають надлишок лугу до утворення алюмінату натрію. До отриманого розчину додають води та надмір сухого хлориду амонію. Суміш кип’ятять. Осад Al(OH)3, який при цьому утворюється, відфільтровують і до осаду на фільтрі додають дві-три краплини розчину алізарину. Далі осад, що набув червоного кольору, промивають два-три рази холодною водою для видалення надміру алізарину. За наявності алізарату алюмінію осад після промивання повинен зберегти червоне забарвлення.
Або: на фільтр вміщують краплину розчину солі алюмінію. Після того, як розчин ввійде в папір, пляму обводять (“обмальовують”) капіляром з розчином алізарину. Потім цей фільтр тримають над отвором пляшки з концентрованим розчином аміаку (під тягою!) поки розчин алізарину (по краю) не стане червоно-фіалковим. Та ж зона, де зустрілись розчини солі алюмінію та алізарину, забарвлюється при цьому в червоний колір.