- •Передмова
- •1.1. Дія лугу.
- •1.3 Дія реактиву Несслера (суміш k2HgI4 з koh).
- •1.4. Дія гідратартрату натрію (NaHc4h4o6).
- •1.5. Дія гексанітрокобальтату (ііі) натрію.
- •1.6. Дія гексагідроксостибіату (V) калію.
- •1.7. Дія цинкуранілацетату (Zn(uo2)3(Ac)8 або ZnAc2∙3uo2Ac2, де Ac− − іони ch3coo− ).
- •1.8. Забарвлення полум’я.
- •2.1. Дія групового реагенту ((nh4)2co3).
- •1.2. Дія розчину аміаку.
- •Хід аналізу суміші катіонів першої та другої аналітичних груп
- •Розділ 3. Катіони третьої аналітичної групи
- •4.10.1. Виявлення хрому.
- •Хід аналізу суміші катіонів першої, другої та третої груп
- •Розділ 4. Четверта група катіонів
- •7.14. Дія сірчаної кислоти.
- •Додаток Мікрокристалоскопічні реакції на іони калію та натрію.
- •Натрій.
- •Краплинні реакції на деякі катіони третьої та четвертої аналітичних груп. Алюміній.
Розділ 4. Четверта група катіонів
До четвертої групи катіонів відносяться катіони Ag+, Pb2+, Hg22+, Cu2+, Hg2+, Cd2+ Bi3+. До цієї ж групи належать золото і талій.
Головною особливістю катіонів четвертої групи є те, що їх сульфіди нерозчинні у воді, розведених кислотах (за виключенням HNO3) та полісульфіді амонію. Груповим реагентом є сірководень в кислому середовищі. Слід відзначити, що за цих умов сірководень осаджує і катіони п’ятої групи, але їх сульфіди розчинні в полісульфіді амонію.
Катіони четвертої групи поділяються на дві підгрупи. Розподіл базується на різній розчинності хлоридів. До першої підгрупи, що називають підгрупою срібла, відносяться катіони Ag+, Hg22+, Pb2+(а також Au+ та Tl+), хлориди яких не розчинні у воді. Груповим реагентом є розведена соляна кислота.
До другої підгрупи, яку називають підгрупою міді, належать Cu2+, Hg2+, Cd2+ та Bi3+, хлориди яких добре розчинні у воді.
Таким чином, соляна кислота використовується в аналізі для відділення катіонів підгрупи срібла від інших катіонів.
7.1. Дія сірководню.
Сульфіди катіонів четвертої групи мають дуже малу розчинність у порівнянні з сульфідами катіонів третьої групи і тому випадають в осад навіть при дії H2S, в розчині якого концентрація сульфід-іонів дуже мала. Осадження катіонів четвертої групи сірководнем провадиться в кислому середовищі, що забезпечує повне відділення четвертої групи від третьої групи катіонів, сульфіди яких легко розчинні в розведених кислотах.
При дії сірководню на розчини солей Ag+, Pb2+, Hg22+, Cu2+ та Hg2+ випадають сульфіди чорного кольору; іони Cd2+ утворюють осад CdS жовтого кольору, а Bi3+ – осад Bi2S3 темно-коричневого кольору.
При дії сірководню на розчин Hg2(NO3)2 в осад випадає суміш HgS та Hg:
Hg2(NO3)2 + H2S = HgS + Hg + 2 HNO3.
Жодний з сульфідів катіонів четвертої групи не розчиняється в оцтовій кислоті. В соляній та розведеній сірчаній кислотах не розчиняються сульфіди срібла, свинцю, ртуті та міді. Сульфід вісмуту розчиняється в гарячій концентрованій соляній кислоті:
Bi2S3 + 6 HCl = 2 BiCl3 + 3 H2S.
Легко розчиняється в гарячих розведених HCl та H2SO4 і сульфід кадмію:
CdS + H2SO4 = CdSO4 + H2S.
Сульфіди всіх катіонів четвертої групи, за винятком HgS, розчиняються в розведеній HNO3 при нагріванні, наприклад:
3 Ag2S + 8 HNO3 = 6 AgNO3 + 3 S + 2 NO + 4 H2O.
HgS розчиняється тільки в концентрованій HNO3, царській водці та в HCl у присутності окисників:
3 HgS + 2 HNO3 + 6 HCl = 3 HgCl2 + 3 S + 2 NO + 4 H2O;
HgS + H2O2 + 2 HCl = HgCl2 + S + 2 H2O;
S2– – 2 ē = So ;
H2O2 + 2 ē + 2 H+ = 2 H2O.
Ag2S не розчиняється в аміаку, ціаніді та тіосульфаті натрію.
PbS не розчиняється в лугах. При дії гарячої концентрованої HNO3 сульфід свинцю окислюється до сульфату:
PbS + 8 HNO3 = PbSO4 + 8 NO2 + 4 H2O.
Сульфід міді помітно розчинний в надлишку ціаніду калію.
Сульфіди катіонів четвертої групи практично не розчиняються в сульфіді амонію; в сульфідах лужних металів розчиняються лише HgS та трохи Bi2S3 з утворенням комплексних солей Na2HgS2 та NaBiS2. В полісульфіді амонію помітно розчинний лише CuS.
7.2. Дія соляної кислоти.
При дії HCl на катіони Ag+, Pb2+ та Hg22+ утворюються білі осади AgCl, PbCl2 та Hg2Cl2. З них найбільш розчинний PbCl2, тому при додаванні HСl до суміші катіонів четвертої групи з метою відділення підгрупи срібла, свинець не повністю переходить в осад, а частково залишається в розчині разом з катіонами підгрупи міді.
PbCl2 добре розчинний в гарячій воді, що використовують для відділення Pb2+ від Ag+ та Hg22+. Осади AgCl, PbCl2 та Hg2Cl2 не розчиняються в розведених HNO3 та H2SO4. При дії концентрованої HCl осади хлоридів срібла та свинцю помітно розчиняються внаслідок утворення безбарвних комплексних іонів:
AgCl + Cl– = [AgCl2]–;
PbCl2 + 2 Cl– = [PbCl4]2–.
Hg2Cl2 в концентрованій HCl не розчиняється, але розчиняється в азотній кислоті:
3 Hg2Cl2 + 8 HNO3 = 3 Hg(NO3)2 + 3 HgCl2 + 2 NO + 4 H2O.
AgCl під дією світла легко розкладається з виділенням дрібнодисперсного металічного срібла, внаслідок чого білий осад AgCl досить швидко набуває сіро-фіалкового відтінку, а потім темніє.
AgCl легко розчиняється в аміаку і карбонаті амонію:
AgCl + 2 NH4OH = [Ag(NH3)2]Cl + 2 H2O.
При підкисленні розчину аміакату срібла азотною кислотою в осад випадає AgCl:
[Ag(NH3)2]Cl + 2 HNO3 = AgCl + 2 NH4NO3.
Така послідовність перетворень – розчинення AgCl в аміаку та наступне підкислення розчину, в результаті якого знову випадає AgCl, використовується в аналізі для відділення Ag+ від Pb2+ та Hg22+, а також для виявлення Ag+ в розчині.
AgCl розчинний також в ціаніді калію, роданіді амонію та тіосульфаті натрію, при цьому утворюються комплексні іони [Ag(CN)2]–, [Ag(SCN)2]– [Ag(S2O3)2]3–.
Hg2Cl2 (каломель) при дії аміаку чорніє внаслідок виділення металічної ртуті. При цьому виділяється також осад хлориду меркурамонію NH2HgCl білого кольору, але через ртуть, що виділяється, осад має чорний колір:
Hg2Cl2 + 2 NH4OH = NH2HgCl + Hg + NH4Cl + 2 H2O.
Ця реакція є однією із характерних на іон Hg22+.
7.3. Дія лугу.
Розчин NaOH або KOH з іоном Ag+ утворюють білий осад AgOH, який швидко розкладається з утворенням оксиду Ag2O бурого кольору:
AgNO3 + KOH = AgOH + KNO3;
2 AgOH = Ag2O + H2O.
Осад Ag2O легко розчиняється в азотній кислоті та аміаку.
Іон Pb2+ при дії невеликої кількості лугу утворює білий осад Pb(OH)2, легко розчинний в надлишку лугу з утворенням гідроксоплюмбіту:
Pb(NO3)2 + 2 KOH = Pb(OH)2 + 2 KNO3;
Pb(OH)2 + 2 KOH = K2[Pb(OH)4].
Pb(OH)2 легко розчиняється в розведеній HNO3.
Іон Hg22+ при дії лугу утворює чорний осад закису ртуті:
Hg2(NO3)2 + 2 KOH = Hg2O + 2 KNO3 + H2O.
Іон Hg2+ при дії лугу утворює оксид жовтого кольору:
Hg(NO3)2 + 2 KOH = HgO + 2 KNO3 + H2O.
При додаванні лугу до розчину солі Cu2+ виділяється блакитний гідроксид міді, що має слабкі амфотерні властивості і частково розчинний в надлишку концентрованого лугу з утворенням гідроксокупрату блакитного кольору:
Cu(OH)2 + KOH = K[Cu(OH)3].
Cu(OH)2 розчиняється в деяких органічних кислотах – лимонній, винній (внаслідок утворення комплексних сполук), а також в аміаку з утворенням комплексного аміак ату міді [Cu(NH3)4]2+
Іони Cd2+ та Bi3+ при додаванні лугу утворюють білі осади гідроксидів – Cd(OH)2 та Bi(OH)3, які не розчиняються в надлишку лугу, але легко розчиняються в кислотах, а Cd(OH)2 – ще й в аміаку з утворенням безбарвного аміакату [Cd(NH3)4]2+. Цією реакцією можна користуватись для відділення Bi3+ від Cd2+.
7.4. Дія аміаку.
При дії гідроксиду амонію на катіони Ag+ утворюється бурий осад Ag2O, що одразу ж розчиняється в надлишку NH4OH з утворенням безбарвного комплексного аміакату срібла:
Ag2O + 4 NH4OH = 2 [Ag(NH3)2](OH) + 3 H2O.
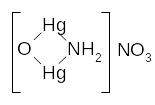
Іони Hg22+ з NH4OH утворюють білий осад нітрату оксидимеркурамонію [OHg2NH2]NO3, при цьому виділяється металічна ртуть чорного кольору. Таким чином, зовнішний ефект реакції – утворення осаду чорного кольору:
2 Hg2(NO3)2 + 4 NH4OH = |
|
+ 2 Hg + 3 NH4NO3 + 3H2O |
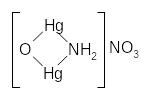
Іони Hg2+ утворюють з аміаком білий осад нітрату оксидимеркурамонію, який лише частково розчиняється в надлишку аміаку:
2 Hg(NO3)2 + 4 NH4OH = |
|
+ 3 NH4NO3 + 3 H2O |
Іони Pb2+, Cd2+ та Bi3+ прни дії невеликої кількості аміаку утворюють відповідні гідроксиди, а іон Cu2+ - основну сіль, наприклад, Cu2(OH)2SO4 блакитно-зеленого кольору. У надлишку NH4OH розчиняються тільки сполуки міді та кадмію з утворенням аміакатів – синього [Cu(NH3)4]2+ та безбарвного [Cd(NH3)4]2+ :
Cu2(OH)2SO4 + 10 NH4OH = 2 [Cu(NH3)4](OH)2 + (NH4)2SO4 + 8 H2O;
Cd(OH)2 + 4 NH4OH = [Cd(NH3)4](OH)2 + 4 H2O.
Таким чином, дією надлишку розчину аміаку на катіони четвертої групи відділяють іони Ag+, Cu2+ та Cd2+ від іонів Hg22+, Hg2+, Pb2+ та Bi3+. Реакція з аміаком є характерною на Cu2+. Виявленню Cu2+ за цією реакцією заважає лише іон Ni2+, який утворює аміакат схожого кольору. Аміакат міді досить стійкий, але сірководень розкладає його з виділенням сульфіду міді, а ціанід калію – з утворенням стійкого безбарвного комплексу тетраціанокуприту K3[Cu(CN)4]:
[Cu(NH3)4](OH)2 + H2S + 2 H2O = CuS + 4 NH4OH;
2 [Cu(NH3)4](OH)2 + 9 KCN + 7 H2O = 2 K3[Cu(CN)4] +KCNO + 2 KOH +
+8 NH4OH.
Комплекс K3[Cu(CN)4] настільки стійкий, що не розкладається навіть при дії сірководню.
Аміакат кадмію руйнується ціанідом з утворенням безбарвного комплексу K2[Cd(CN)4], але останній менш стійкий за комплекс міді і при діі сірководню виділяє жовтий осад CdS:
K2[Cd(CN)4] + H2S = CdS + 2 KCN + 2 HCN.
Цим користуються в аналізі для виявлення Cd2+ в присутності Cu2+.
7.5. Дія карбонатів лужних металів та амонію.
Розчини Na2CO3, K2CO3 та (NН4)2CO3 з іоном Ag+ утворюють білий осад карбонату срібла, а з іонами Pb2+, Cu2+, Cd2+ та Bi3+ – основні карбонати:
2 Ag+ + CO32– = Ag2CO3;
2 Pb2+ + 3 CO32– + 2H2O = Pb2(OH)2CO3 + 2 HCO3–;
2 Bi3+ + 4 CO32– + 2 H2O = 2 Bi(OH)CO3 + 2 HCO3–.
З перелічених сполук забарвлений лише основний карбонат міді (Cu2(OH)2CO3 – зеленого кольору), всі інші – білі.
Гідрокарбонат натрію осаджує Pb2+ у вигляді середнього карбонату PbCO3 білого кольору:
Pb2+ + 2 HCO3– = PbCO3 + CO2 + H2O.
Ag2CO3, а також основні карбонати міді та кадмію легко розчиняються в надлишку аміаку з утворенням відповідних аміакатів.
Ag2CO3 та Cu2(OH)2CO3 легко розчиняються також в надлишку карбонату амонію, проте Cd2(OH)2CO3 в (NH4)2CO3 розчиняється важко.
При дії карбонат-іона на солі Hg22+ утворюється осад Hg2CO3 жовтого кольору, який нестійкий і легко розкладається з виділенням металічної ртуті та жовтого оксиду HgO:
Hg2CO3 = HgO + Hg + CO2.
Іон Hg2+ з Na2CO3 утворює основну сіль червоно-бурого кольору відповідно до рівняння:
2 Hg(NO3)2 + 2 Na2CO3 = HgCO3•HgO + CO2 + 4 NaNO3.
7.6. Дія гідрофосфату натрію.
Гідрофосфат натрію з іонами Ag+ утворює жовтуватий осад фосфату срібла, який розчиняється в азотній кислоті та аміаку:
3 AgNO3 + 2 Na2HPO4 = Ag3PO4 + NaH2PO4 + 3 NaNO3.
З іоном Pb2+ гідрофосфат натрію утворює білий осад фосфату свинцю, розчинний в азотній кислоті та лугах:
3Pb(NO3)2 + 4 Na2HPO4 = Pb3(PO4)2 +6 NaNO3 + 2 NaH2PO4.
Іони Hg22+ та Hg2+ утворюють з гідро фосфатом білі осади відповідно Hg2HPO4 та Hg3(PO4)2:
Hg2(NO3)2 + Na2HPO4 = Hg2HPO4 + 2 NaNO3;
3 Hg(NO3)2 + 4 Na2HPO4 = Hg3(PO4)2 + 2 NaH2PO4 + 6 NaNO3.
Hg2HPO4 розчинний в азотній кислоті, а Hg3(PO4)2 – в соляній з утворенням малодисоційованої сполуки HgCl2.
З іонами Cd2+ гідрофосфат утворює осад фосфату Cd3(PO4)2 білого кольору:
3 Cd(NO3)2 + 4 Na2HPO4 = Cd3(PO4)2 + 2 Na2HPO4 + 6 NaNO3.
З іонами Cu2+ утворюється світло-блакитний осад змінного складу, який як і Cd3(PO4)2 розчинний в мінеральних кислотах, оцтовій кислоті та аміаку.
Гідро фосфат натрію осаджує іон Bi3+ у вигляді білого осаду BiPO4, який не розчиняється в розведеній HNO3, але розчиняється в розведеній HCl:
Bi(NO3)3 + 2 Na2HPO4 = BiPO4 + NaH2PO4 + 3 NaNO3.
7.7. Дія йодиду калію.
З іоном Ag+ йодод калію утворює осад AgI, який практично не розчиняється в аміаку, але легко розчиняється в ціаніді калію та тіосульфаті натрію з утворенням комплексних сполук за реакціями:
AgI + 2 KCN = K[Ag(CN)2] + KI;
AgI + 2 Na2S2O3 = Na3[Ag(S2O3)2] + NaI.
Осад AgI трохи розчиняється в концентрованому розчині йодиду калію з утворенням безбарвної комплексної сполуки K[AgI2].
З іонами Hg22+ та Hg2+ йодид калію утворює осади Hg2I2 та HgI2 зеленого та померанчево-червоного кольорів відповідно. Обидва осади розчиняються в надлишку йодиду калію з утворенням безбарвної комплексної сполуки K2[HgI4]. У випадку Hg2I2 розчинення супроводжуеться виділенням металічної ртуті:
Hg2I2 + 2 KI = K2[HgI4] + Hg.
З іоном Pb2+ йодид утворює жовтий осад PbI2, який розчиняється в надлишку KI з утворенням комплексної сполуки K2[PbI4].
Характерною особливістю осаду PbI2 є його розчинність в гарячій воді. Після охолодження осад PbI2 випадає знову, але вже у вигляді блискучих золотавих кристаликів. Це одна з найбільш характерних реакцій на Pb2+. Вона відома під назвою “золотого дощу”.
З іоном Bi3+ утворює осад BiI3 чорного кольору, який розчиняється в надлишку KI з утворенням комплексної сполуки K[BiI4] померанчевого кольору.
При дії йодиду калію на іон Cu2+ виділяється вільний йод, а Cu2+, відновлюючись йодидом до Cu+, утворює з йодидом білий осад Cu2I2:
2 CuSO4 + 4 KI = Cu2I2 + I2 + 2 K2SO4.
З іоном Cd2+ йодид калію легко утворює добрерозчинну безбарвну комплексну сполуку K2[CdI4].
Йодид калію вважається одним з найбільш характерних реагентів на іони Pb2+, Hg2+, Bi3+, Cu2+.
7.8. Дія ціаніду калію.
При дії ціаніду калію на катіони Ag+, Pb2+, Cd2+ утворюються осади ціанідів білого кольору – AgCN, Pb(CN)2 та Cd(CN)2. Всі ці осади, за винятком AgCN, розчинні в розведених кислотах; AgCN розчиняеться тільки в концентрованій азотній кислоті при нагріванні. Ціаніди срібла і кадмію розчиняються в надлишку KCN з утворенням комплексних сполук:
AgCN + KCN = K[Ag(CN)2];
Cd(CN)2 + 2 KCN = K2[Cd(CN)4].
Іони Bi3+ при дії KCN також спочатку утворюють Bi(CN)3, але останній внаслідок гідролізу повністю перетворюється в малорозчинний Bi(OH)3. Таким чином, продуктом реакції Bi3+ з KCN є гідроксид вісмуту:
Bi(NO3)3 + 3 KCN + 3 H2O = Bi(OH)3 + 3 HCN + 3 KNO3.
Іони міді при взаємодії з KCN утворюють спочатку дуже нетривкий осад ціаніду міді Cu(CN)2 жовтого кольору, який в момент утворення відразу ж відщеплює диціан і переходить в безбарвний Cu2(CN)2:
2 CuCl2 + 4 KCN = Cu2(CN)2 + (CN)2 + 4 KCl;
2Cu2+ + 2 ē = Cu22+;
2 CN– –2 ē = (CN)2.
Ціанід міді (І) розчинний в надлишку KCN з утворенням комплексних сполук, наприклад, K3[Cu(CN)4].
З іоном Hg2+ ціанід-іон утворює добре розчинний у воді безбарвний комплекс Hg(CN)2, тому при додаванні KCN до розчину Hg2+ ніякого зовнішного ефекту не спостерігається. При додаванні KCN до розчину Hg22+ в осад випадає металічна ртуть і утворюється Hg(CN)2:
Hg2(NO3)2 + 2 KCN = Hg(CN)2 + Hg + 2 KNO3.
Hg(CN)2 реагує з надлишком KCN з утворенням комплексної сполуки K2[Hg(CN)4].
Таким чином, із катіонів четвертої групи лише Bi3+ не утворює складних ціанідних сполук.
Відносно ж утворення ціанідних комплексів свинцю в літературі прямих доказів немає.
7.9. Дія тіосульфату натрію Na2S2O3.
При дії невеликої кількості тіосульфату натрію з іонами Ag+, Pb2+ та Bi3+ утворюються солі:
2 Ag+ + S2O32– = Ag2S2O3;
Pb2+ + S2O32– = PbS2O3;
2 Bi3+ + 3 S2O32– = Bi2(S2O3)3.
Солі Cu2+ з тіосульфатом утворюють тіосульфат Cu+:
2 Cu2+ + 3 S2O32– = Cu2S2O3 + S4O62–.
При нагріванні тіосульфатні солі розкладаються з утворенням сульфіду відповідного металу:
Ag2S2O3 + H2O = Ag2S + H2SO4;
PbS2O3 + H2O = PbS + H2SO4;
Bi2(S2O3)3 + 3 H2O = Bi2S3 + 3 H2SO4.
При дії надлишку тіосульфату іони Ag+, Pb2+, Cu2+, Hg2+ утворюють комплексні сполуки Na3[Ag(S2O3)2], Na4[Pb(S2O3)3], Na[Cu(S2O3)] (Cu2+, як було вказано раніше, відновлюється до Cu+) і Na4[Hg(S2O3)3], наприклад:
AgNO3 + 2 Na2S2O3 = Na3[Ag(S2O3)2] + NaNO3.
Ці комплексні сполуки при нагріванні розкладаються з утворенням сульфідів відповідних металів і сірчаної кислоти; враховуючи, що тіосульфат натрію розкладається кислотою за схемою:
Na2S2O3 + H2SO4 = Na2SO4 + S + SO2 + H2O,
процес розкладання тіосульфатних комплексів при нагріванні можна записати, наприклад, так:
2 Na3[Ag(S2O3)2] + H2O = (Ag2S + H2SO4 + 3 Na2S2O3) =
= Ag2S + Na2SO4 + S + SO2 + H2O + 2 Na2S2O3.
Всі катіони четвертої аналітичної групи (за винятком Cd2+) при дії тірсульфату натрію в кислому середовищі при нагріванні осаджуються у вигляді сульфідів:
2AgNO3 + 4Na2S2O3 + 2H2SO4 = Ag2S + 3S + 3SO2 + 2NaNO3 + 3 Na2SO4
+ 2 H2O;
Pb(NO3)2 + 3Na2S2O3 + H2SO4 = PbS + 2S + 2SO2 + 2NaNO3 + 2 Na2SO4 +
+ H2O;
2Bi(NO3)3 + 3Na2S2O3 + 3H2O = Bi2S3 + 6NaNO3 + 3 H2SO4;
або, оскільки Na2S2O3 береться у надлишку, то:
2Bi(NO3)3 + 6Na2S2O3 = Bi2S3 + 3S + 3SO2 + 6NaNO3 + 3 Na2SO4;
Hg(NO3)2 + 2Na2S2O3 = HgS + S + SO2 + 2NaNO3 + Na2SO4.
Іони міді (ІІ) за таких умов відновлюються до міді(І):
2 CuSO4 + 3 Na2S2O3 + H2O = Cu2S + 2S + SO2 + 3 Na2SO4 + H2SO4;
або при надлишку Na2S2O3:
2 CuSO4 + 4 Na2S2O3 = Cu2S + 3S +2 SO2 + 4 Na2SO4 .
Іони Hg22+ дисмутують на іони Hg2+ та HgO:
Hg2(NO3)2 + 2 Na2S2O3 = HgS + Hg + S + SO2 + Na2SO4 + 2 NaNO3.
Cd2+ за таких умов тіосульфатом не осаджується, сульфіду не утворює, що й використовується для відділення його від інших катіонів четвертої аналітичної групи.
Крім того, тіосульфат в наведених умовах може бути використаний замість сірководню і для відділення катіонів четвертої і п’ятої аналітичних груп від третьої та першої аналітичних груп (друга група випадає в осад у вигляді сульфатів). Слід пам’ятати, що при цьому вводиться іон натрію.
7.10. Дія гексаціаноферату (ІІ) (фероціаніду) калію.
K4[Fe(CN)6] утворює осади з усіма катіонами четвертої групи. Для якісного аналізу мають значення його сполуки з Ag+ та Cu2+.
З іонами Ag+ утворюється осад фероціаніду срібла білого кольору, а з іонами Cu2+ – осад фероціаніду міді червоно-бурого кольору:
4 AgNO3 + K4[Fe(CN)6] = Ag4[Fe(CN)6] + 4 KNO3;
2 CuSO4 + K4[Fe(CN)6] = Cu2[Fe(CN)6] + 2 K2SO4.
Фероціанід срібла не розчиняється в азотній кислоті і аміаку, але розчиняється в ціаніді калію.
Фероціанід міді легко розчиняється в аміаку з утворенням аміакату та розкладається лугом з виділенням гідроксиду блакитного кольору:
Cu2[Fe(CN)6] + 12 NH4OH = 2 [Cu(NH3)4](OH)2 + (NH4)4[Fe(CN)6] + 8 H2O;
Cu2[Fe(CN)6] + 4 KOH = 2 Cu(OH)2 + K4[Fe(CN)6].
7.11. Дія гексаціаноферату (ІІІ) калію.
K3[Fe(CN)6] взаємодіє з іонами Ag+, утворюючи осад фериціаніду срібла померанчевого кольору:
3 AgNO3 + K3[Fe(CN)6] = Ag3[Fe(CN)6] + 3 KNO3.
Осад не розчиняється в розведеній HNO3, але розчиняється в KCN та NH4OH з утворенням відповідних комплексних сполук.
Інші катіони четвертої групи утворюють з K3[Fe(CN)6] різного кольору осади, які, проте, не використовують в якісному аналізі для їх виявлення.
7.12. Дія роданіду амонію.
NH4SCN та KSCN з іонами Ag+ утворюють білий осад, який не розчиняється в розведеній HNO3, але розчиняється в надлишку реактиву з утворенням комплексного іона [Ag(SCN)3]2–:
AgSCN+ 2 KSCN = K2[Ag(SCN)3].
Іони Hg2+ з NH4SCN утворюють білий осад роданіду ртуті, який розчиняється в надлишку реактиву з утворенням комплексної сполуки – тетрароданомеркуріату амонію:
Hg(SCN)2 + 2 NH4SCN = (NH4)2[Hg(SCN)4].
Ця комплексна сполука використовується для виявлення іонів Zn2+, Co2+, Cu2+. З іонами Cu2+ тетрароданомеркуріат амонію утворює осад жовто-зеленого кольору. В присутності цинку осад Cu[Hg(SCN)4]• Zn[Hg(SCN)4] забарвлений в сіро-фіолетовий колір.
Co2+ утворює утворює синій осад, а в присутності цинку – блакитний.
При дії KSCN на іони Cu2+ випадає осад Cu(SCN)2 чорного кольору, який поступово перетворюється на білий осад CuSCN:
CuSO4 + 2 KSCN = Cu(SCN)2 + K2SO4;
2 Cu(SCN)2 = 2 CuSCN + (SCN)2.
Іони Bi3+ при дії надміру роданіду калію утворюють розчинну сполуку жовтого кольору K[Bi(SCN)4].
Іони Cd2+ роданідом не осаджуються.
7.13. Дія хромату та дихромату калію.
K2CrO4 з іонами Ag+ утворює осад Ag2CrO4 цегляно-червоного кольору, а дихромат - осад Ag2Cr2O7 темно-червоного кольору. Ці осади добре розчинні в азотній кислоті, аміаку, але погано розчинні в оцтовій кислоті.
З іонами Pb2+ і хромат, і дихромат калію, утворюють осад хромату свинцю жовтого кольору:
Pb(NO3)2 + K2CrO4 = PbCrO4 + 2 KNO3;
2 Pb(NO3)2 + K2Cr2O7 + H2O =2 PbCrO4 + 2 KNO3 + 2 HNO3.
Осад поганорозчинний в 2 н HNO3, але розчиняється в 3 н азотній кислоті; в лузі розчиняється з утворенням малодисоційованого плюмбіту лужного металу; в ацетаті амонію – з утворенням комплексної сполуки – ацетату свинцю.
Іони Hg22+ з хроматом утворюють червоний хромату ртуті (І):
Hg2(NO3)2 + K2CrO4 = Hg2CrO4 + 2 KNO3,
а іони Hg2+ – жовтий осад хромату ртуті (ІІ):
Hg(NO3)2 + K2CrO4 = HgСrO4 + 2 KNO3.
При дії на розчин Hg(NO3)2 розчином K2Cr2O7 утворюється осад HgCrO4. З розчину HgCl2 біхромат не осаджує ртуть, бо HgCl2 є дуже малодисоційованою сполукою і концентрація Hg2+ в розчині незначна.
Обидва осади Hg2CrO4 та HgCrO4 не розчиняються в розведеній HNO3.
Біхромат калію з Bi3+ в середовищі ацетатного буфера утворює жовтий осад біхромату вісмутилу (BiO)2Cr2O7.
2Bi(NO3)3 + K2Cr2O7 + 4NaAc + 2H2O = (BiO)2Cr2O7 + 4NaNO3 + 2KNO3 +
+4 HAc.
Це одна із характерних реакцій на Bi3+. Осад біхромату вісмутилу розчиняється в мінеральних кислотах і не розчиняється в лугах, чим відрізняється від хромату свинцю.