- •Передмова
- •1.1. Дія лугу.
- •1.3 Дія реактиву Несслера (суміш k2HgI4 з koh).
- •1.4. Дія гідратартрату натрію (NaHc4h4o6).
- •1.5. Дія гексанітрокобальтату (ііі) натрію.
- •1.6. Дія гексагідроксостибіату (V) калію.
- •1.7. Дія цинкуранілацетату (Zn(uo2)3(Ac)8 або ZnAc2∙3uo2Ac2, де Ac− − іони ch3coo− ).
- •1.8. Забарвлення полум’я.
- •2.1. Дія групового реагенту ((nh4)2co3).
- •1.2. Дія розчину аміаку.
- •Хід аналізу суміші катіонів першої та другої аналітичних груп
- •Розділ 3. Катіони третьої аналітичної групи
- •4.10.1. Виявлення хрому.
- •Хід аналізу суміші катіонів першої, другої та третої груп
- •Розділ 4. Четверта група катіонів
- •7.14. Дія сірчаної кислоти.
- •Додаток Мікрокристалоскопічні реакції на іони калію та натрію.
- •Натрій.
- •Краплинні реакції на деякі катіони третьої та четвертої аналітичних груп. Алюміній.
1.1. Дія лугу.
З катіонів першої групи лише NH4+ взаємодіють з розчином лугу. Реакція NH4+ з лугом при нагріванні супроводжується виділенням аміаку:
NH4Cl + NaOH = NH3 ↑ + NaCl + H2O.
Аміак можна виявити або за запахом, або з допомогою деяких реакцій (наприклад, змочений водою рожевий лакмусовий папірець синіє, а фільтрувальний папір, змочений Hg2(NO3)2, чорніє). Ця реакція є специфічною для NH4+ і дає змогу виявити його в присутності всіх катіонів.
1.3 Дія реактиву Несслера (суміш k2HgI4 з koh).
Реакція NH4+ з реактивом Несслера дуже чутлива і придатна для виявлення навіть надзвичайно малих концентрацій аміаку в розчині. Тому вона виконується краплинним способом на скляній плативці.
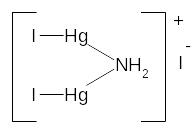
При додаванні реактиву Несслера до розчину солі амонію утворюється червоно-бурий осад йодиду дийодиддимеркурамонію:
NH4NO3 + 2K2[HgI4] +2KOH = |
|
+ 5KI + KNO3 + + 2H2O |
Виявленню NH4+ за цією реакцією не заважають катіони першої та другої аналітичних груп. Заважають катіони Fe3+, Cr3+, Co2+, Ni2+ і інші, що утворюють із лугом забарвлені нерозчинні гідроксиди. Щоб позбутись впливу перелічених вище іонів, до досліджуваного розчину спочатку додають 50%-ний розчин сегнетової солі KNaC4H4O6, а вже потім – реактив Несслера. Тартрат-іони маскують ці іони, зв’язуючи їх в стійкі розчинні комплексні сполуки. Виявленню іонів амонію заважають також іоні Bi3+, Hg2+, Sb(III), Sn(II) та інших металів, які утворюють забарвлені йодиди та (або) руйнують реагент.
1.4. Дія гідратартрату натрію (NaHc4h4o6).
Винна кислота (H2C4H4O6) є двохосновною кислотою і здатна утворювати середні (K2C4H4O6, Na2C4H4O6) та кислі (KHC4H4O6, NaHC4H4O6) солі. Серед солей винної кислоти першої аналітичної групи важкорозчинні лише KHC4H4O6, NH4HC4H4O6 та Mg(HC4H4O6)2. NaHC4H4O6 є реагентом на іони K+ за відсутності іонів NH4+ та Mg2+. Реакція відбувається при кімнатній температурі, оскільки розчинність осаду KHC4H4O6 при нагріванні значно зростає.
K+ + HC4H4O6− = KHC4H4O6.
Мінеральні кислоти та луги розчиняють осад KHC4H4O6 , при цьому відбуваються такі реакції:
KHC4H4O6 + HCl = H2C4H4O6 + KCl;
KHC4H4O6 + KOH = K2C4H4O6 + H2O.
В оцтовій кислоті осад KHC4H4O6 нерозчинний.
Виявленню калію розглянутим способом заважають, крім іонів NH4+ та Mg2+, катіони другої та інших аналітичних груп.
1.5. Дія гексанітрокобальтату (ііі) натрію.
Na3[Co(NO2)6] – це характерний реагент для K+. В нейтральному або оцтовокислому середовищі він утворює з солями калію жовтий осад K2Na[Co(NO2)6].
2 K+ + Na3[Co(NO2)6] = K2Na[Co(NO2)6] + 2 Na+
Реакцію виконують краплинним способом. Луги заважають виявленню калію, оскільки реагент розкладається з утворенням темно-бурого осаду Co(OH)3 згідно з реакцією:
[Co(NO2)3]3− + 3 OH− =Co(OH)3 + 6 NO2−.
Кислоти теж руйнують реагент:
[Co(NO2)3]3− + 6 H+ = Co3+ + 6 HNO2,
причому з часом темно-буре забарвлення розчину змінюється на рожеве:
[Co(NO2)3]3− + 5H+ = Co2+ + NO2 + 5 HNO2.
(або: Co3+ + NO2− = Co2+ + NO2 ).
Виявленню калію реакцією з гексанітрокобальтатом (ІІІ) натрію заважають іони NH4+, тому що осад, що вони утворюють з реагентом, подібний як за складом, так і за зовнішніми характеристиками. Перешкоджають виявленню калію іони IV та V аналітичних груп - Hg22+, Pb2+, Sn2+, Sb3+, AsO33−. Іони Hg2+, Bi3+, Sn(IV), та AsO43− з гексанітрокобальтатом (ІІІ) натрію також утворюють осади жовтого кольору, проте ці осади розчинні в оцтовій кислоті. Заважають також I− та інші відновники. Для виявлення K+ в присутності I− досліджуваний розчин випаровують з HNO3 , сухий залишок розчиняють у воді, додавши оцтової кислоти, і в одержаному розчині проводять реакцію виявлення K+ з Na3[Co(NO2)6].