- •2. Элементы специальной (частной) теории относительности
- •3. Механические колебания и волны в упругих средах
- •4. Основы молекулярной физики и термодинамики
- •5. Электростатика
- •6. Постоянный электрический ток
- •7. Электромагнетизм
- •8. Электромагнитные колебания и волны
- •9. Волновая оптика
- •10. Квантовая природа излучения
- •11. Элементы атомной физики и квантовой механики
- •12. Элементы квантовой статистики и физики твердого тела
- •13. Элементы физики атомного ядра и элементарных частиц
- •Методические указания к рабочей программе
- •Методические указания к выполнению контрольных работ
- •Решение
- •Задача 1.2
- •Решение
- •Задача 1.3
- •Решение
- •Задача 1.4
- •Решение
- •Задача 1.5
- •Решение
- •Задача 1.6
- •Решение
- •Задача 1.7
- •Решение
- •Задача 1.8
- •Решение
- •Задача 1.9
- •Решение
- •Задача 1.10
- •Решение
- •Задача 1.11
- •Решение
- •Задача 1.12
- •Решение
- •Задача 1.13
- •Решение
- •Задача 1.14
- •Решение
- •Задача 1.15
- •Решение
- •Задача 1.16
- •Решение
- •Задача 1.17
- •Решение
- •Задача 1.18
- •Решение
- •Задача 1.19
- •Решение
- •Контрольная работа №1
- •Решение
- •Задача 2.2
- •Решение
- •Задача 2.3
- •Решение
- •Задача 2.4
- •Решение
- •Задача 2.5
- •Решение
- •Задача 2.6
- •Решение
- •Задача 2.7
- •Решение
- •Задача 2.8
- •Решение
- •Задача 2.9
- •Решение
- •Задача 2.10
- •Решение
- •Задача 2.11
- •Решение
- •Контрольная работа №2
- •Задача 3.2
- •Решение
- •Задача 3.3
- •Решение
- •Задача 3.4
- •Решение
- •Задача 3.5
- •Решение
- •Задача 3.6
- •Решение
- •Задача 3.7
- •Решение
- •Задача 3.8
- •Решение
- •Задача 3.9
- •Решение
- •Задача 3.10
- •Решение
- •Задача 3.11
- •Решение
- •Контрольная работа №3
- •Волновые свойства частиц
- •Боровская теория водородоподобного атома
- •Атомное ядро. Радиоактивность
- •Теплоемкость кристалла
- •Элементы квантовой статистики
- •Дозы радиационного облучения
- •Полупроводники
- •Контрольная работа №4
- •Литература Основная
- •Дополнительная
- •Содержание
- •220013, Минск, проспект ф.Скорины, 65.
Решение
Пленка мыльного пузыря имеет две сферические поверхности – внешнюю и внутреннюю. Обе поверхности оказывают давление на воздух, заключенный внутри пузыря. Так как толщина пленки чрезвычайно мала, диаметры обеих поверхностей практически одинаковы. Поэтому добавочное давление
![]()
где R – радиус пузыря;
![]() – коэффициент
поверхностного натяжения мыльного
пузыря.
– коэффициент
поверхностного натяжения мыльного
пузыря.
Так
как r
=
d /
2, то
![]() Работа, которую нужно совершить, чтобы,
растягивая пленку, увеличить ее
поверхность на
Работа, которую нужно совершить, чтобы,
растягивая пленку, увеличить ее
поверхность на
![]() ,
выражается формулой
,
выражается формулой
![]() ,
,
где S – общая площадь двух сферических поверхностей пленки мыльного пузыря;
S0 – общая площадь двух поверхностей плоской пленки, затягивающей отверстие трубки до выдувания пузыря.
Пренебрегая S0, получаем
![]()
Задача 1.18
Как изменится энтропия 2 г водорода, занимающего объем 40 л при 270 К, если давление увеличить вдвое при постоянной температуре, и затем повысить температуру до 320 К?
Дано:
m = 2 г = 2 10-3 кг; V = 40 л; T1 = 270 K; T2 = 320 K; P2 = 2P1. |
|
|
S = ? |
|
|
Решение
Изменение энтропии определяется формулой
 (1.49)
(1.49)
где dQ – изменение количества теплоты;
Т – термодинамическая температура.
Изменение количества теплоты находим из первого закона термодинамики для идеального газа:
![]() ,
(1.50)
,
(1.50)
где m – масса газа;
– молярная масса;
![]() – молярная
изохорная теплоемкость;
– молярная
изохорная теплоемкость;
dT – изменение температуры газа;
P – давление газа;
dV – изменение объема;
PdV – работа расширения газа.
Величину P найдем из уравнения Менделеева – Клапейрона:
![]() (1.51)
(1.51)
Для двухатомных газов
![]() (1.52)
(1.52)
где R = 8,31 Дж/(мольK) – универсальная газовая постоянная.
Подставляя (1.51) и (1.52) в (1.50), находим
![]() (1.53)
(1.53)
Подставляя (1.53) в (1.49), получаем
 (1.54)
(1.54)
Для изотермического процесса
![]()
Тогда уравнение (1.54) примет вид
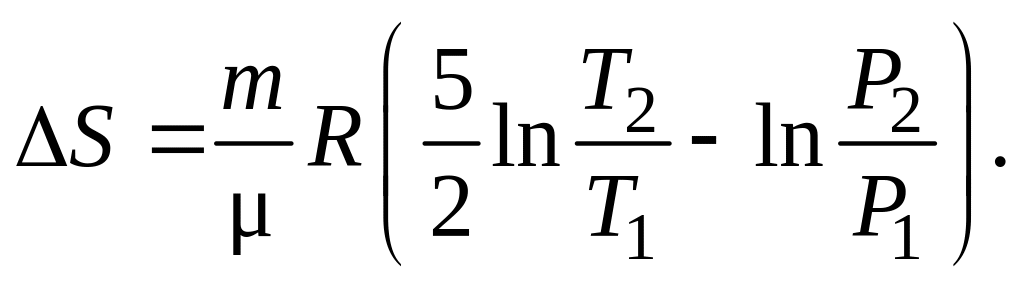 (1.55)
(1.55)
Производим вычисления:
![]()
Задача 1.19
Вычислить эффективный диаметр молекул азота, если его критическая температура 126 К, критическое давление 3,4 МПа.
Дано:
Ткр = 126 K; Pкр = 3,4 МПа = 3,14 106 Па. |
|
|
d = ? |
|
|
Решение
Азот, согласно условию задачи, должен подчиняться уравнению Ван-дер-Ваальса:
![]() (1.56)
(1.56)
Постоянную
b
в уравнении Ван-дер-Ваальса с достаточной
степенью точности считают равной
учетверенному собственному объему 1
моля газа. В 1 моле газа находится
6,021023
молекул (![]() ),
следовательно, объем одной молекулы
равен
),
следовательно, объем одной молекулы
равен
![]() (1.57)
(1.57)
откуда
![]() .
.
Постоянная b = ТкрR / (8Pкр), тогда