
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
ММО – метод разработан Леонардо Джонсоном, Хундом (1927 – 29 гг)
Основная идея ММО из атомных орбиталей отражается молекулярная орбиталь, электрон с атомных орбиталей переходит на молекулярные. Основная идея связана с нахождением в основной функции описывающей состояние электронов на молекулярной орбитали.
общ = С1а С2в
c1=c2
c1=-c2
A, B - атомы
Симметрично, если
s = C2А + C1В
Молекулярная орбиталь (МО) связывающая
as = C2B – C1a МО разрыхляющаяся

М О
- это линейные комбинации атомных
орбиталей.
О
- это линейные комбинации атомных
орбиталей.

H + H H H

аs =c1(a-B) - симметричная
s =c1(a-B) – антисимметричная
АО s, p, d, f
МО

Заселение МО происходит по тем же принципам, как и атом; 1. принцип наименьшей энергии; 2. правило Хунда;3. принцип Паули.
Н2
Н 1S1 + Н 1S1 = H2 [ ( связи 1S)2]
Порядок связи – сумма всех связывающих электронов минус сумма разрыхляющих е деленных пополам.

Н 1S1 + Н 1S0 = H2+ [ ( связи 1S)1]
Порядок связи = 1\2 = 0.5
Н2 Е связи = 436 кДж \ моль
Н – Н l связи = 0.074 нм
Порядок связи = 1
Н2+ Е связи = 277 кДж \ моль
Н – Н l связи = 0.106 нм
Порядок связи = 0.5
Электрон на разрыхляющей аннулирует действие электрона связывающей
I I
период
I
период

1S

2
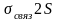


2px


2
2py

2pz



Для 1 и 2 периодов порядок заполнения энергетических уровней в зависимости от энергии подуровня следующей:

Основные положения ММО.
МО получают линейными комбинациями атомных орбиталей.
МО – связывающие более низка Е
МО – разрыхляющие более высока.
Единичная химическая связь может образовываться даже одним е, если он переходит с АО на связывающее МО.
ММО не исключает МВС, а дополняет его.
Общность этих методов только для двухцентровых систем, т.к. МВС не может рассмотреть многоцентровую систему.
Достоинства метода валентной связи.
Это простой наглядный метод, он позволяет предсказать такие свойства многих молекул: пространственную конфигурацию молекул, полярность молекул, энергию и длину связи и другие свойства, но МВС объяснить не может.
Также есть недостатки:
1.Учитывает только валентные электроны.
2. МВС не может объяснять одноэлектронную химическую связь.
3. МВС не может объяснять наличие и существование радикалов
4. Не объясняет парамагнетизм кислорода.
Поскольку кислород обладает парамагнитными свойствами, то у него должны быть неспаренные электроны.
№11/2
14. Термодинамические функции:
внутренняя энергия, энтальпия, энтропия, энергия Гиббса. Законы термодинамики. Закон Лавуазье-Лапласа. Закон Гесса.
Внутренняя энергия U вещества (или системы) – это полная энергия частиц, составляющих данное вещество. Она слагается из кинетической и потенциальной энергий частиц. Кинетическая – это энергия поступательного, колебательного и вращательного движения частиц; потенциальная обусловлена силами притяжения и отталкивания, действующими между частицами.
В нутренняя
энергия зависит от состояния вещества.
Изменение внутренней энергии системы
можно определять: U = Q
– A – закон сохранения
энергии. Если в ходе выполнения процесса
не производится никакой работы, в том
числе работы расширения против внешнего
давления, т.е. если объем системы не
изменяется, то U=Qv
, где Qv
- теплота, поглощенная системой
в условиях постоянного объема.
нутренняя
энергия зависит от состояния вещества.
Изменение внутренней энергии системы
можно определять: U = Q
– A – закон сохранения
энергии. Если в ходе выполнения процесса
не производится никакой работы, в том
числе работы расширения против внешнего
давления, т.е. если объем системы не
изменяется, то U=Qv
, где Qv
- теплота, поглощенная системой
в условиях постоянного объема.
В случае нагревания вещества при постоянном объеме изм. внутренней энергии определяется по теплоемкости этого вещества: U =Qv =nCv T
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
Энтальпия. Чаще приходится иметь дело с процессами, при постоянном давлении. При этом пользуются величиной энтальпии Н, определяемой соотношением: H=U+PV
П ри постоянном давлении и при условии, что в ходе процесса совершается только работа расширения (А= P V) H= U+P V . при указанных условиях Н= Qр , : Н =Qр =nCр T.
В случае химической реакции изменение энтальпии равно взятому с обратным знаком тепловому эффекту реакции, проведенной при постоянной температуре и постоянном давлении. Энтальпия, как и внутренняя энергия, характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления, т.е. работу расширения. Энтельпия определяется состоянием системы и независит от того, каким путем оно достигнуто.
Энтропия (S) связана с числом W равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнением: S=klgW, к- коэффициент пропорциональности.
Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле. С повышением температуры энтропия возрастает, т.к. возрастает интенсивность движения частиц, растет число способов их расположения. Изменяется энтропия при протекании химических процессов. Увеличение числа газовых молекул приводит к возрастанию энтропии, уменьшение – ее понижению.
Подобно внутренней энергии и энтальпии, энтропия зависит только от состояния системы. Но, в отличие от этих двух функций, связь изменения энтропии с теплотой зависит от способа проведения процесса – от его скорости.
Если процесс проводится обратимо и при постоянной температуре, то изменение энтропии связано с поглощаемой теплотой уравнением:
S=Qобр/Т, Qобр- кол-во теплоты, поглощенной системой в изотермическом обратимом процессе; Т – абсолютная температура. С помощью этой формулы можно определить изменение энтропии при плавлении и кипении веществ. При поглощении некоторого кол-ва теплоты энтропия системы возрастает тем сильнее, чем ниже температура, при которой поглощается теплота. Энтропия имеет размерность энергии, деленной на температуру: выражают в Дж/К.
Энергия Гиббса G, называемая также изобарно-изотемическим потенциалом, изобарным потенциалом или свободной энергией при постоянном давлении.
Энергия Гиббса связана с энтальпией, энтропией и температурой соотношением: G = H – TS, если реакция осуществляется при постоянных давлении и температуре, то изменение энергии Гиббса при реакции равно:
G = H – T S. При обратимом и изотермическом проведении процесса G равно по абсолютной величине, но обратно по знаку максимальной полезной работе, которую система производит в данном процессе. Полезной работой называется вся производимая в ходе процесса работа за вычетом работы расширения P V.
В условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса. Самопроизвольно могут протекать только те реакции, за счет энергии которых можно совершать полезную работу.
Закон Гесса: стандартное изменение энтальпии реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ. Аналогично стандартное изменение энергии Гиббса реакции равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ. При этом все суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Вопрос № 14.
