
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
Принцип Паули (1925)
В атоме не может быть 2-х электронов, имеющих одинаковые 4 квантовые числа или одноатомную орбиталь могут занимать 2 электрона, если спины антипараллельны.
Емкость n / уровней

Емкость n/уровней

l =0 s 2(2 +1)
l =1
p 6
=1
p 6
l=2 d 10
l =3
f 14
=3
f 14
Электронное строение атомов выражается в виде электронных формуле
n= 1

1H 1S1 2He 1 S2
S-элементы
n= 2


3 Li
1S2
2S1
2p0 S
– элементы
Li
1S2
2S1
2p0 S
– элементы
4Be 1S2 2S2 2p0
5 B 1S2 2S2 2p1 p – элементы
6С 1S2 2S2 2p2
Графические изображение электронных структур. Правила Хунда
Пустующему состоянию атома соответствует такое распределение электронов в пределах подуровня при котором суммарный спин будет максимальный. Если в одной 2 электрона, то суммарный спин = 0
7N 1S2 2S2 2P3

8O 1S2 2S2 2p4

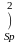

3 период – аналог второго
11Na 1S2 2S2 2 p6 3S1
12 Mg……….3 S2
13 M 1S2 2S2 2P6 3S2 3p4
18 Ar 1S2 2S2 p6 3S2 3p6
n=4

19K 1S2 2S2 2p6 3S2 3p6 3d 4s
Заполнение уровней и подуровней происходит по принципу наименьшей энергии.
По правилу Кличковского
L=2 3d n+l = 3+2=5
L=0 4S n+l=4+0=4
Первая правило Кличковского: заполнение уровня и подуровня происходит по меньшей сумме n+l
20Sс 1S2 2S2 3S2 3p6 3d 4S2 4p
l=2 3d n+l = 3+2=5
l=1 4s n+l=4+1=5
№7/2
При одинаковых суммах n+b заполняется уровень и подуровень с меньшим n.
Sc- первый d-элемент
25Mn 1S2 2S2 2p6 3S2 3p6 3d5 4S2 4p
30 Zn 1S2 2S2 2p6 3S2 3p6 3d10 4S2 4p 0
31 Ga …………………….. 3d10 4S2 4p 1
36 Kr 1S2 2S2 2p6 3S2 3p6 3d10 4S2 4p 6
Пятый период аналог четвертого 2-S, 10-d, 6- p элементов
Заполнение уровней и подуровней по возрастанию энергии.

1 s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<5d1<4f1-14<5d2-10<6p<7s<5f1-14<6d2-10<7p
1. S – элементы находятся 1,2 группа главная подгруппа.
2. P- элементы находятся 3-8 группы – главная подгруппа
3. d – элементы. Находятся 1-8 группы, побочные подгруппы
4. f – элементы лантаноиды и актиноиды.
5
4d10 0Sn
0Sn
1s2 2s22p6 3s23p63d104s24p65s24d105p2

5s2 5p2
S* 5s1 5p3
Иногда в распределении электронов наблюдаются отсутствие это провал или проскок электронов, с последнего энергетического уровня электроны проваливаются на нижележащих уровень.
Проскок или провал электров связан с повышенной энергетической устойчивостью электронных структур при полностью занятом энергетическом подуровне.
A g,
Au, Cu, Mo, Cr, Th, Nb, Pd.
g,
Au, Cu, Mo, Cr, Th, Nb, Pd.
29 Cu 1S2 2S2 2p6 3S2 3p6 3d9 4S2
c «проскок»
29Cu 1S2 2S2 2p6 3S2 3p6 3d10 4S1
Современная формулировка периодического закона:
Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов, а также от повторения электронных структур атома.
№7/3
Вопрос № 8.
Типы химической связи. Ковалентная
связь и ее природа. Характеристики
ковалентной связи (энергия длина связи).
Дополнительные особенности: кратность,
насыщаемость, направленность, сопряжение,
полярность и поляризуемость.
 -
и
-
и
 - связи. Привести примеры.
- связи. Привести примеры.
Ковалентная связь образуется за счет одной или нескольких электронных пар с антипараллельными спинами.
Теория разработанная на основе квантово - механического расчета ковалентной связи для более сложных молекул получено название МВС и ММО.
Валентность – в 1853 г. разработал Франк-Лондон, за единицу взял валентность водорода
Валентность предложил 1893 г . Франкланд за единицу валентности взял валентность водорода
 B(H)=1
B(H)=1

По Гейзенбергу и Лондону валентность определяется числом неспаренных электронов.
13Al 1s2 2s2 2p63s23p1



3
3s2 3p1
Ч
 исло
неспаренных электронов увеличивается
путем распаривания электрона в пределах
s подуровня на подуровень
в пределах уровня.
исло
неспаренных электронов увеличивается
путем распаривания электрона в пределах
s подуровня на подуровень
в пределах уровня.
A l*
l*
3s1 3p2
Al Cl3
 Cl B=3
Cl B=3
A
 l
l
Cl
Cl
6C 1s2 2s2 2p2 C=0
 B=2
B=2


C*
2s1 2p3
CO2 O=C=O
7N1s2 2s2 2p3 B=3
P, As, Cl, Br, S
16S 1s2 2s2 2p63s23p43d0


3s2 3p4 3d0
B=2
H-S-H H2S O=S=O SO2
S* 1s2 2s2 2p63s23p33d1

3s2 3p3 3d1
S *… …………..3s13p33d2
B=6
