
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
17. Энергия Гиббса образования вещества.
Энергия Гиббса G, называемая также изобарно-изотемическим потенциалом, изобарным потенциалом или свободной энергией при постоянном давлении.
Энергия Гиббса связана с энтальпией, энтропией и температурой соотношением: G = H – TS, если реакция осуществляется при постоянных давлении и температуре, то изменение энергии Гиббса при реакции равно:
G = H – T S. При обратимом и изотермическом проведении процесса G равно по абсолютной величине, но обратно по знаку максимальной полезной работе, которую система производит в данном процессе. Полезной работой называется вся производимая в ходе процесса работа за вычетом работы расширения P V.
В условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса. Самопроизвольно могут протекать только те реакции, за счет энергии которых можно совершать полезную работу.
Величиной, указывающей на направление реакций, является энергияГиббса (G°298)
G х.р. G
G х.р.
Из формулы расчета G х.р. видно, что величина G х.р. будет зависеть от того, какой из факторов преобладает: при низких температурах преобладает энтальпийный фактор, а при высоких - энтропийный.
Можно рассчитать G х.р. и по табличным значениям энергии Гиббса (с учетом стехиометрических коэффициентов в реакции).
G х.р. = G0прод реакции - G0исход. вещество
По знаку ДО можно судить о направленности реакции:
1. G<0-реакция идет в прямом направление
2. G>0- прямая реакция не идет, осуществляемой оказывается обратная реакция, для которой G<0.
3.
G=0 – устанавливается
химическое равновесие т.к. исход их
формулы (1) в этих условиях. Т
равн. =
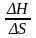
4. Для окислительно-восстановительных реакции - G =nF*Eэ,Где n – число е, F – число Фарадея (96500 кл), Е- ЭДС.
18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
Все реакции можно разделить на две группу: обратимые и не обратимые. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью.
Химические реакции, которые идут в одном направлении, называются
необратимыми. При этом взятые вещества целиком превращаются в продукты реакции
Химические реакции, которые при одних и тех же условиях могут проходить как в прямом так и в обратном направлении - называются обратимыми реакциями. Эти реакции никогда не доходят до конца.
Вначале, при смешивании исходных, веществ, скорость прямой реакции велика, а обратной равна нулю. По мере появления продуктов реакции начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие.
Химическое равновесие называют динамическим равновесием. Этим подчеркивается, что при равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не заметно.
Количественной характеристикой химического равновесия служит величена, называемая константой химического равновесия. Рассмотрим на примере синтеза иодоводорода: H2 + I2 = 2HI, v1=k1[H2][I2], v2=k2[HI]2
При равновесии скорости прямой и обратной реакций равны друг другу: k1[H2][I2] =k2[HI]2 или k1/k2=[HI]2/[H2][I2].
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К). при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии. Величена константы равновесия зависит от природы реагирующих веществ и от температуры. От присутствия катализаторов она не зависит.
В случае гетерогенных реакций в выражение константы равновесия, так же как и выражение закона действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Для СО2 + С =2СО, константа равновесия имеет вид: К= [CO]2/[CO2].
Если система находится в равновесии, то она будет пребывать в нем, пока внешние условия сохраняются постоянными.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции. Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения, то говорят, что равновесие смещается вправо, в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево. При увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо вещества равновесие смещается в сторону образования этого вещества.
Нарушение равновесия вследствие изменения давления. когда в реакции участвуют газы, равновесие может нарушаться при изменении объема системы. При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления; при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
Нарушение равновесия вследствие изменения температуры. При повышении температуры равновесие смещается в направлении эндотермической реакции, а при понижении – в направлении экзотермической реакции.
Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказать внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
