
- •Вопрос № 2
- •Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- •Вопрос № 4.
- •Вопрос № 5. Радиоактивный распад, его типы. Закон смещения. Радиоактивность. Виды радиоактивных лучей, их характеристика.
- •Принцип Паули (1925)
- •Емкость n/уровней
- •Способы образования ковалентной связи.
- •Свойства связи.
- •Причины образования химической связи. Основы виды химической связи (ковалентная, ионная, металлическая)
- •Вопрос № 9. Ионная связь и металлическая связь. Ионная связь, ее свойства
- •Свойства связи.
- •Вопрос № 10. Метод валентных связей. Валентность по донорно-акцепторному и обменному механизму.
- •Способы образования ковалентной связи.
- •Донорно-акцепторная связь – разновидность ковалентной связи.
- •Вопрос № 11. Метод молекулярных орбиталей. Его сравнение с методом валентных связей.
- •14. Термодинамические функции:
- •16. Энтропия образования химических соединений.
- •17. Энергия Гиббса образования вещества.
- •18. Обратимые химические реакции. Химическое равновесие. Условия термодинамического равновесия.
- •19. Скорость химических реакций в гомогенных и гетерогенных процессах. Факторы, изменяющие скорость химических реакций.
- •21. Влияние температуры на скорость реакций.
- •Топливный элемент. Принцип работы кислородно-водородного топливного элемента.
- •Основные методы защиты от коррозии. Протекторы, ингибиторы коррозии.
- •Методы получения полимеров. Привести примеры реакций полимеризации и поликонденсации.
Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
В 1913г. Нильс Бор предложил теорию строения атома водорода, в которой связал планетарную модель атома с квантовой теорией излучения Планка и учения Эйнштейна о световых квантах. Бор показал, что если квантуется вся энергия, то энергия электрона тоже должна квантоваться.
В 1900 Планк доказал, что чистая энергия излучается квантом, энергия одного кванта рассчитывается по простой формуле.
E=h![]() ,
где h-постоянная Планка,
v-частота квантовой
колебаний: h=6,626 10-34
Дж*Сек.
,
где h-постоянная Планка,
v-частота квантовой
колебаний: h=6,626 10-34
Дж*Сек.
С= *
Е=
*
Е= =
=
Фотон обладает массой
E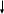 =mc2
mc2=
=
=mc2
mc2=
=


фотон
Волновые -
= - корпускулярные
- корпускулярные
Уравнение показывает корпускулярные – волновые свойства фотона
В своих постулатах Бор учитывал, что энергия электрона в атоме изменяется скачкообразно – дискретно.
Постулаты:
1. Электрон вращается вокруг ядра не по любым орбитам, а по стационарным, радиусы которых относятся к квадрату целых чисел.
2. Двигаясь по стационарной орбите электрон энергию не излучает и не поглощает, он находится в основном состоянии r1=0,053 Hм.
3. Излучение или помещение энергии происходит, при переходе электрона с одной орбиты на другую.
∆Е=Ен-Ек ∆Е=h
=
=

После постулатов Бора появился новый раздел в физике, изучающий свойства и поведения частиц микромира (с малой массой) это так называемая квантовая или волновая механика.
Дополнение к постулатом Бора Зоммерфельд предложении эллипсовидные орбитами
Квантовая механика основывается на представлениях о квантовании энергии, волновом характере движения микрочастиц вероятностном методе описания микрообъектов.
Основное уравнение квантовой механики - двойственная природа фотонов
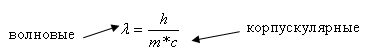
В 1924 г. Луи де Бройль применил это уравнение для описания поведения электрона.
Заменив скорость света на скорость движения электрона, таким образом было доказано, что электрон обладит корпускулярно-волновыми свойствами

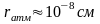
Задача 1
Частица m=1гр, v=5м/сек,
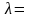 1,3*10-31
м=1,3*10-29см
1,3*10-31
м=1,3*10-29см
В 1927 году Девиссон и Джермер (США) Томсон (Англия), Тарковский (Россия) обнаружили независимо друг от друга дифракцию и интерференцию у электронов.
Электрон обладает дуализмом – это одновременно и частица и волна. Учесть двойственную природу электрона позволяет принцип неопределенности Гейзенберга невозможно одновременно определимо точно и скорость движения электрона и его координаты.
 ,
v – скорость движения , q
– координаты
,
v – скорость движения , q
– координаты
В связи с этим в квантовой механике
состояние микрочастицы описывается не
ее координатой и скоростью, а каждого
функций
 (пси) (волновая функция).
(пси) (волновая функция).
Квантовая механика отказывается от уточнения положения электрона в пространстве е и заменяет это понятие вероятностью пребывания электрона в данной точке около ядерного пространства.
= (x,y,z)
В качестве модели состояния электронов в атоме в квантовой механике принято представление об электронном облаке.
Плотность соответствующих участков которого пропорциональна вероятности нахождение там электрона.
П ространство
вокруг ядра в котором наиболее вероятно
пребывание электрона называется
орбиталь.
ространство
вокруг ядра в котором наиболее вероятно
пребывание электрона называется
орбиталь.
Исходя из представления о наличии у электрона волновых свойств. Шредингер в 1925 г. предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил новое уравнение, связывающее энергию электрона с пространственными координатами в этом уравнении амплитуде трехмерного волнового процесса.
Особенно важное значение для характеристики
состояния электрона имеет волновая
функция
.
Подобно амплитуде любого волнового
процесса, она может принимать как
положительные, так и отрицательные
значения. Однако величина
 в
данной области пространства, тем выше
вероятность, того, что электрон
проявит здесь своё действие, т. е. что
его существование будет обнаружено в
каком-либо физическом процессе.
в
данной области пространства, тем выше
вероятность, того, что электрон
проявит здесь своё действие, т. е. что
его существование будет обнаружено в
каком-либо физическом процессе.
Более точным будет следующее утверждение:
вероятность обнаружения электрона в
некотором малом объеме
 выражается произведением
выражается произведением
 .Таким
образом сама величина
выражает плотность вероятности нахождения
электрона в соответствующей области
пространства.
.Таким
образом сама величина
выражает плотность вероятности нахождения
электрона в соответствующей области
пространства.
Для электрона, находящегося под действием сил притяжения к ядру, уравнение Шледингера имеет решение не при любых, а только при определенных значениях энергии. Таким образом, квантованность энергетических состояний электрона в атоме оказывается следствие5м присущих электрону волновых свойств и не требует введения особых постулатов.
