
- •1. Кинематика материальной точки. Система отсчета. Траектория, перемещение, скорость, ускорение. Равномерное и равнопеременное прямолинейное движение.
- •2. Криволинейное движение. Нормальное и тангенсальное ускорения.
- •3. Движение точки по окружности. Угловые перемещение, ускорение, скорость. Связь между линейными и угловыми характеристиками.
- •4. Динамика материальной точки. Инерциальные системы отсчета и первый закон Ньютона.
- •5. Фундаментальные взаимодействия. Силы различной природы(упругие, гравитационные, трения). Второй закон Ньютона. Масса. Третий закон Ньютона.
- •6. Импульс системы материальных точек. Уравнение движения центра масс. Закон сохранения импульса.
- •7. Уравнение движения тела переменной массы ( уравнение Мещерского).
- •8. Момент импульса и момент силы. Уравнение моментов. Закон сохранения момента импульса. Гироскопические явления.
- •9. Вращение твердого тела вокруг неподвижной оси. Основной закон динамики вращательного движения абсолютно твердого тела. Момент инерции.
- •10. Расчет момента инерции тел простой формы. Теорема Штейнера.
- •11. Кинетическая энергия материальной точки и абсолютно твердого тела.
- •12. Работа переменной силы, мощность. Потенциальные и непотенциальные поля. Консервативные и диссипативные силы. Потенциальная энергия.
- •13. Закон всемирного тяготения. Поле тяготения, его напряженность и потенциальная энергия гравитационного взаимодействия.
- •14. Работа по перемещения тела в поле тяготения. Космические скорости.
- •15. Соударения тел. Упругое и неупругое взаимодействия.
- •16. Колебательное движение и его характеристики: смещение, амплитуда, фаза, циклическая частота, период, скорость, ускорение.
- •17. Векторные диаграммы для представления гармонических колебаний. Дифференциальное уравнение гармонических колебаний. Энергия колебательного движения.
- •18. Пружинный и физический маятники.
- •19. Сложение параллельных колебаний одинаковой и разной частоты. Биения. Сложения колебаний одинаковой частоты
- •Сложение колебаний разной частоты
- •20. Сложение взаимно перпендикулярных колебаний. Фигуры Лиссажу.
- •21. Свободные затухающие колебания. Характеристики затухания: коэффициент затухания, время релаксации, декремент затухания, добротность колебательной системы.
- •22 Вынужденные колебания. Резонанс.
- •24. Термодинамическая система параметры состояния термодинамической системы. Основные положения молекулярно-кинетической теории газов.
- •25. Закон равномерного распределения энергии по степеням свободы молекул. Основное уравнение молекулярно-кинетической теории газов.
- •26. Закон Максвелла распределения молекул по скоростям теплового движения. Барометрическая формула. Распределение Больцмана.
- •27. Среднее число столкновений и средняя длина свободного движения молекул.
- •28. Первый закон термодинамики. Работа, теплота, теплоемкость, ее виды.
- •29. Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный.
- •30. Второй закон термодинамики. Энтропия. Тепловые двигатели и холодильные машины. Цикл Карно.
29. Политропный процесс, его частные случаи: изобарный, изотермический, адиабатный, изохорный.
Процесс, в ко тором теплоемкость остается постоянной, называется политропным.
Исходя из первого начала термодина мики при условии постоянства теплоемко сти (C = const) можно вывести уравнение политропы:
pVn = const, (55.9) где n=(C-Ср)/(С-Cv) — показатель политропы. Очевидно, что при С = 0, n= из (55.9) получается уравнение адиабаты; при С=, n =1 —уравнение изотермы; при С=СР, n = 0 — уравнение изобары, при С = Сv, n=± —уравнение изохоры.
Среди равновесных процессов, происходя щих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
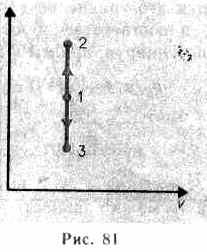
Изохорный процесс (V = const). Диаг рамма этого процесса (изохора) в коорди натах р, V изображается прямой, парал лельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.
A=pdV = 0.
Как уже указывалось в § 53, из первого начала термодинамики (Q=dU+A) для изохорного процесса следует, что вся теп лота, сообщаемая газу, идет на увеличе ние его внутренней энергии:
Q =dU
Согласно формуле (53.4), dUm = CvdT.
Тогда для произвольной массы газа по лучим
![]()
Изобарный процесс (р=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, парал лельной оси V

. При изобарном процессе работа газа при расширении объема от V1 до V2 равна
![]()
и определяется площадью прямоугольни ка, выполненного в цвете на рис. 82. Если использовать уравнение Клапейро на — Менделеева для выбранных нами двух состояний, то
![]()
откуда
![]()
Тогда выражение (54.2) для работы изо барного расширения примет вид
![]()
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2-T1=1К, то для 1 моля газа R=А, т. е. R численно равна работе изо барного расширения 1 моля идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой от количества теплоты
![]()
его внутренняя энергия возрастает на ве личину (согласно формуле (53.4))
![]()
При этом газ совершит работу, определяе мую выражением (54.3).
Изотермический процесс (T=const). Изотермиче ский процесс описывается законом Бой ля — Мариотта:
pV=const.
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше темпе ратура, при которой происходил процесс. Найдем работу изотермического расшире ния газа:
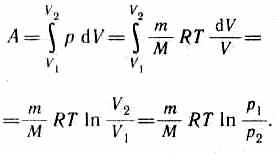
Так как при T=const внутренняя энергия идеального газа не изменяется:
![]()
то из первого начала термодинамики (Q =dU+A) следует, что для изотермиче ского процесса
Q=A,
т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им рабо ты против внешних сил:
![]()
Следовательно, для того чтобы при рабо те расширения температура не уменьша лась, к газу в течение изотермического процесса необходимо подводить количест во теплоты, эквивалентное внешней работе расширения.
Адиабатический процесс. Политропный процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен (Q=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распро странения звуковой волны настолько вели ка, что обмен энергией между волной и средой произойти не успевает. Адиаба тические процессы применяются в двига телях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (Q=dU+A) для адиабатического про цесса следует, что
A=-dU, (55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Для произвольной массы газа перепишем уравнение (55.1) в виде
![]()
Продифференцировав уравнение состоя ния для идеального газа pV=(m/M)RT, получим
![]()
Исключим из (55.2) и (55.3) температу ру Т:
![]()
Разделив переменные и учитывая, что Ср/Сv = найдем
dp/p=-dV/V.
Интегрируя это уравнение в пределах от р1 до р2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению
p2/pl=(V1/V2).
или
p1v1 = p2v2.
Так как состояния 1 и 2 выбраны про извольно, то можно записать
рV=const. (55.4)
Полученное выражение есть уравнение адиабатического процесса, называемое также уравнением Пуассона.
