
- •Введение
- •Предмет медицинской химии
- •Современный способ разработки лекарственных препаратов
- •Требования к молекулам-кандидатам в лекарства, концепция lead-like, правило Липински.
- •Перспективность использования гетероциклов в качестве лекарственных препаратов
- •Лекция про виагру
- •Физико-химические методы анализа.
- •Хроматография. Сущность метода. Области применения. Применение хроматографии в медицинской химии. Тсх – быстрота, простота и информативность
- •Синтез сульфопроизводных на основе
- •Синтез и функционализация производных изоксазола
- •2.1.2 Сульфамидные производные 3-метил-5-аминовинил замещенных изоксазолов
- •2.1.4 Сульфамидные производные 3-метил-4-нитро-5-винилизоксазолов
- •2.2 Синтез двуядерных соединений, содержащих изоксазольный цикл, их функционализация и превращения
2.2 Синтез двуядерных соединений, содержащих изоксазольный цикл, их функционализация и превращения
Замещенные 5-арил- и 5-гетерилизоксазолы
В нашей работе мы использовали реакцию циклоприсоединения гидроксиламина к 1,3-дикетонам, полученным конденсацией Кляйзена, что позволяет синтезировать двуядерные соединения, содержащие изоксазольный цикл (5-арил- и 5-гетерилизоксазолы).
Для синтеза 1,3-дикетонов мы использовали реакцию этилацетата 16 с рядом ацетилпроизводных бензола, тиофена и фурана 15а-з. Конденсацию проводили под действием гидрида натрия в гексане (в случае жидких исходных реагентов) или в смеси гексана и диоксана (в случае если исходное ацетилпроизводное является кристаллическим веществом), в присутствии небольшого количества этанола для инициирования реакции (схема 58). Использование этанола не влияет на выход продуктов конденсации, но в отсутствии этанола для проведения реакции требуется значительно больше времени. В результате реакции были получены натриевые производные 1,3-дикетонов 17а-з, которые использовались двумя путями.
При действии на соединения 17 уксусной кислоты были получены соответствующие 1,3-дикетоны, которые представляют собой смесь енольной 18 и кетонной 19 формы. Их строение было изучено 1Н ЯМР-спектроскопией. На 1Н ЯМР-спектрах соединений 18/19 в области 4.00-4.10 м.д. характерно наличие сигнала в виде синглета, соответствующего двум протонам при С-2 атоме углерода кетонной формы 19. Для енольной формы 18 характерно присутствие на спектрах двух сигналов: в области 6.00-6.25 м.д. находится сигнал в виде синглета, относящийся к протону при С-2 атоме углерода и в области 14.5 м.д. находится сигнал в виде уширенного синглета, относящийся к протону гидроксильной группы. Соотношение площадей сигналов, соответствующих протонам при С-2 атоме углерода соединений 18 и 19 позволяет точно определить молярное соотношение кетонной и енольных форм в смеси. По данным 1Н ЯМР-спектров соединений 18/19, снятых в дейтерированном ДМСО, в смеси значительно преобладает енольная форма 18. Общий выход соединений 18/19 в расчете на исходный кетон составлял более 50 %, за исключением производного фурана 18/19з. При взаимодействии 2-ацетилфурана 15з с этилацетатом продукт конденсации 18/19з был получен с выходом 6 %, при этом происходит сильное осмоление реакционной смеси.
При кипячении соединений 17 с иодметаном в диоксане в течение 6 ч были получены 2-метил-1,3-дикетоны 20а-в. В результате эффекта переноса реакционного центра метилирование происходит только в положение 2-. На 1Н ЯМР-спектрах соединений 20 характерны сигналы протонов метильной группы при С-2 атоме углерода в области 1.20-1.30 м.д. в виде дуплета с КССВ 6.2 Гц и протона при С-2 атоме углерода в области 4.50-4.60 м.д. в виде квартета с КССВ 6.2 Гц. По данным 1Н ЯМР-спектроскопии соединения 20 существуют исключительно в кетонной форме, присутствие сигналов, соответствующих их енольной форме, в дейтерированном ДМСО не наблюдалось.
При кипячении полученных 1,3-дикетонов 18/19 и 20 в этаноле с солянокислым гидроксиламином в присутствии пиридина были синтезированы соответствующие арил и гетерилизоксазолы 21а-л.

В литературном обзоре (стр. 8-9) нами отмечено, что реакция циклоконденсации гидроксиламина с не симметричными диэлектрофильными субстратами в зависимости от условий реакции может приводить к региоселективному образованию 5- или 3- замещенных изоксазолов или к образованию смеси изомеров. В используемых нами условиях реакции, которые подробно описаны в экспериментальной части, по данным 1Н ЯМР-спектроскопии и ЖХ-МС региоселективно образуется один изомер. Для определения положения заместителей в изоксазольном цикле были изучен распад соединений 21в,з под действием электронного удара. Построенная нами по данным масс-спектроскопии схема фрагментации в соответствии с известными литературными данными [5, 71] указывает на то, что соединения 21 имеют строение 5-арил и 5-гетерилизоксазолов (схема 59).

Для увеличения выхода 5-фуранилизоксазолов, вместо конденсации 15з с этилацетатом по схеме 57, мы осуществили альтернативную конденсацию этилового эфира фуран-2-карбоновой кислоты 22 с ацетоном 23 (схема 60). При этом были синтезированы дикетоны 18/19з и 20г с выходами 70 % и 65 % соответственно. Синтез по схеме 59 протекал без осмоления реакционной смеси, характерного для получения этих продуктов по схеме 57. При взаимодействии их с солянокислым гидроксиламином и пиридином были получены 5-фуранил-2-ил-3-метилизоксазол 21з и 5-фуран-2-ил-3,4-диметилизоксазол 21м с выходом 95 %.

При взаимодействии ацетилпроизводных бензола, тиофена и пиридина 15в,ж,и-л с диэтилоксалатом были получены соответствующие натриевые производные дикетонов 25а-д, которые легко преобразовывались in situ до карбонильных соединений 26а,б под действием уксусной кислоты (схема 61). При кипячении полученного in situ 25а,б с солянокислым гидроксиламином и пиридином в этаноле в течение 3 ч были получены соответственно 5-арил и 5-тиенилпроизводные изоксазола 27а,б. При кипячении производных пиридина 25в-д с солянокислым гидроксиламином и пиридином в этаноле были получены соединения, которые, по данным 1Н ЯМР-спектроскопии и ЖХ-МС, не являлись ожидаемыми производными изоксазола. На масс-спектре химической ионизации полученные соединения имели пик протонированного молекулярного иона (M+H+) при M/Z = 237. На их 1Н ЯМР-спектрах отсутствовал сигнал протона при С-4 атоме изоксазольного цикла, но присутствовали сигнал двух протонов в виде синглета в области 4 м.д. и очень слабопольный сигнал одного протона в виде уширенного синглета в области 13 м.д. На основании этих данных стало очевидно, что реакция 25в-д с гидроксиламином приводит к региоселективному образованию оксимов 28а-в, и даже длительное кипячение реагентов в этаноле (более 10 ч) не приводит к циклизации в соответствующие изоксазолы. Лишь кипячение оксимов 28а-в в избытке хлорокиси фосфора в течение 1 ч приводило к дегидратации и циклизации с образованием соответствующих пиридинил замещенных изоксазолов 27в-д с выходом 80 %. Это подтверждалось наличием на 1Н ЯМР-спектрах в области 7.25-7.45 м.д. сигнала в виде синглета, относящегося к протону при С-4 атоме углерода изоксазольного цикла, а так же данными ЖХ-МС – характерным протонированным молекулярным ионом (М+Н+) при M/Z = 219.
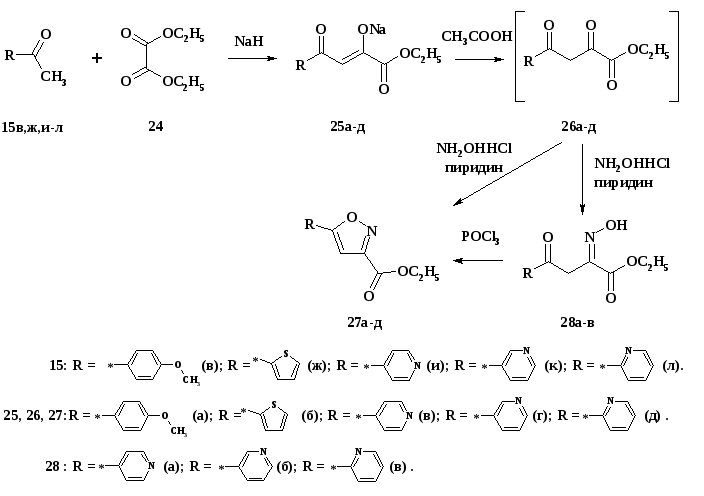
Региоселективность взаимодействия соединений 25а-д с гидроксиламином была доказана совокупностью данных 1Н ЯМР-спектроскопии и ЖХ-МС. Для подтверждения положения заместителей в изоксазольном цикле соединений 27 был изучен их распад под действием электронного удара. На схеме 62 представлены пути фрагментации по данным масс-спектра соединения 27б [71]. Интенсивный сигнал, соответствующий фрагменту при M/Z = 111, подтверждает нахождение тиофенового фрагмента в положении 5-изоксазольного цикла.

Схема 62
При сульфохлорировании 3-метил-5-фенилизоксазола 21а в смеси 10- кратного избытка хлорсульфоновой кислоты и 10 %-ного избытка пятихлористого фосфора была получена смесь 4- и 3- сульфохлоридов 29 и 30 в соотношении 40:60 (% моль) соответственно (схема 63). Такое соотношение изомеров в смеси было получено при 60 С, при это выход общий выход соединений 29 и 30 в расчете на исходный 3-метил-5-фенилизоксазол 21а составил 90 %. При проведении реакции при 25 С соотношение изомеров в смеси не изменилось, однако общий выход соединений 29 и 30 в расчете на исходный 21а составил лишь 30 %. Несмотря на подбор условий, нам не удалось разделить изомерные сульфохлориды хроматографически.
По результатам квантовохимических расчетов методом АМ1 было вычислено, что энергия локализации промежуточного σ-комплекса при введении сульфогруппы в мета-положение к гетероциклу на 27,83 кДж/моль меньше, чем энергия локализации σ-комплекса, образующегося при введении сульфогруппы в пара-положении к гетероциклу (а так же его резонансной структуры с локализацией положительного заряда на атоме кислорода гетероцикла). Исходя из этих результатов следует, что σ-комплекс с сульфогруппой в пара-положении к гетероциклу более стабилен и равновесие должно быть смещено в сторону образования сульфохлорида 29. Однако если считать, что изоксазольный цикл, как электроноакцепторный заместитель, является мета-ориентантом в реакциях электрофильного замещения, то становится объяснимой причина образования смеси сульфохлоридов 29 и 30 в соотношении 40:60 (% моль) соответственно.
На основе смеси 29 и 30 реакцией сульфамидирования с использованием морфолина и пиридина была получена смесь изомерных сульфамидов 31 и 32. Разделить изомеры хроматографически нам так же не удалось, однако удалось разделить их дробной кристаллизацией из этанола.

Схема 63
При сульфохлорировании 4/-замещенных 3-метил-5-арилизоксазолов 21б,в,д,е и 4/-замещенных 3,4-диметил-5-арилизоксазолов 21и,к, а также этилового эфира 5-(4-метокси-фенил)-изоксазол-3-карбоновой кислоты 27а в смеси 10-кратного избытка хлорсульфоновой кислоты и 10 %-ного избытка пятихлористого фосфора происходит региоселективное образование сульфохлоридов 33а-ж с выходом 65-85 % (схема 64). Образование сульфохлоридов 33а,б,д-ж проходило при 60 ºC в течение 2 ч, а соединений 33в,г - при 90 ºC в течение 4 ч, что, вероятно, связано со стерическими препятствиями, вызванными этильным и изо-пропильным заместителем в 4/-положении. Из сульфохлоридов 33а-ж были получены соответствующие сульфамиды 34а-ж. Строение соединений было изучено совокупностью методов 1Н ЯМР-спектроскопии и ЖХ-МС. На 1Н ЯМР-спектрах соединений 33 и 34 характерно наличие АВХ-системы сигналов ароматических протонов, подтверждающей нахождение сульфогруппы в м-положении к изоксазольному циклу [69].

Схема 64
При сульфохлорировании метилзамещенного изоксазола 21г в течение 2 ч при 60 ºC смеси 10-кратного избытка хлорсульфоновой кислоты и 10 %-ного избытка пятихлористого фосфора была получена смесь изомерных сульфохлоридов 35а и 36а в соотношении 40:60 (% моль) соответственно (схема 65). Их удалось эффективно разделить методом жидкостной хроматографии с использованием в качестве элюента смеси этилацетата и гексана в соотношении 25:75 (% обьемных). На основе сульфохлоридов 35а и 36а были синтезированы сульфамиды 37а и 38а путем нагревания с морфолином и пиридином в ацетонитриле до 60 ºC в течение 2 ч.

Схема 65
На 1Н ЯМР-спектрах сульфохлоридов 35а и 36а в области 6.5-8.0 м.д. имеется наличие АВХ-системы сигналов ароматических протонов (два протона, находящихся в орто-взаимодействии друг с другом, и один протон, находящийся в мета-взаимодействии с одним из первых двух протонов). Причем у обоих изомеров сигналы ароматических протонов расположены на 1Н ЯМР-спектрах в одинаковом порядке: дуплет дуплетов, дуплет с маленькой КССВ, дуплет с большой КССВ. Существует лишь одно характерное отличие между 1Н ЯМР-спектрами соединений 35а и 36а - значение КССВ для сигналов ароматических протонов. Но на основании этих данных не возможно точно определить положение сульфогруппы, поэтому для однозначного установления строения полученных сульфохлоридов и их сульфамидных производных был использован метод двухмерной корреляционной 1Н-1Н ЯМР-спектроскопии методом NOESY. На рисунках 8, 9 представлены корреляционные спектры сульфамидов 37а, 38а и взаимодействия между близко расположенными в пространстве протонами, обусловленные ядерными эффектами Оверхаузера. На корреляционном 1Н-1Н ЯМР-спектре соединения 37а характерен корреляционный пик взаимодействия между протоном при С-4 атоме углерода изоксазольного цикла и В-протоном АВХ-системы (имеющим сигнал в виде дуплета дуплетов). Такое взаимодействие подтверждает нахождение сульфо группы в пара-положении к изоксазольному циклу. Характерным для 1Н ЯМР-спектров сульфамида 37а и сульфохлорида 35а является значения КССВ сигналов протонов АВХ-системы - КССВ между А и В протонами 8.7 Гц, КССВ между В и Х протонами 1.4 Гц. В случае нахождения сульфо группы в орто-положении к изоксазольному циклу взаимодействие между В-протоном АВХ-системы и протоном при С-4 атоме углерода изоксазольного цикла было бы не возможно из-за очень большого расстояния между ними. Действительно на корреляционном 1Н-1Н ЯМР-спектре соединения 38а наблюдается корреляционный пик взаимодействия между В-протоном АВХ- системы и расположенными близко в пространстве протонами метокси группы. Кроме того, наблюдается корреляционный пик взаимодействия между протоном при С-4 атоме углерода изоксазольного цикла и протонами морфолина. Все это указывает на нахождение сульфогруппы в орто-положении к изоксазольному циклу. Характерным для 1Н ЯМР-спектров сульфохлорида 36а и сульфамида 38а является значения КССВ сигналов протонов АВХ-системы - КССВ между А и В протонами 9.1 Гц, КССВ между В и Х протонами 2.5 Гц. [69,70]

Рис. 8. Корреляционный 1Н-1Н NOESY спектр соединения 37а и построенная на его основе схема взаимодействия протонов.

Рис. 9. Корреляционный 1Н-1Н NOESY спектр соединения 38а и построенная на его основе схема взаимодействия протонов.
