- •Введение
- •Предмет медицинской химии
- •Современный способ разработки лекарственных препаратов
- •Требования к молекулам-кандидатам в лекарства, концепция lead-like, правило Липински.
- •Перспективность использования гетероциклов в качестве лекарственных препаратов
- •Лекция про виагру
- •Физико-химические методы анализа.
- •Хроматография. Сущность метода. Области применения. Применение хроматографии в медицинской химии. Тсх – быстрота, простота и информативность
- •Синтез сульфопроизводных на основе
- •Синтез и функционализация производных изоксазола
- •2.1.2 Сульфамидные производные 3-метил-5-аминовинил замещенных изоксазолов
- •2.1.4 Сульфамидные производные 3-метил-4-нитро-5-винилизоксазолов
- •2.2 Синтез двуядерных соединений, содержащих изоксазольный цикл, их функционализация и превращения
-
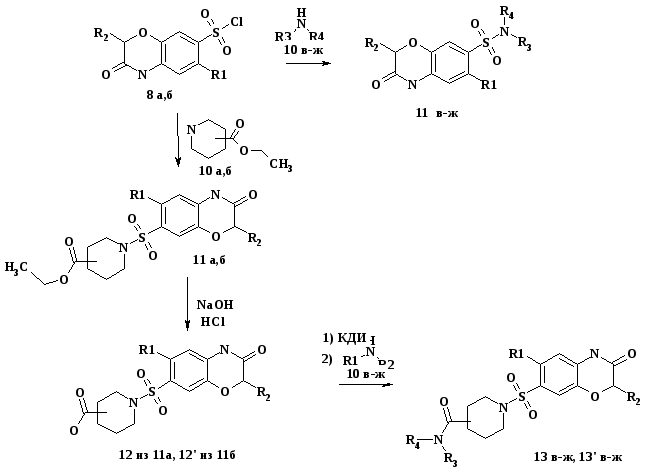
Синтез сульфопроизводных на основе
4Н-БЕНЗО(1,4)ОКСАЗИН-3-ОНА
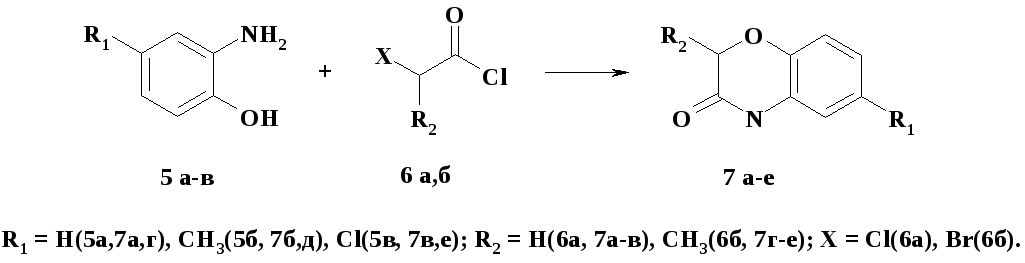
Синтез 4Н-бензо(1,4)оксазин-3-она и его производных 7 а-е осуществлялся взаимодействием различных о-аминофенолов 5 а-в с хлорангидридами хлоруксусной 6 а и 2-бромпропионовой 6 б кислот (схема1).
На основании экспериментальных данных спектроскопии 1Н ЯМР и 1Н-1Н NOESY установлено, что сульфохлорирование 4Н-бензо(1,4)оксазин-3-она 7 а и 2-метил-4Н-бензо(1,4)оксазин-3-она 7 г хлорсульфоновой кислотой в выбранных условиях идет строго в положение 6. В случае наличия в положении 6 какого-либо заместителя (соединения 7 б,в,д,е) сульфохлорирование идет в положение 7 (схема 2).
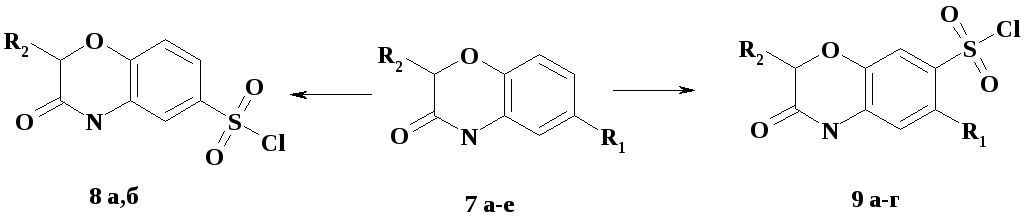
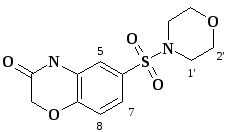
Рис. 2. Соединение 11аг с нумерацией атомов, принятых для интерпретации спектров
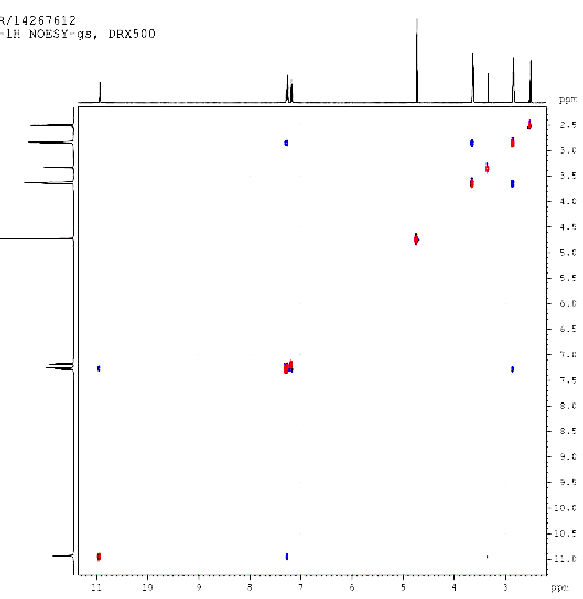
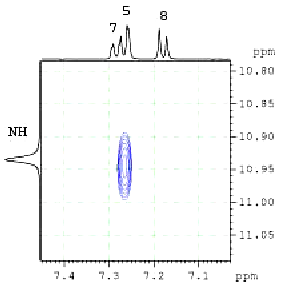
Рис. 3. Двумерный корреляционный спектр 1Н-1H NOESY 11ав
В 1Н-1Н NOESY спектре соединения 11ав (рис. 3) наблюдается кросс-пик, характеризующий взаимодействие протона группы NН (хим. сдвиг 10,94 м.д.) с одним ароматическим протоном (протон при 5С, 7,25 м.д.). Сигнал этого протона представляет собой дублет с константой J=1,8 Гц, характеризующей его мета-взаимодействие с еще одним протоном (протон при 7С, 7,27 м.д., дд, J1=8,3 Гц, J2=1,8 Гц). Последнее было бы невозможным в случае местонахождения сульфогруппы в положении 7-. Одновременно в спектре NOESY наблюдается кросс-пик, характеризующий взаимодействие этих двух протонов. Кроме того, на спектре присутствует кросс-пик, характеризующий взаимодействие протонов при 5С и 7С с протонами CH3 групп аминного фрагмента (1’С, 2,84 м.д.).
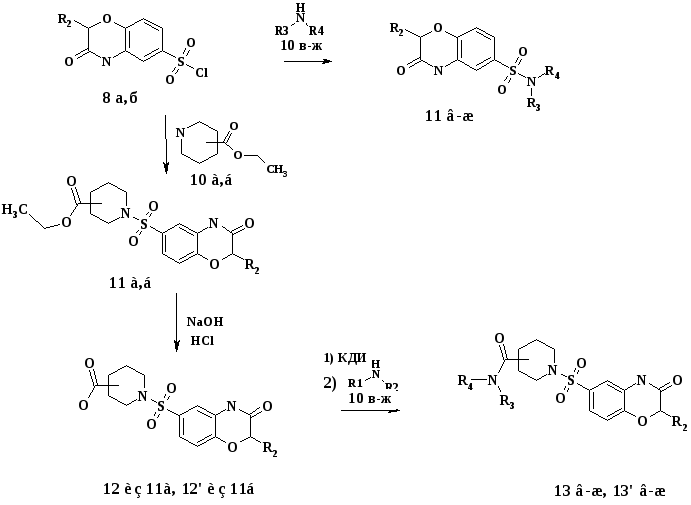
Схема 3.
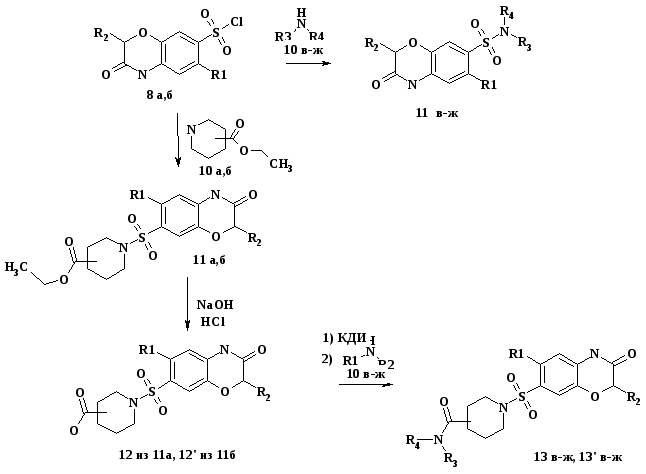
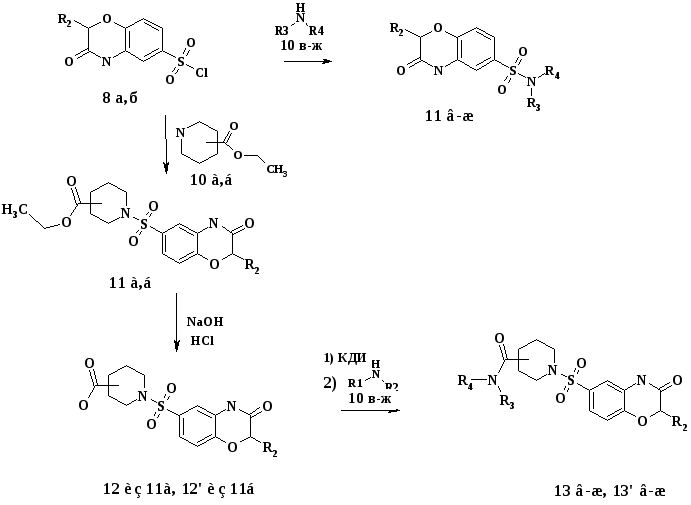
Схема 3.
Синтез и функционализация производных изоксазола
Известно, что значительный недостаток электронной плотности в изоксазоле препятствует его функционализации посредством реакции электрофильного замещения. Однако наличие двух метильных групп в молекуле 3,5-диметилизоксазола увеличивает электронную плотность кольца и способствует сульфо- и нитрофункционализации данной гетероциклической системы.
При нагревании 1,3-диметилизоксазола 1 в смеси 10-кратного избытка хлорсульфоновой кислоты и 10 %-ного избытка пятихлористого фосфора до 130 ºC был синтезирован 3,5-диметилизоксазол-4-сульфонил хлорид 2 (схема 47).
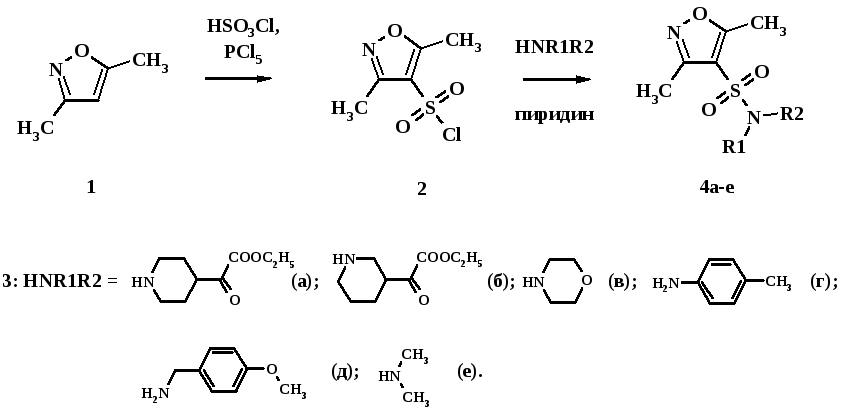
Щелочным гидролизом сложноэфирной группы соединений 4а,б были синтезированы кислоты 5а,б. Реакцию гидролиза проводили в 5 %-ном водном растворе гидроксида натрия в присутствии каталитического количества этанола при 70 С в течение 30 мин.
2.1.2 Сульфамидные производные 3-метил-5-аминовинил замещенных изоксазолов
Известно, что электроноакцепторными заместителями в положении 4- изоксазольного цикла активируют 5-метильную группу к реакциях конденсации с нитрозосоединениями и альдегидами [5]. Нами установлено, электроноакцепторные сульфамидные заместители в положении 4- изоксазольного цикла активируют метильную группу в реакцию конденсации с диметоксиметил-диметил амином, с получением соответствующих аминовинилпроизводных 7а-в,е с выходом 76-88 % (схема 49). Реакцию проводили в ДМФА при 100-120 С в течение 3 ч. В аналогичных условиях, и даже при более длительном нагревании (до 12 ч), 3,5-диметилизоксазол с диметоксиметил-диметиламином не реагирует.
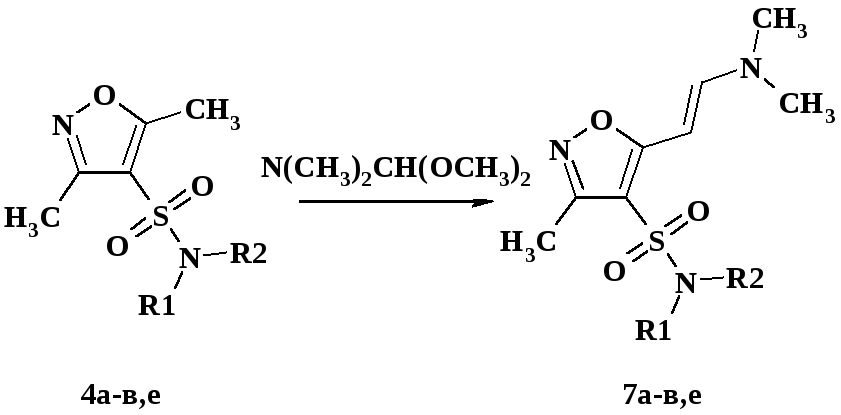
Совокупностью данных ЖХ-МС и 1Н ЯМР-спектроскопии установлено, что конденсация протекает региоселективно и стереоселективно. На 1Н ЯМР-спектрах соединений 7а-д в области 4.9 и 5.3 м.д. присутствуют два дуплета с константой спин-спинового взаимодействия (КССВ) 13.7 Гц, соответствующие двум протонам двойной связи в енаминовом фрагменте. Большое значение КССВ указывает на нахождение заместителей при двойной связи в транс-форме [69]. Методом 1Н ЯМР-спектроскопии не возможно определить, в каком из двух возможных положений изоксазольного цикла (3- или 5-) находится енаминовый фрагмент. Для однозначного определения строения был использован метод рентгено-структурного анализа (РСА) [72]. Выбор соединения для РСА был обусловлен возможностью получения крупного монокристалла. По примененной нами методике успешно удалось получить кристалл требуемых размеров только для соединения 7а. В результате было точно установлено, что 7а представляет собой исключительно 5-аминовинилпроизводное, с положением заместителей при двойной связи в транс-форме (рис. 6 и 7).
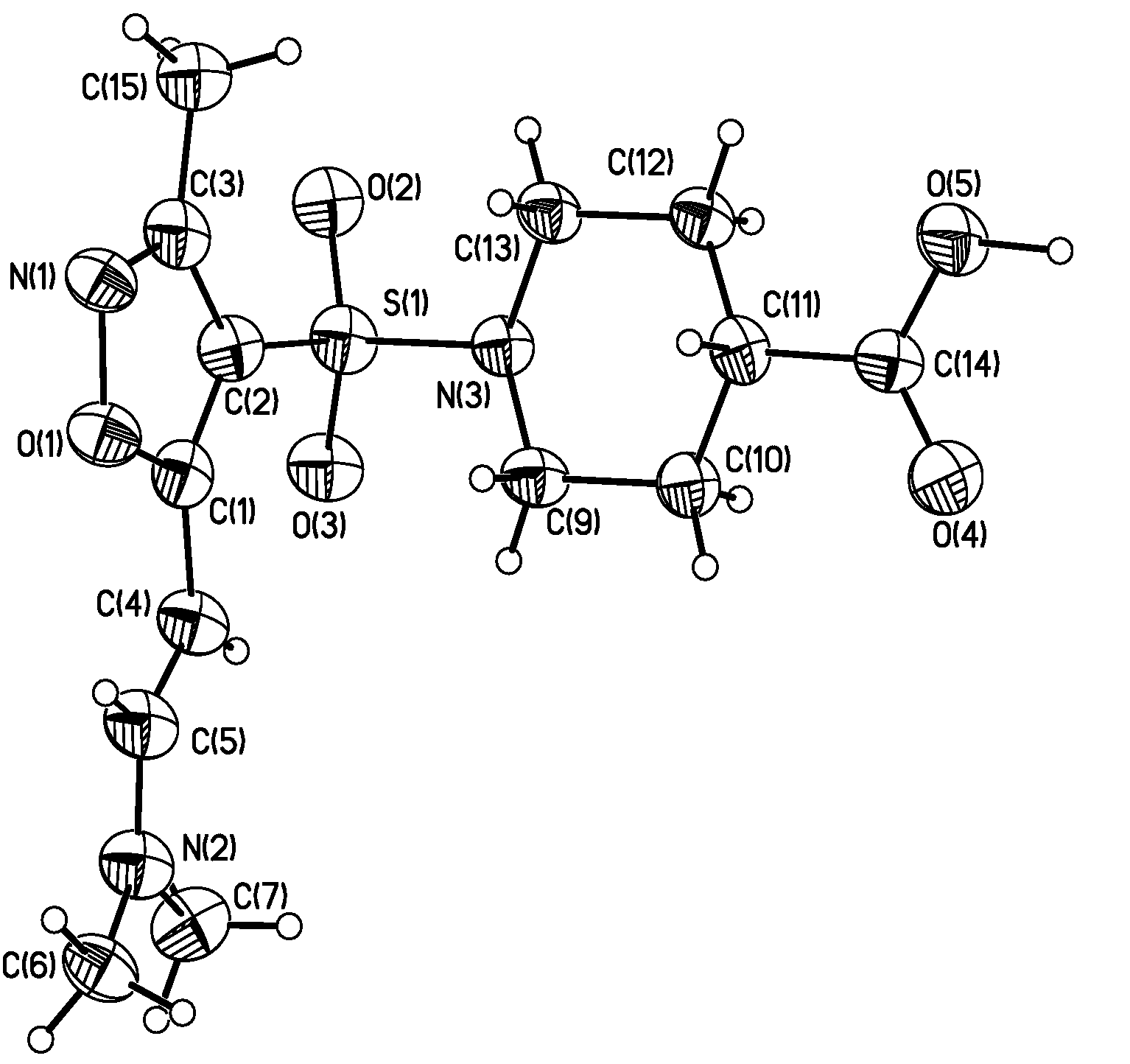
Рис. 6. Результат РСА соединения 7а
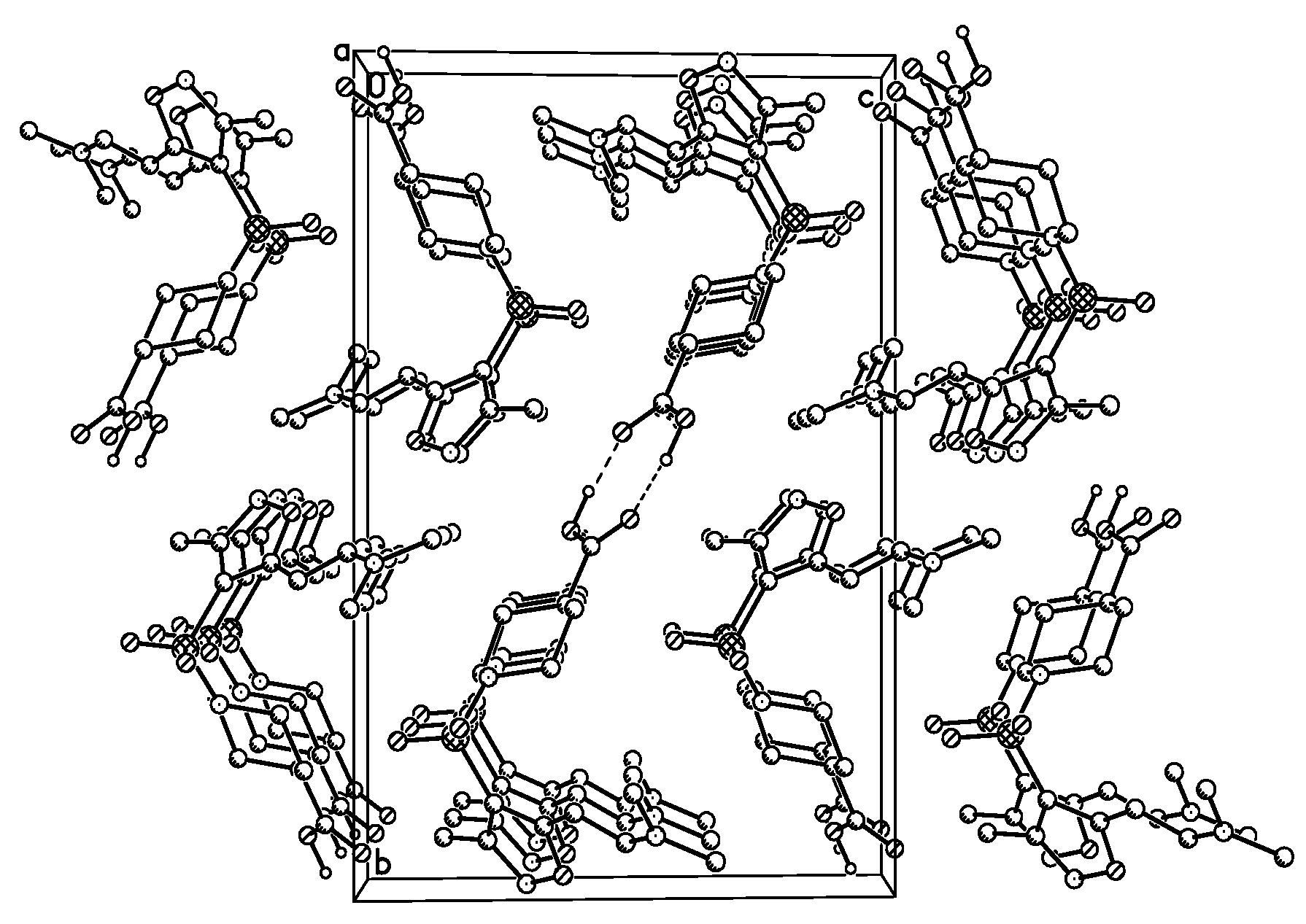
Рис. 7. Расположение молекул в кристалле соединения 7а по данным РСА
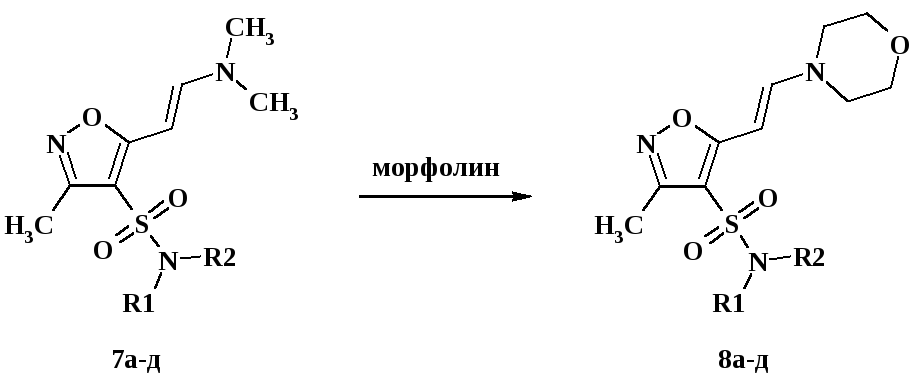
При длительном кипячении соединений 7а-е в ДМФА с морфолином были синтезированы продукты переаминирования 8а-е с выходом 40-72 %. Реакция переаминирования обратима, поэтому для полного переаминирования необходим трехкратный избыток амина-реагента (схема 52). Строение синтезированных соединений было определено совокупностью методов ЖХ-МС и 1Н ЯМР-спектроскопии.