
- •Содержание
- •Контрольные задачи
- •Тема 2. Эквиваленты
- •Контрольные задачи
- •Тема 3. Строение атома
- •Контрольные задачи
- •Тема 4. Химическая связь
- •Контрольные задачи
- •Тема 5. Энергетика химических процессов и химическое сродство (термохимические и некоторые термодинамические расчеты)
- •Контрольные задачи
- •Тема 6. Химическая кинетика и химическое равновесие
- •Контрольные задачи
- •Контрольные задачи
- •Тема 7. Растворы. Способы выражения концентрации растворов.
- •Контрольные задачи
- •Тема 8. Ионно-молекулярные реакции обмена.
- •Контрольные задачи
- •Тема 9. Гидролиз солей
- •Контрольные задачи
- •Тема 10. Окислительно-восстановительные реакции
- •Контрольные задачи:
- •Тема 11. Электрохимия
- •Пример 1. Сколько меди выделится на катоде, если через раствор медного купороса пропустить ток силой 2,68 а в течение 30 мин?
- •3600 Кл электричества выделит х г
- •3600 Кл электричества выделит y г
- •Контрольные задачи (Электродные потенциалы, гальванический элемент)
- •Контрольные задачи (Электролиз)
- •Тема 12. Коррозия металлов
- •Контрольные задачи
- •Тема 13. Комплексные соединения
- •Контрольные задачи
Контрольные задачи:
Для всех заданий:
- укажите восстановитель и окислитель в указанных реакциях;
- исходя из степени окисления атомов окислителя и восстановителя охарактеризуйте их (только окислительные, только восстановительные свойства или окислительно-восстановительная двойственность);
- составьте методами электронного и электронно-ионного баланса уравнения реакций, протекающей по указанным схемам;
- рассчитайте массы молярных эквивалентов окислителя (восстановителя) в ОВР.
1. Sn + H2SO4 SnSO4 + SO2 + H2O;
H2S + H2SO3 S + H2O.
2. KMnO4 + HCl MnCl2 + Cl2 + H2O + KCl;
Ca + HNO3 Ca(NO3)2 + NH4NO3 + H2O.
3. Al + H2SO4 Al2(SO4)3 + H2;
Zn + H2O + NaOH Na2[Zn(OH)4] + H2.
4. Sn + H2O + KOH K2[Sn(OH)4] + H2;
Zn + H2SO4 ZnSO4 + H2.
5. KJ + KNO2 + H2SO4 J2 + NO + K2SO4 + H2O;
KMnO4 + KNO2 + H2SO4 MnSO4 + KNO3 +K2SO4 + H2O.
6. MnO2 + HCl MnCl2 + Cl2 + H2O;
KMnO4 + HCl MnCl2 + Cl2 + H2O +KCl.
7. Zn + H2SO4 ZnSO4 + H2S + H2O;
Pb + HNO3 Pb(NO3)2 + NO + H2O.
8. KMnO4 + K2SO3 + H2SO4 MnSO4 + K2SO4 + H2O;
KMnO4 + HCl MnCl2 + Cl2 + H2O + KCl.
9. Hg + HNO3 Hg(NO3)2 + NO + H2O;
K2Cr2O7 + K2SO3 + H2SO4 Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HCl PbCl2 + Cl2 + H2O;
Al + H2SO4 Al2(SO4)3 + H2.
11. Zn + H2O + KOH K2[Zn(OH)4] + H2;
Al + H2SO4 Al2(SO4)3 + H2.
12. KMnO4 + Na2SO3 + H2SO4 MnSO4 + Na2SO4 +K2SO4 + H2O;
Fe + HNO3 Fe(NO3)3 + NO + H2O.
13. Mg + H2SO4 MgSO4 + H2S + H2O;
Cu + HNO3 Cu(NO3)2 + NO + H2O.
14. Zn + H2O + KOH K2[Zn(OH)4] + H2;
Al + H2SO4 Al2(SO4)3 + H2.
15. KJ + KNO2 + H2SO4 J2 + NO + K2SO4 + H2O;
KMnO4 + K2SO3 + H2SO4 MnSO4 + K2SO4 + H2O.
16. MnO2 + HCl MnCl2 + Cl2 + H2O;
K2CrO4+ HCl CrCl3 + Cl2 + H2O +KCl.
17. Sn + H2SO4 SnSO4 + H2S + H2O;
Cu + HNO3 Cu(NO3)2 + NO + H2O.
18. KMnO4 + K2SO3 + H2SO4 MnSO4 + K2SO4 + H2O;
Zn + H2O + LiOH Li2[Zn(OH)4] + H2.
19. Hg + HNO3 Hg(NO3)2 + NO + H2O;
K2Cr2O7 + K2SO3 + H2SO4 Cr2(SO4)3 + K2SO4 + H2O.
20. S + KOH K2S + K2SO3 + H2O;
KMnO4 K2MnO4 + MnO2 + O2.
21. Cr2(SO4)3 + H2O2 + NaOH Na2CrO4 + H2O;
Cl2 + KOH(хол.) KClO + Kl + H2O.
22. SO2 + H2S S + H2O;
I2 + H2S HI + S.
23. KClO3 KCl + KClO4;
Cl2 + KOH(гор.) KClO3 + KCl + H2O.
24. K2MnO4 + Cl2 KMnO4 + KCl;
Zn + H2SO4 ZnSO4 + H2S + H2O.
25. Cu + HNO3 Cu(NO3)2 + NO + H2O;
Zn + H2O + NaOH Na2[Zn(OH)4] + H2.
Тема 11. Электрохимия
Все электрохимические процессы можно разделить на две основные группы: процессы превращения химической энергии в электрическую (процессы в гальванических и топливных элементах) и процессы превращения электрической энергии в химическую (электролиз). Основные понятия электрохимии: электродный потенциал, ряд напряжений, гальванический элемент и др.
При погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл-раствор создается двойной электрический слой за счет частичного перехода атомов металла в раствор и обратного процесса.
Возникающую разность потенциалов EMe принято называть электродным потенциалом металла, вызванным образованием двойного электрического слоя, который можно представить в виде конденсатора, одна обкладка которого является поверхностью металла, а другая соответствует слою ионов, находящихся в растворе и притягивающихся к поверхности металла за счет электростатического взаимодействия. На границе раздела устанавливается равновесие: Me – nē = Men+.
Разность потенциалов, возникшая между металлом и раствором называется равновесным электродным потенциалом EР, который зависит от природы металла, концентрации его ионов в растворе и температуры окружающей среды.
Электродные потенциалы обычно определяют по отношению к так называемому стандартному водородному электроду, потенциал которого условно принят равным нулю.
Разность между потенциалом металла, погруженного в раствор его соли с концентрацией одного моль иона металла в 1 дм3 и потенциалом стандартного водородного электрода при 25С называется стандартным электродным потенциалом данного металла.
Располагая металлы по их стандартным потенциалам, получим электрохимический ряд металлов – ряд напряжений металлов.
Ряд напряжений металлов
|
Металл |
Электродная реакция |
E0, В |
|
Металл |
Электродная реакция |
E0, В |
|
Li |
Li+ + ē Li |
-3,04 |
|
Cr |
Cr3+ + 3ē Cr |
-0,74 |
|
Rb |
Rb+ + ē Rb |
-2,99 |
|
Fe |
Fe2+ + 2ē Fe |
-0,44 |
|
Cs |
Cs+ + ē Cs |
-2,93 |
|
Cd |
Cd2+ + 2ē Cd |
-0,40 |
|
K |
K+ + ē K |
-2,92 |
|
In |
In3+ + 3ē In |
-0,34 |
|
Ba |
Ba2+ + 2ē Ba |
-2,90 |
|
Tl |
Tl+ + ē Tl |
-0,33 |
|
Sr |
Sr2+ + 2ē Sr |
-2,89 |
|
Co |
Co2+ + 2ē Co |
-0,28 |
|
Ca |
Ca2+ + 2ē Ca |
-2,87 |
|
Ni |
Ni2+ + 2ē Ni |
-0,25 |
|
Na |
Na+ + ē Na |
-2,71 |
|
Sn |
Sn2+ + 2ē Sn |
-0,14 |
|
La |
La3+ + 3ē La |
-2,52 |
|
Pb |
Pb2+ + 2ē Pb |
-0,13 |
|
Mg |
Mg2+ + 2ē Mg |
-2,36 |
|
H |
2H+ + 2ē H2 |
0,00 |
|
Th |
Th4+ + 4ē Th |
-1,90 |
|
Ge |
Ge2+ + 2ē Ge |
+0,01 |
|
Be |
Be2+ + 2ē Be |
-1,85 |
|
Cu |
Cu2+ + 2ē Cu |
+0,34 |
|
U |
U3+ + 3ē U |
-1,79 |
|
Ag |
Ag+ + ē Ag |
+0,80 |
|
Al |
Al3+ + 3ē Al |
-1,66 |
|
Pd |
Pd2+ + 2ē Pd |
+0,83 |
|
Zr |
Zr4+ + 4ē Zr |
-1,53 |
|
Hg |
Hg2+ + 2ē Hg |
+0,85 |
|
Ti |
Ti3+ + 3ē Ti |
-1,21 |
|
Pt |
Pt2+ + 2ē Pt |
+1,20 |
|
Mn |
Mn2+ + 2ē Mn |
-1,18 |
|
Au |
Au3+ + 3ē Au |
+1,50 |
|
Zn |
Zn2+ + 2ē Zn |
-0,76 |
|
Au |
Au+ + ē Au |
+1,69 |
Ряд напряжений характеризует химические свойства металла:
- каждый металл этого ряда восстанавливает все стоящие ниже металлы из растворов их солей;
- чем выше в ряду напряжений расположен металл, тем больше его химическая активность, т.е. тем сильнее его восстановительная способность;
- все металлы, расположенные в ряду напряжений выше водорода, восстанавливают его из растворов разбавленных кислот.
Значения электродных потенциалов металлов при нестандартных условиях вычисляются по уравнению Нернста:
|
E Men+/Me = E0Men+/Me + |
RT |
ln aMen+ , |
|
nF |
где E0Men+/Me – стандартный электродный потенциал; n – число электронов, участвующих в окислительно-восстановительном процессе; F – постоянная Фарадея (9,65104 Кл/моль экв); Т – абсолютная температура, К; R – Универсальная газовая постоянная (8,314 Джград-1моль-1); aMen+ – активная концентрация (активность) ионов металла в растворе, моль/дм3.
Замена в уравнении Нернста постоянных величин их численными значениями, а натурального логарифма десятичным, позволяет получить следующее выражение (применительно к температуре 25С):
|
E Men+/Me = E0Men+/Me + |
0,0592 |
lg aMen+ . |
|
N |
Гальваническими элементами называются устройства, преобразующие химическую энергию окислительно-восстановительных процессов в электрическую. Возникновение электрического тока в гальваническом элементе обусловлено разностью потенциалов взятых металлов. Например, в цинково-медном гальваническом элементе, на цинковом электроде, опущенном в раствор сульфата цинка, происходит окисление атомов цинка – растворение цинковой пластины: Zn - 2ē = Zn2+. На медном электроде, погруженном в раствор сульфата меди, происходит восстановление ионов меди из раствора: Cu2+ + 2ē = Cu.
Цинковый электрод является источником электронов и имеет меньший потенциал по сравнению с медным (см. табл.). Электрод на котором протекает процесс окисления, называется анодом (Zn – A), а электрод, на котором протекает процесс восстановления, называется катодом (Cu – К).
Г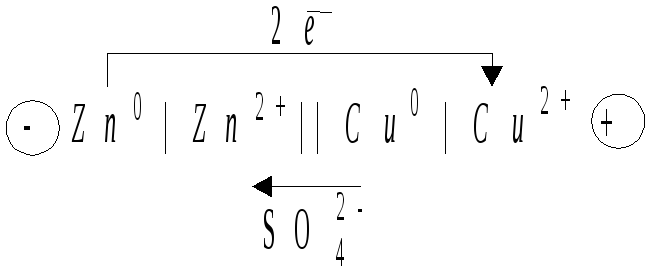 альванический
элемент можно представить в виде краткой
электрохимической схемы (формулы), анод
записывается слева, катод – справа:
альванический
элемент можно представить в виде краткой
электрохимической схемы (формулы), анод
записывается слева, катод – справа:
В этой схеме одна черта означает границу между электродом и раствором, две черты – границу между двумя растворами.
Разность потенциалов электродов гальванического элемента называется его электродвижущей силой (ЭДС). Она для любого гальванического элемента – величина положительная и вычисляется по разности электродных потенциалов: из величины более положительного вычитается величина менее положительного потенциала. Гальванические элементы, состоящие из одинаковых электродов, помещенных в растворы с различными активностями ионов, называются концентрационными. В этом случае металл погруженный в более разбавленный раствор выполняет функцию анода, а помещенный в более концентрированный – катода.
Электролиз представляет собой совокупность процессов, в которых химические реакции протекают на электродах при пропускании электрического тока через растворы или расплавы электролитов. Происходящие при этом процессы делятся на первичные и вторичные. Первичные процессы – это окислительно-восстановительные реакции, протекающие на электродах. Вторичные – реакции с участием образовавшихся в первичных процессах активных частиц. Как и в случае химического источника тока, электрод, на котором происходит окисление, называют анодом, а электрод, на котором идет восстановление – катодом. Однако различие здесь заключается в том, что при электролизе анод заряжен положительно (+), а катод отрицательно (-). Для химических источников тока знаки обратные. Это связано с тем, что процессы, протекающие при электролизе, обратны процессам, имеющим место в гальванических элементах. Отличительной особенностью здесь является то, что при электролизе химические реакции осуществляются за счет электрической энергии внешнего источника, тогда как при работе гальванического элемента энергия самопроизвольно протекающей химической реакции превращается в электрическую.
На практике проводят электролиз как водных растворов, так и расплавов электролитов. Электролиз расплавов более прост, так как в этом случае на электродах окисляются или восстанавливаются только ионы, образовавшиеся при плавлении электролита. Электролиз водных растворов электролитов протекает сложнее, поскольку в этом случае на электродах могут окисляться и восстанавливаться молекулы воды. Однако электролиз растворов электролитов проводить энергетически выгодно, чем расплавов, так как электролиты – соли и щелочи, плавятся при очень высоких температурах.
Электроды могут быть выполнены из различных материалов. Инертный электрод, как правило, изготавливается из графита, платины, золота, хотя графит может окисляться кислородом, выделяющимся в ходе электролиза, и тем самым участвовать во вторичных процессах электролиза. Активный (растворимый) анод, сделан из металла, способного окисляться (растворяться) в процессе электролиза.
Электролиз расплавов
Рассмотрим несколько примеров электролиза расплавов веществ:
Пример 1. Электролиз расплава хлорида натрия
В расплаве NaCl (выше 800С) происходит диссоциация на ионы: NaCl Na+ + Cl-
При пропускании через расплав электрического тока протекают процессы: Na+ + ē Na (на катоде) и 2Cl- - 2ē Cl2 (на аноде).
Суммарное уравнение процесса электролиза: 2NaCl = 2Na + Cl2.
Как правило, процесс электролиза представляют в виде общей схемы:
|
|
NaCl |
|
|
||||
|
|
(800C) |
|
|
||||
|
(-) К |
Na+ + Cl- |
А(+) |
|
||||
|
Na+ + ē Na |
|
2Cl‾ – 2ē Cl2 |
|
||||
|
|
|
|
|
||||
|
К: |
Na+ + ē = Na |
2 |
|
||||
|
А: |
2Cl‾ – 2ē = Cl2 |
1 |
|
||||
|
Суммарно: |
2Na+ + 2Cl- = 2Na + Cl2 |
||||||
|
|
эл. ток |
||||||
|
|
2NaCl = 2Na + Cl2 |
||||||
|
|
на катоде на аноде |
||||||
Пример 2. Электролиз расплава гидроксида натрия:
Катодный процесс протекает аналогично схеме электролиза NaCl, анодный протекает согласно уравнению: 4OH- - 4ē O2 + 2H2O.
При электролизе растворов схема усложняется, поскольку в электрохимических реакциях на электродах могут принимать участие частицы растворителя. При этом из нескольких возможных процессов первым будет протекать тот, осуществление которого связано с наименьшей затратой энергии. Это означает, что на катоде будут восстанавливаться окисленные формы электрохимических систем, имеющих наибольший электродный потенциал, а на аноде – окисляться восстановленные формы с наименьшим электродным потенциалом.
Рассмотрим более подробно электролиз водных растворов неорганических веществ. Для этого необходимо определить последовательность разряда ионов на электродах.
Электрохимические реакции на катоде
Для того чтобы определить, какие частицы будут восстанавливаться на катоде, необходимо использовать значения равновесных потенциалов (см. выше). Необходимо иметь ввиду, что при электролизе водных растворов солей рН раствора принимается равным 7, и, следовательно, концентрация ионов водорода равна 10-7 моль/дм3. В этом случае величина равновесного потенциала водородного электрода равна:
EH2O/H2 = E0 + 0,059lg10-7 = -0,413 В.
Последняя величина значительно отличается от стандартного потенциала водородного электрода. На катоде будут восстанавливаться в первую очередь частицы, имеющие больший по величине равновесный потенциал. Если проводится электролиз раствора одного вещества, возможны три случая:
При E0Men+/Me >> EH2O/H2, то восстанавливаются ионы металла. Например:
E0Cu2+/Cu = 0,334 В >> EH2O/H2 = -0,413 В,
К: Cu2+ + 2ē = Cu.
Если E0Men+/Me EH2O/H2, то идет одновременное восстановление иона металла и водорода из молекул воды, например:
E0Fe2+/Fe = -0,443 В.
Величина равновесного потенциала железа достаточно близка EH2O/H2:
К: Fe2+ + 2ē = Fe,
2H2O + 2ē = H2 + 2OH-.
Этот случай относится к растворам солей металлов, занимающих в ряду напряжений положение между алюминием и водородом, т.е.
E0Al3+/Al < E0Men+/Me < E0H+/H2
E0H+/H2 = 0 соответствует стандартному равновесному потенциалу водородного электрода.
Если E0Men+/Me << EH2O/H2, то идет восстановление водорода из воды:
К: 2H2O + 2ē = H2 + 2OH-.
Из опыта следует, что металлы от Li и до Аl в ряду напряжений не восстанавливаются из водных растворов их солей.
Если водный раствор содержит катионы различных металлов, то при электролизе происходит их последовательное выделение на катоде в порядке уменьшения стандартного электродного потенциала.
При электролизе солей, содержащих катионы аммония (NH4+), выделяется водород.
Электрохимические реакции на аноде
Как правило, на аноде окисляются частицы, имеющие меньший по величине равновесный потенциал. Электролиз может проводиться с использованием инертного электрода или с растворимым анодом.
Если электролиз проводится с инертным анодом, то окисляются ионы галогенов (Cl-, Br-, J-) или ОН-, имеющие меньшие величины равновесных потенциалов по сравнению с равновесным потенциалом окисления воды:
2H2O - 4ē = O2 + 4H+ E0O2/H2O = 1,23 В.
При электролизе растворов электролитов, имеющих кислородосодержащие ионы, в которых центральный атом элемента имеет максимальную степень окисления (NO3-, SO42-, PO43-, CO32-, ClO4- и др.), а так же при электролизе растворов, содержащих анионы F-, функцию восстановителя выполняют молекулы воды:
2H2O - 4ē = O2 + 4H+.
В щелочных средах на аноде в первую очередь окисляется гидроксид-ионы ОН‾:
4OH‾ - 4ē = O2 + 2H2O.
В случае активного (растворимого) анода число конкурирующих окислительных процессов возрастает до трех: электрохимическое окисление воды с выделением кислорода, разряд аниона (т.е. его окисление) и электрохимическое окисление металла анода (анодное растворение металла). Из этих возможных процессов в первую очередь будет идти тот, который энергетически наиболее выгоден. Если металл анода расположен в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет идти выделение кислорода или разряд аниона.
Например, при электролизе водного раствора сульфата никеля с никелевыми электродами происходит окисление никеля, потому что этот процесс характеризуется наименьшей величиной потенциала:
Ni - 2ē = Ni2+ (E0 = -0,25 В);
2H2O - 4ē = O2↑ + 4H+ (E0 = 1,23 В);
2SO42- - 2ē = S2O82- (E0 = 2,00 В).
Примеры электролиза растворов электролитов
Рассмотрим несколько примеров электролиза растворов:
- электролиз водного раствора иодида калия с инертными электродами:
|
|
KJ, H2O |
|
||||||
|
|
|
|
||||||
|
(-) К |
K+ + J- |
А(+) |
||||||
|
система: K+, H2O |
|
система: J -, H2O |
||||||
|
2H2O + 2ē H2+2OH- |
|
2J‾ – 2ē J2 |
||||||
|
|
|
|
||||||
|
К: |
2H2O + 2ē H2+2OH- |
1 |
|
|||||
|
А: |
2J‾ – 2ē J2 |
1 |
|
|||||
|
Суммарно: |
2H2O + 2J‾ = H2+2OH- + J2 |
|
||||||
|
|
эл. ток |
|
||||||
|
|
2KJ + 2H2O = H2+2KOH + J2 |
|
||||||
|
|
на катоде на аноде |
|
||||||
- электролиз водного раствора нитрата меди (II) с инертными электродами:
|
|
Cu(NO3)2, H2O |
|
||||||
|
|
|
|
||||||
|
(-) К |
Cu2+ + 2NO3- |
А(+) |
||||||
|
система: Cu2+, H2O |
|
система: NO3 -, H2O |
||||||
|
Cu2+ + 2ē Cu |
|
2H2O – 4ē O2 + 4H+ |
||||||
|
|
|
|
||||||
|
К: |
Cu2+ + 2ē Cu |
2 |
|
|||||
|
А: |
2H2O – 4ē O2 + 4H+ |
1 |
|
|||||
|
Суммарно: |
2Cu2+ + 2H2O = 2Cu + O2 + 4H+ |
|
||||||
|
|
эл. ток |
|
||||||
|
|
2Cu(NO3)2 + 2H2O = 2Cu + O2 + 4HNO3 |
|
||||||
|
|
на катоде на аноде |
|
||||||
- электролиз водного раствора сульфата меди (II) с медными электродами:
|
|
CuSO4, Cu, H2O |
|
||||||
|
|
|
|
||||||
|
(-) К |
Cu2+ + SO42- |
А(+) |
||||||
|
система: Cu2+, H2O |
|
система: Cu, SO42-, H2O |
||||||
|
Cu2+ + 2ē Cu |
|
Cu - 2ē Cu2+ |
||||||
|
|
|
|
||||||
|
К: |
Cu2+ + 2ē Cu |
1 |
|
|||||
|
А: |
Cu – 2ē Cu2+ |
1 |
|
|||||
|
|
эл. ток |
|
||||||
|
Суммарно: |
Cu2+ + Cu = Cu + Cu2+ |
|
||||||
|
|
на катоде на аноде |
|
||||||
- электролиз водного раствора сульфата цинка с инертным анодом:
|
|
ZnSO4, Zn, H2O |
|
||||||
|
|
|
|
||||||
|
(-) К |
Zn2+ + SO42- |
А(+) |
||||||
|
система: Zn2+, H2O |
|
Система: SO42-, H2O |
||||||
|
Zn2+ + 2ē Zn 2H2O + 2ē H2+2OH- |
|
2H2O – 4ē O2 + 4H+ |
||||||
|
|
|
|
||||||
|
К: |
Zn2+ + 2ē Zn 2H2O + 2ē H2+2OH- |
1 |
|
|||||
|
А: |
2H2O – 4ē O2 + 4H+ |
1 |
|
|||||
|
Суммарно: |
Zn2+ + 4H2O = Zn + H2+2OH- + O2 + 4H+ |
|
||||||
|
|
эл. ток |
|
||||||
|
|
ZnSO4 + 2H2O = Zn + H2 + O2 + 2H2SO4 |
|
||||||
|
|
на катоде на аноде |
|
||||||
Законы Фарадея
Поскольку прохождение электрического тока при электролизе связано с химическими превращениями, то существует определенная зависимость между количеством электричества и количеством прореагировавшего вещества. Эта зависимость была установлена М. Фарадеем (1833-1834).
Первый закон Фарадея устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества: масса вещества (m) выделенная на электроде электрическим током, пропорциональна количеству электричества (Q), прошедшего через электролит:
m = KЭ·I·τ = KЭ·Q,
где I – сила тока, А;
τ – время прохождения тока, с.
Коэффициент пропорциональности KЭ называется электрохимическим эквивалентом. Он показывает количество прореагировавшего вещества при прохождении одного кулона электричества:
KЭ = МЭК/F,
где МЭК – масса молярного эквивалента вещества, г/моль экв;
F – Постоянная Фарадея, равная 9,65104 Кл/моль экв.
Таким образом, масса вещества, образующегося при электролизе, может быть вычислена по формуле:
-
m =
МЭК ·I·τ
,
F
На практике, вследствие протекания побочных процессов электролиза, на электродах выделяется меньше вещества по сравнению с расчетным по количеству прошедшего через раствор электричества. Отношение количества фактически полученного продукта (mопыт.) к теоретическому (mтеор.), выраженное в процентах, называется выходом по току η:
-
η =
mопыт.
·100%.
mтеор.
Согласно второму закону Фарадея массы различных веществ, выделенных одним и тем же количеством электричества, пропорциональны их химическим эквивалентам:
-
m1
=
Э1
.
m2
Э2
Примеры решения задач
