
- •Содержание
- •Контрольные задачи
- •Тема 2. Эквиваленты
- •Контрольные задачи
- •Тема 3. Строение атома
- •Контрольные задачи
- •Тема 4. Химическая связь
- •Контрольные задачи
- •Тема 5. Энергетика химических процессов и химическое сродство (термохимические и некоторые термодинамические расчеты)
- •Контрольные задачи
- •Тема 6. Химическая кинетика и химическое равновесие
- •Контрольные задачи
- •Контрольные задачи
- •Тема 7. Растворы. Способы выражения концентрации растворов.
- •Контрольные задачи
- •Тема 8. Ионно-молекулярные реакции обмена.
- •Контрольные задачи
- •Тема 9. Гидролиз солей
- •Контрольные задачи
- •Тема 10. Окислительно-восстановительные реакции
- •Контрольные задачи:
- •Тема 11. Электрохимия
- •Пример 1. Сколько меди выделится на катоде, если через раствор медного купороса пропустить ток силой 2,68 а в течение 30 мин?
- •3600 Кл электричества выделит х г
- •3600 Кл электричества выделит y г
- •Контрольные задачи (Электродные потенциалы, гальванический элемент)
- •Контрольные задачи (Электролиз)
- •Тема 12. Коррозия металлов
- •Контрольные задачи
- •Тема 13. Комплексные соединения
- •Контрольные задачи
Тема 7. Растворы. Способы выражения концентрации растворов.
Раствор – многокомпонентная однородная равновесная система, состоящая из растворителя и растворенных веществ. Растворы делятся на твердые (сплавы), жидкие, газообразные. Наиболее важным видом растворов являются жидкие растворы, характеристикой которых является их концентрация. Концентрация выражает содержание растворенного вещества в определенном количестве раствора или растворителя.
Существуют следующие способы выражения концентрации растворов: массовая, молярная, моляльная, нормальная, титр и т.д.
I. Массовая концентрация (процентная концентрация по массе) выражается отношением массы растворенного вещества к массе раствора:
![]() ;
mраствора
= mвещества
+ mрастворителя
;
;
mраствора
= mвещества
+ mрастворителя
;
т.к.
mраствора
= Vраствора
· ρ
, следовательно
![]() .
.
II. Молярная концентрация определяется числом моль растворенного вещества в 1дм3 (1000 см 3) раствора:
![]() или
или
![]()
![]() ;
;
![]() [моль/
дм3]
[моль/
дм3]
III. Моляльная концентрация выражается числом моль растворенного вещества, содержащегося в 1 кг (1000 г) растворителя:
![]() или
или
![]()
IV. Нормальная концентрация выражается числом моль-эквивалентов растворенного вещества, содержащегося 1дм3 раствора.
![]() или
или
![]() ;
[моль-экв/дм3]
;
[моль-экв/дм3]
V. Титр определяется содержанием массы растворенного вещества в 1 см3 раствора:
![]() ;
[г/мл]
;
[г/мл]
При решении задач необходимо помнить закон эквивалентов (см. тему 2): объёмы реагирующих друг с другом растворов обратно пропорциональны их концентрации, выраженным в единицах нормальности.
Сн 1 V1 = Сн 1V1
Пример 1.Какой объем (см3) воды необходимо прибавить к 150 см3 30,0 % -ного раствора NaOH (ρ = 1,33 г/см3) для получения 12,0 %-ного раствора щелочи?
Решение: Масса исходного раствора равна mр-р = V . ρ = 150 . 1,33 = 199,5 г.
В
этом 30,0% -ном растворе NaOH
содержится
![]() .
По условию задачи эта масса NaOH
.
По условию задачи эта масса NaOH
![]() должна
содержаться в 12,0 % растворе NaOH.
должна
содержаться в 12,0 % растворе NaOH.
![]()
Следовательно
к исходному раствору необходимо прибавить
![]()
т.к. ρ H2O=1 г/см3, отсюда V H2O=299 см3.
Пример 2. Определить молярную, нормальную концентрации и титр 20,0 %-ного раствора серной кислоты (ρ=1,14 г/см3)
Решение:
Пусть объём раствора кислоты равен 1,00
дм3
(1000см3),
тогда масса серной кислоты в нем
![]() .
Вычисляем молярную концентрацию
раствора:
.
Вычисляем молярную концентрацию
раствора:
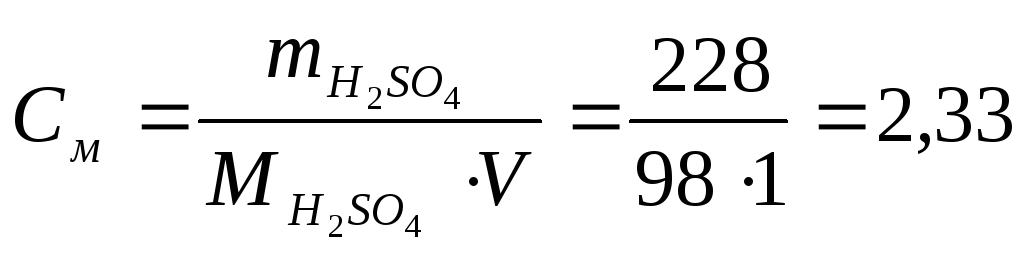 [моль/
дм3],
т.к. молярная масса эквивалента серной
кислоты равна
[моль/
дм3],
т.к. молярная масса эквивалента серной
кислоты равна
![]() г/моль-экв,
следовательно нормальная концентрация
раствора равна
г/моль-экв,
следовательно нормальная концентрация
раствора равна
![]() моль-экв/дм3.
Определяем титр раствора серной кислоты
моль-экв/дм3.
Определяем титр раствора серной кислоты
![]() г/мл.
г/мл.
Пример 3. Для нейтрализации 50 см3 раствора серной кислоты потребовалось добавить 23 см3 0,15Н раствора щелочи. Вычислите нормальную концентрацию раствора серной кислоты.
Решение:
По закону эквивалентов вещества
взаимодействуют в эквивалентных
количествах: Сн(кислоты)·Vр-ра(кислоты)=
Сн(щелочи)·Vр-ра(щелочи)
, следовательно
![]()
Контрольные задачи
-
Сколько граммов Na2SO3 потребуется для приготовления 2дм3 6%-ного раствора (ρ=1,075 г/см3)? Вычислите нормальную концентрацию этого раствора.
-
Сколько см3 0,01 Н раствора нитрата серебра потребуется для реакции обмена с 1 см3 10%-ного раствора HBr (ρ=1,073 г/см3)?
-
Какой объём воды надо прибавить к 100 см3 20%-ного раствора серной кислоты (ρ=1,14 г/см3), чтобы получить 5%-ный раствор?
-
Какой объём раствора кислоты нормальной концентрацией равной 0,2 моль-экв/дм3 требуется для нейтрализации раствора, содержащего 0,4 г NaOH в 50 см3?
-
Вычислите молярную и моляльную концентрацию и титр раствора ортофосфорной кислоты, содержащего 49 г H3PO4 в 100 г раствора (ρ=1,33 г/см3).
-
К 300 см3 18%-ного раствора Na2CO3 (ρ=1,19 г/см3) добавили 500 см3 6%-ного раствора H2SO4 (ρ=1,04 г/см3). Сколько см3 2,5 Н раствора соляной кислоты потребуется для взаимодействия с оставшейся содой?
-
Сколько граммов Na2SO4·10H2O надо растворить в 800 г воды, чтобы получить 10%-ный раствор Na2SO4?
-
Сколько граммов 5%-ного раствора AgNO3 потребуется для обменной реакции со 120 см3 0,3 М раствора хлорида алюминия?
-
Какой объём в см3 38%-ного раствора соляной кислоты
(ρ=1,19 г/см3), нужно взять для приготовления 1 литра 2Н раствора?
-
Сколько миллилитров 4,7М раствора NaOH требуется для взаимодействия с 7,6 л H2S (при 15оС и 96 кПа), если известно, что образуется средняя соль?
-
В какой массе воды нужно растворить 25 граммов медного купороса (CuSO4·5H2O), чтобы получить 8%-ный раствор CuSO4?
-
Смешали 1,2 дм3 3.5%-ного раствора КОН (ρ=1,033 г/см3) и 0,8 дм3 2,5%-ного раствора КОН (ρ=1,027 г/см3). Вычислить нормальность полученного раствора щелочи.
-
Какой объём 15%-ного раствора H2SO4 (ρ=1,10 г/см3) потребуется для полного растворения 2,7 г алюминия?
-
Раствор нитрата калия содержит 192,6 г соли в 1 дм3 (ρ=1,14 г/см3). Рассчитайте массовую концентрацию, молярную концентрацию, моляльность и титр раствора.
-
Сколько граммов карбоната кальция выпадает в осадок, если к 400 см3 0,5Н раствора хлорида кальция прибавить избыток раствора соды?
16.К какому объёму 0,2Н раствору аммиака следует добавить 20 см3
35%-ного раствора аммиака (ρ=0,88 г/см3) для получения 0,5Н раствора?
17. В каком объёме 25%-ного раствора уксусной кислоты (ρ=1,035 г/см3) содержится 1 моль этой кислоты? Рассчитайте титр и нормальную концентрацию этого раствора.
18. Какой объём 0,5Н раствора серной кислоты следует добавить к 1 дм3
0,11Н раствора той же кислоты для получения 0,1М раствора?
19. Смешали 100 см3 20%-ного раствора азотной кислоты (ρ=1,12 г/см3)
и 500 см3 воды. Определите процентную концентрацию азотной
кислоты в полученном растворе.
20. Вычислите процентную концентрацию гидроксида натрия в 9,28Н
раствора NaOH если плотность раствора равна 1,310 г/см3.
21.Сколько граммов AlCl3·6H2O потребуется для приготовления 300 см3 4%-ного раствора AlCl3 (ρ =1,03 г/см3)? Вычислить молярную концентрацию этого раствора.
22.Сколько см3 0,1Н раствора хлорида бария потребуется для реакции обмена с 100 см3 15%-ного раствора H2SO4 (ρ=1,10 г/см3)?
23.Какой объём воды необходимо прибавить к 10 см3 36,5%-ного раствора соляной кислоты (ρ=1,18 г/см3), чтобы получить 0,1Н раствор соляной кислоты (ρ=1,002г/см3)?
24.Какой объём 0,2Н раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 100 см3 0,5Н раствора хлорида железа (III)?
25.Вычислить массу воды, необходимую для приготовления раствора хлорида натрия, содержащего 1,50 моль NaCl на 100 г воды, если имеется 10 г NaCl?
