
- •Аналитическая химия: предмет, цель и задачи, основные понятия, принципы
- •Качественный анализ неорганических соединений качественный анализ катионов
- •Классификация катионов по аммиачно-фосфатному методу
- •Классификация катионов по кислотно-основному методу
- •Катионы і -ой аналитической группы
- •Реакции катиона калия
- •Реакции катиона аммония
- •Действие некоторых реагентов на катионы і аналитической группы
- •Катионы іi -ой аналитической группы
- •Действие некоторых реагентов на катионы II аналитической группы
- •Аналитические реакции катионов III - VI аналитических групп. Групповые реагенты, условия их применения. Систематический ход анализа катионов Катионы III аналитической группы
- •Действие некоторых реагентов на катионы III аналитической группы
- •Действие некоторых реагентов на катионы IV аналитической группы
- •Этапы исследования
- •Действие некоторых реагентов на катионы V аналитической группы
- •Аналитическая химия - лекция №5 Анионы. Классификация. Характерные реакции анионов. Особые случаи и систематический ход анализа анионов при совместном присутствии.
- •I аг анионов: s2o2ˉ3 , so2ˉ4 , so2ˉ3 , CrO2ˉ4 , Cr2 o2ˉ7 с2o2ˉ4 , co2ˉ3 , f ˉ , po3ˉ4 , AsO3ˉ4 , SiO2ˉ3 и др.
- •II аг анионов: Cl ˉ , Brˉ , I ˉ , s2ˉ
- •III аг анионов: no2ˉ , no3ˉ , сн3сооˉ
- •Аналитическая химия - лекция №6 Количественный анализ. Классификация методов. Гравиметрический анализ. Осажденная и гравиметрическая формы осадков. Расчеты в гравиметрическом анализе.
- •N этапа Содержание этапа анализа
- •Механизм образования осадка и условия осаждения
- •Условия осаждения кристаллических и аморфных осадков
- •Осажденная и гравиметрическая формы. Требования к ним.
- •Вычисление результатов в гравиметрическом методе анализа
- •Выбор массы навески в гравиметрии
- •Погрешности гравиметрии
- •Методические погрешности гравиметрии
- •Аналитическая химия - лекция №7 кислотно-основное титрование. Сущность метода и его возможности. Интервал перехода окраски кислотно-основных индикаторов. Кривые титрования.
- •Индикаторы в методе кислотно-основного титрования
- •Бесцветный малиновый
- •Титрование слабой кислоты сильным основанием
- •Аналитическая химия - лекция №8
- •Классификация растворителей
- •Классификация по физическим свойствам
- •Классификация по химическим свойствам
- •Кислота сопряженное основание
- •По характеру влияния на относительную силу кислот, оснований и солей растворители также делят на дифференцирующие и нивелирующие.
- •Применение метода в анализе
Этапы исследования
1. Определение Fe(II), Fe(III) ионов в отдельной пробе с реагентами K3[Fe(CN)6] и K4[Fe(CN)6] соответственно:
Fe2+ K3[Fe(CN)6] Fe3[Fe(CN)6]2↓
Fe3+ K4[Fe(CN)6] Fe4[Fe(CN)6]3↓
2. Отделенение Sb(III) и Sb(V) ионов действием HNO3 и Н2О2:
Sb(III), Sb(V) HNO3; H2O2 HSbO3↓
3. Растворение осадка № 2 в растворе HCl:
HSbO3↓ HCl [SbCl6]ˉ
4. Определение Sb(V) катиона в растворе № 3 действием цинка на никелевой пластине:
[SbCl6]ˉ Zn Sb↓
5. Осаждение катионов V аналитической группы из центрифугата №2 действием концентрированного раствора NH3 * H2O:
Mg2+ NH3 * H2O Mg(OH)2↓
Mn2+ NH3 * H2O Mn(OH)2↓
Fe3+ NH3 * H2O Fe(OH)3↓
Bi3+ NH3 * H2O BiONO3↓
6. Отделение Mg2+ катионов действием на осадок №5 насыщенным раствором NH4Cl и 3% раствором Н2О2:
Mg(OH)2↓ NH4Cl Mg2+
7. Определение Mg2+ катиона в центрифугате № 6 действием Na2HPO4 в присутствии аммиачного буферного раствора:
Mg2+ Na2HPO4, NH3 *H2O+NH4Cl MgNH4PO4↓
8. Отделение Bi3+ и Fe3+ катионов действием раствора HNO3 на осадок № 6:
BiONO3↓ HNO3 Bi3+
Fe(OH)3↓ HNO3 Fe3+
9. Растворение осадка MnO2 * nH2O, полученного по п. 8, действием раствора HNO3 в присутствии Н2О2:
MnO2*nH2O↓ HNO3; H2O2 Mn2+
10. Определение Mn2+ катиона действием на раствор № 9 (NH4)S2O8:
Mn2+ (NH4)S2O8; HNO3; AgNO3 MnOˉ4
11. Определение Bi3+ катиона в центрифугате №8 действием свежеприготовленного [Sn(OH)6]4ˉ :
Bi3+ [Sn(OH)6]4ˉ Bi↓
Действие некоторых реагентов на катионы VI аналитической группы
Cu2+ , Hg2+ , Co2+ , Ni2+
|
Реагент |
Катионы |
|||
|
Cu2+ |
Hg2+ |
Co2+ |
Ni2+ |
|
|
NaOH
или
KOH |
Cu(OH)2 голубой осадок |
Hg(OH)2 белый осадок, разлагается до HgO. Желтый осадок. |
Co(OH)Cl синий осадок |
Ni(OH)2 зеленый осадок |
|
Осадки растворяются в кислотах и в избытке раствора аммиака |
||||
|
Основные соли и амидные соединения |
||||
|
NH3 * H2O без избытка |
Cu(OH)2SO4↓ и др. зеленый |
NH2HgCl↓ белый |
Co(OH)Cl↓ и др. синий |
(NiOH)2SO4↓ и др. зеленый |
|
Осадки растворяются в избытке реактива |
||||
|
NH3 * H2O в избытке |
[Cu(NH3)4]2+ - синий |
[Hg(NH3)4]2+ бесцветный |
[Co(NH3)6]2+ оранжево-коричневый |
[Ni(NH3)6]2+ сиреневый |
|
Разрушаются кислотами |
||||
|
Na2S2O3 |
Cu2S↓ черный + S↓ растворяется в HNO3 |
HgS черный, растворяется в бромной воде |
- |
- |
|
KI |
CuI белый + +I2 бурый |
HgI2 оранжево-красный, растворяется в избытке реагента |
- |
- |
|
(NH4)2NCS |
Cu(NCS)2↓ черный, который постепенно превращается в белый CuNCS↓ |
Hg(NCS)2↓ белый, растворимый в избытке реагента с образованием [Hg(NCS)4]2ˉ бесцветный |
(NH4)2[Co(NCS)4] синий цвет |
- |
|
SnCl2 |
Cu↓ |
Hg↓ |
- |
- |
Схема систематического хода анализа катионов VI аналитической группы Cu2+, Hg2+, Co2+, Ni2+
Этапы исследования
1. Взаимодействие катионов VI аналитической группы с групповым реагентом (избыток NH3*H2O):
Cu2+ изб.NH3*H2O [Cu(NH3O)4]2+
Hg2+ изб.NH3*H2O [Hg(NH3O)4]2+
Co2+ изб.NH3*H2O [Co(NH3O)6]2+
Ni2+ изб.NH3*H2O [Ni(NH3O)6]2+
2. Разрушение аммиакатов действием 2 моль/дм3 H2SO4
3. Отделение Cu2+ и Hg2+ ионов от других катионов VI
аналитической группы действием Na2S2O3 на раствор №2:
Cu2+ Na2S2O3;Δ Cu2S↓ + S↓
Hg2+ Na2S2O3;Δ HgS↓
4. Отделение Cu2S от HgS при частичном растворении осадка №3 в разб. HNO3 при нагревании:
Cu2S↓ HNO3;Δ Cu2+
5. Определение Cu2+ ионов в растворе №4 действием
концентрированного NH3 * H2O:
Cu2+ NH3*H2O [Cu(NH3)4]2+
6. Растворение осадка № 4 действием бромной воды в присутствии HCl или в «царской водке»:
HgS↓ Br;HCl [HgCl2] + S↓
HgS↓ конц.HNO3,конц. HCl [HgCl2]
7. Отделение [HgCl2] от S↓ центрифугированием.
8. Определение Hg2+ ионов в центрифугате №7 действием раствора SnCl2:
[HgCl2] SnCl2 Hg↓
9. Определение Co2+ ионов в центрифугате №3 действием раствора NH4NCS в присутствии амилового спирта:
Co2+ NH4NCS (NH4)2[Co(NCS)4]
C5H11OH
10. Определение Ni2+ ионов в центрифугате №3 действием реактива Чугаева (диметилглиоксима):
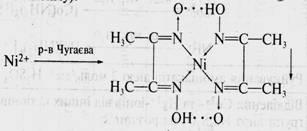
Схема систематического хода анализа катионов III аналитической группы Ba2+, Sr2+, Ca2+
Этапы исследования
1. Осаждение катионов III аналитической группы действием 1 моль/дм3 H2SO4 в присутствии C2H5OH при нагревании:
Ba2+ H2SO4, Δ BaSO4↓
Sr2+ H2SO4, Δ SrSO4↓
Ca2+ H2SO4, C2H5OH, Δ CaSO4↓
Промывание осадка водой, которая содержит H2SO4
2. Переосаждение осадков сульфатов катионов III аналитической группы в осадки их карбонатов действием насыщенного раствора Na2CO3 при кипячении:
BaSO4↓ Na2CO3, Δ BaCO3↓
SrSO4↓ Na2CO3, Δ SrCO3↓
CaSO4↓ Na2CO3, Δ CaCO3↓
Промывание осадка водой
3. Растворение осадка №2 действием раствора СН3СООН:
BaCO3↓ СН3СООН Ba2+
SrCO3↓ СН3СООН Sr2+
CaCO3↓ СН3СООН Ca2+
4. Выявление Ba2+ катиона в отдельной порции раствора №3 действием раствора K2CrO4:
Ba2+ K2CrO4 BaCrO4↓
Если присутствие Ba2+ катиона доказано, то его извлекают из раствора №3 действием раствора K2CrO4
5. Выявление Sr2+ катиона в отдельной порции центрифугата №4 действием насыщенного раствора кальция сульфата (гипсовая вода):
Sr2+ насыщ. раствор CaSO4 SrSO4↓
гипсовая вода
6. Удаление Sr2+ катионов из центрифугата №4 действием конц. раствора (NH4)2SO4:
Sr2+ конц. (NH4)2SO4 SrSO4↓
Ca2+ конц. (NH4)2SO4 [Ca(SO4)2]2ˉ
7. Выявление Ca2+ катиона в центрифугате № 6 действием раствора (NH4)2С2O4 :
Ca2+ (NH4)2С2O4 СаС2О4↓
СН3СООН
Схема систематического хода анализа катионов IV аналитической группы
Al3+, Zn2+, Cr3+, Sn2+, Sn (IV), As(III), As (V)
Этапы исследования
1. Выявление As (III) , As (V) ионов в отдельной пробе действием металлического цинка в среде HCl:
As(III), (V) Zn, НCl AsH3↑
Бумага, пропитанная AgNO3 AsH3↑ Ag↓ (черный)
(реакция Гутцайта)
Бумага, пропитанная [HgCl2] AsH3↑ AsH2(HgCl)↓
(Реакция Зангер-Блека) AsH(HgCl)2↓
As(HgCl)3↓
As2Hg3↓
(желто-коричневый)
2. Действие избытка 6 моль/дм3 NaOH в присутствии Н2О2 на катионы IV аналитической группы при нагревании:
Al3+ NaOH Al(OH)3↓избыток NaOH[Al(OH)6]3ˉ
Cr3+ NaOH Cr(OH)3↓ избыток NaOH,H2O2,Δ CrO2ˉ4
Sn2+ NaOH Sn(OH)2↓ избыток NaOH, H2O2, Δ[Sn(OH)6]2ˉ
Sn(IV) NaOH Sn(OH)4↓ избыток NaOH [Sn(OH)6]2ˉ
As(III) NaOH AsO3ˉ3 H2O2, Δ AsO3ˉ4
As(V) NaOH AsO3ˉ4 H2O2, Δ AsO3ˉ4
3. Отделение гидроксоанионов [Al(OH)6]3ˉ; [Sn(OH)6]2ˉ из раствора №2 действием кристаллического NH4Cl при нагревании:
[Al(OH)6]3ˉ NH4Cl,Δ Al(OH)3↓
[Sn(OH)6]2ˉ NH4Cl,Δ Sn(OH)4↓
4. Растворение осадка №3 действием 2 моль/дм3 HCl:
Al(OH)3↓ HCl Al3+
Sn(OH)4↓ HCl [SnCl6]2ˉ
5. Выявление Al3+ катиона действием на раствор №4 ализарина или натрия ацетата:
Al3+ ализарин, NaOH
Al3+ CH3COONa Al(OH)2CH3COO↓
6. Выявление Sn(IV) действием раствора соли меркурий (II) – катионов на прокипяченный с железными в среде HCl раствор №4:
[SnCl6]2ˉ Fe, HCl; Δ Sn2+ HgCl2 Hg↓
7. Выявление Zn2+ - катиона в центрифугате №3 действием раствора дитизона, или K4[Fe(CN)6] :
