
- •Аналитическая химия: предмет, цель и задачи, основные понятия, принципы
- •Качественный анализ неорганических соединений качественный анализ катионов
- •Классификация катионов по аммиачно-фосфатному методу
- •Классификация катионов по кислотно-основному методу
- •Катионы і -ой аналитической группы
- •Реакции катиона калия
- •Реакции катиона аммония
- •Действие некоторых реагентов на катионы і аналитической группы
- •Катионы іi -ой аналитической группы
- •Действие некоторых реагентов на катионы II аналитической группы
- •Аналитические реакции катионов III - VI аналитических групп. Групповые реагенты, условия их применения. Систематический ход анализа катионов Катионы III аналитической группы
- •Действие некоторых реагентов на катионы III аналитической группы
- •Действие некоторых реагентов на катионы IV аналитической группы
- •Этапы исследования
- •Действие некоторых реагентов на катионы V аналитической группы
- •Аналитическая химия - лекция №5 Анионы. Классификация. Характерные реакции анионов. Особые случаи и систематический ход анализа анионов при совместном присутствии.
- •I аг анионов: s2o2ˉ3 , so2ˉ4 , so2ˉ3 , CrO2ˉ4 , Cr2 o2ˉ7 с2o2ˉ4 , co2ˉ3 , f ˉ , po3ˉ4 , AsO3ˉ4 , SiO2ˉ3 и др.
- •II аг анионов: Cl ˉ , Brˉ , I ˉ , s2ˉ
- •III аг анионов: no2ˉ , no3ˉ , сн3сооˉ
- •Аналитическая химия - лекция №6 Количественный анализ. Классификация методов. Гравиметрический анализ. Осажденная и гравиметрическая формы осадков. Расчеты в гравиметрическом анализе.
- •N этапа Содержание этапа анализа
- •Механизм образования осадка и условия осаждения
- •Условия осаждения кристаллических и аморфных осадков
- •Осажденная и гравиметрическая формы. Требования к ним.
- •Вычисление результатов в гравиметрическом методе анализа
- •Выбор массы навески в гравиметрии
- •Погрешности гравиметрии
- •Методические погрешности гравиметрии
- •Аналитическая химия - лекция №7 кислотно-основное титрование. Сущность метода и его возможности. Интервал перехода окраски кислотно-основных индикаторов. Кривые титрования.
- •Индикаторы в методе кислотно-основного титрования
- •Бесцветный малиновый
- •Титрование слабой кислоты сильным основанием
- •Аналитическая химия - лекция №8
- •Классификация растворителей
- •Классификация по физическим свойствам
- •Классификация по химическим свойствам
- •Кислота сопряженное основание
- •По характеру влияния на относительную силу кислот, оснований и солей растворители также делят на дифференцирующие и нивелирующие.
- •Применение метода в анализе
Аналитическая химия - лекция №8
НЕВОДНОЕ КИСЛОТНО - ОСНОВНОЕ ТИТРОВАНИЕ. ВОЗМОЖНОСТИ МЕТОДА. ПРИМЕНЕНИЕ В АНАЛИЗЕ.
Применение неводных растворителей позволяет резко расширить число объектов, которые можно определить методом кислотно-основного титрования. Неводное кислотно-основное титрование используют, если необходимо:
· изменить растворимость определяемых соединений или проду-ктов реакций;
· усилить или ослабить диссоциацию анализируемого компонента;
· изменить соотношение констант диссоциации компонентов смеси;
· изменить константу титрования анализируемого вещества.
Неводные растворители изменяют кислотно-основные свойства соединений. Вещество, растворенное в одном растворителе, проявляет кислотные свойства, а в другом - свойства основания либо амфолита.
Классификация растворителей
Для оптимального выбора неводного растворителя удобно их сгруппировать по сходным свойствам (физическим или химичес-ким).
Классификация по физическим свойствам
Наиболее важной физической константой, используемой для классификации растворителей, является диэлектрическая прони-цаемость ε, поскольку именно с этой величиной связана диссоци-ирующая способность среды.
Согласно этой классификации растворители делятся на три группы:
1) растворители с высоким значением диэлектрической проницаемости (ε ≥ 40) - в этих растворителях электролиты практически полностью диссоциированы в разбавленных растворах;
2) растворители со средним значением диэлектрической проницаемости (15 < ε < 40) - в этих растворителях в разбавленных растворах электролиты находятся преимущественно в виде ассоциатов;
3) растворители с низким значением диэлектрической nроницаемости (ε < 10...15) - в этих растворителях электролиты находятся преимущественно в виде ассоциатов или же недиссоци-ированных молекул.
Растворители с высокой диэлектрической проницаемостью относят к полярным растворителям в противоположность неполяр-ным, обладающим низкой диэлектрической проницаемостью. Мерой полярности принято считать величину дипольного момента молекулы.
Если молекулы растворителя обладают постоянным диполь-ным моментом, растворитель относят к диполярным раствори-телям; если же дипольный момент молекулы отсутствует или мал, растворитель называют аполярным.
Классификация по химическим свойствам
Существует несколько классификаций растворителей по их химическим свойствам:
· по классам химических соединений (или по функциональным группам);
· кислотно-основным свойствам;
· специфическому взаимодействию с растворенным веществом
Рассмотрим кислотно-основную классификацию растворителей, базирующуюся на теории Бренстеда, согласно которой вещество - донор протона, является кислотой, а вещество - акцептор протона - основанием:
НА ↔ Н + + А-
Кислота сопряженное основание
Поскольку протон изолированно существовать не может вследствие малых размеров и высокого поляризующего действия, кислотно-основное равновесие существует только в присутствии основания, обладающего большим сродством к протону, чем сопряженное основание А-. Вследствие этого сила кислот и оснований зависит от среды, в которой они растворены, так большинство растворителей обладает кислыми или основными свойствами.
В основном растворителе с растворенной в нем кислотой равновесие:
НА + LH ↔ LH2+ + А-
кислота растворитель- сопряженная сопряженное
основание кислота основание
В кислотном растворителе устанавливается равновесие:
А- + LH ↔ НА + L-
основание растворитель- сопряженная сопряженное
кислота кислота основание
Например, уксусная кислота в воде является донором протонов, то есть кислотой:
СН3СООН + Н2О ↔ СН3СОО - + Н3О +
кислота растворитель- сопряженное сопряженная
основание основание кислота
Она же при растворении в серной кислоте является акцептором протонов, то есть основанием:
СН3СООН + H2SO4 ↔ CH3COOH2+ + HSO4-
основание сопряженная сопряженная сопряженное
кислота кислота основание
Собственную ионизацию растворителя описывает уравнение:
2LH ↔ LH2+ + L-
растворитель сопряженная сопряженное
кислота основание
Это равновесие характеризуется константой автопротолиза растворителя Ks:
Ks = [LH2+] ∙ [L-]
[LH]2
Так как [LH] при большом избытке растворителя - величина практически постоянная, то Кs * [LH]2 - тоже постоянна. Эту постоянную обозначают Кi и называют ионным произведением среды: Ki = [LH2+] ∙ [L-]
Таблица 1
Ионное произведение среды pKi некоторых
растворителей при температуре 25 ˚С
|
Растворитель |
рКі |
|
H2O |
14,00 |
|
H2SO4 |
3,62 |
|
CH3COOH |
14,40 |
|
CH3OH |
16,70 |
|
НСООН |
6,10 |
|
ДМФА |
25,30 |
|
CH3NO2 |
24,00 |
|
NH3* |
32,20 |
*При температуре –50 ˚С.
Значение Кі растворителя характеризует собственную ионизацию растворителя. В табл.1 приведены значения рКі = - lg Кі некоторых растворителей при температуре 25˚С.
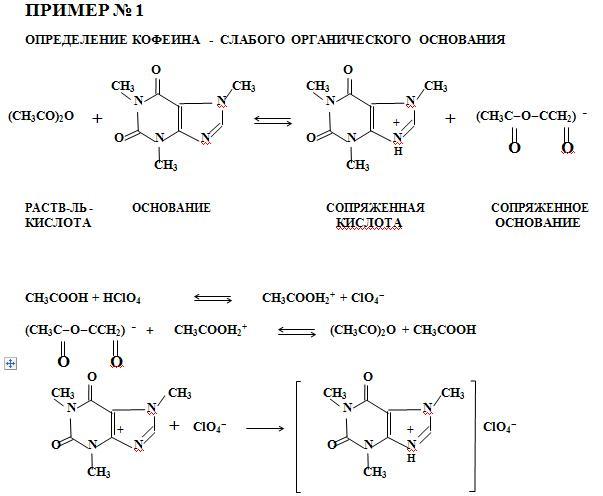
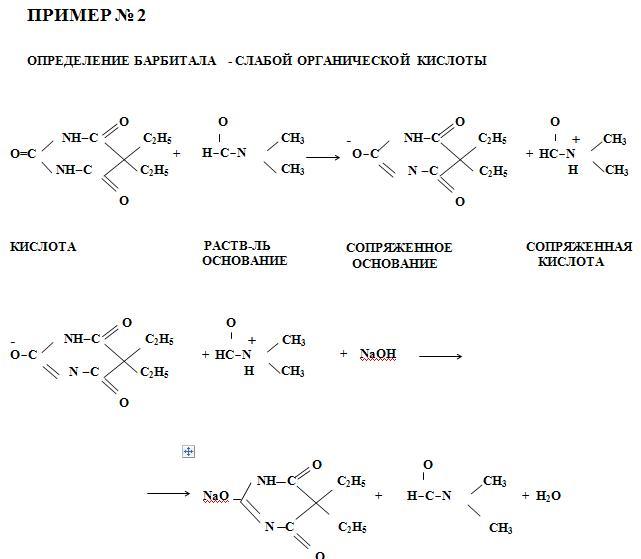
Растворители делятся на апротонные и протолитические. Aпротонные растворители практически не способны к иониза-ции. К этой группе принадлежат гексан, хлороформ, диоксан, бензол, тетрагидрофуран и др. Протолитические растворители содержат в составе молекулы атомы водорода, способные к отще-плению в виде ионов.
Например: 2H2O ↔ H3O + + OH –
2CH3COOH ↔ CH3COOH2 + + CH3COO -
2NH3 ↔ NH4 + + NH2 -
Протолитические растворители, в свою очередь, подразде-ляют на кислотные (протогенные), основные (протофильные) и амфипротные (амфотерные). Кислотные (протогенные) растворители - соединения кислотного характера, являющиеся донорами протонов. К ним относят безводные кислоты: серную, уксусную, муравьиную, жидкий хлороводород; уксусный ангидрид, фенол и др.
Основные (протофильные) растворители - соединения основного характера, являющиеся акцепторами протонов. К этой группе растворителей принадлежат: жидкий аммиак, пиридин, диметил-формамид, формамид, этилендиамин.
Амфипротные (амфотерные) растворители обладают как кислотными, так и основными свойствами. Эта группа раствори-телей представлена спиртами (метанол, этанол и др.), кетонами (метилэтилкетон, ацетон и др.).
