
- •Аналитическая химия: предмет, цель и задачи, основные понятия, принципы
- •Качественный анализ неорганических соединений качественный анализ катионов
- •Классификация катионов по аммиачно-фосфатному методу
- •Классификация катионов по кислотно-основному методу
- •Катионы і -ой аналитической группы
- •Реакции катиона калия
- •Реакции катиона аммония
- •Действие некоторых реагентов на катионы і аналитической группы
- •Катионы іi -ой аналитической группы
- •Действие некоторых реагентов на катионы II аналитической группы
- •Аналитические реакции катионов III - VI аналитических групп. Групповые реагенты, условия их применения. Систематический ход анализа катионов Катионы III аналитической группы
- •Действие некоторых реагентов на катионы III аналитической группы
- •Действие некоторых реагентов на катионы IV аналитической группы
- •Этапы исследования
- •Действие некоторых реагентов на катионы V аналитической группы
- •Аналитическая химия - лекция №5 Анионы. Классификация. Характерные реакции анионов. Особые случаи и систематический ход анализа анионов при совместном присутствии.
- •I аг анионов: s2o2ˉ3 , so2ˉ4 , so2ˉ3 , CrO2ˉ4 , Cr2 o2ˉ7 с2o2ˉ4 , co2ˉ3 , f ˉ , po3ˉ4 , AsO3ˉ4 , SiO2ˉ3 и др.
- •II аг анионов: Cl ˉ , Brˉ , I ˉ , s2ˉ
- •III аг анионов: no2ˉ , no3ˉ , сн3сооˉ
- •Аналитическая химия - лекция №6 Количественный анализ. Классификация методов. Гравиметрический анализ. Осажденная и гравиметрическая формы осадков. Расчеты в гравиметрическом анализе.
- •N этапа Содержание этапа анализа
- •Механизм образования осадка и условия осаждения
- •Условия осаждения кристаллических и аморфных осадков
- •Осажденная и гравиметрическая формы. Требования к ним.
- •Вычисление результатов в гравиметрическом методе анализа
- •Выбор массы навески в гравиметрии
- •Погрешности гравиметрии
- •Методические погрешности гравиметрии
- •Аналитическая химия - лекция №7 кислотно-основное титрование. Сущность метода и его возможности. Интервал перехода окраски кислотно-основных индикаторов. Кривые титрования.
- •Индикаторы в методе кислотно-основного титрования
- •Бесцветный малиновый
- •Титрование слабой кислоты сильным основанием
- •Аналитическая химия - лекция №8
- •Классификация растворителей
- •Классификация по физическим свойствам
- •Классификация по химическим свойствам
- •Кислота сопряженное основание
- •По характеру влияния на относительную силу кислот, оснований и солей растворители также делят на дифференцирующие и нивелирующие.
- •Применение метода в анализе
Индикаторы в методе кислотно-основного титрования
В методах кислотно-основного титрования для определения конечной точки титрования используют кислотно-основные индикаторы. Кислотно-основные индикаторы - это органические вещества, способные видимо и обратимо изменять свою окраску в растворе при изменении рН среды. Существуют различные теории индикаторов, каждая из которых по-своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов. В связи с тем, что кислотно-основные индикаторы представляют собой слабые кислоты или слабые основания, любой индикатор диссоциирует в растворе согласно уравнению:
HInd ↔ Н+ + Ind-
Бесцветный малиновый
Окраска раствора, в котором индикатор находится в молекулярной форме (HInd), отличается от окраски раствора, в котором индикатор находится в ионной форме (Ind -). Так, моле-кулы фенолфталеина HInd бесцветны, а его анионы Ind - окрашены в малиновый цвет. Достаточно к раствору, содержащему фенолфталеин, прибавить 1-2 капли щелочи, как введенные ОН--ионы станут связывать катионы Н+ с образованием слабого электролита - молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов Ind- вызовет окрашивание раствора в малиновый цвет.
Переход одной окраски, присущей молекулярной форме кислотно-основного индикатора, в другую, свойственную его ионной форме, происходит под влиянием Н+ или ОН--ионов, то есть зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, дополняется хромо-форной теорией индикаторов, согласно которой изменение окраски индикаторов связано с изменением структуры их молекул, внутримолекулярной перегруппировкой, вызываемой действием Н+ или ОН--ионов. По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-хиноидной таутомерией. При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индикаторов окраска изменяется в связи с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие.
Типичным одноцветным индикатором является фенол-фталеин. При рН < 8 его молекулы не содержат хиноидной груп-пировки и поэтому бесцветны. Однако при добавлении раствора щелочи к раствору фенолфталеина (рН = 8) происходит перегруппировка атомов в молекуле с образованием хиноидной группировки, которая обусловливает появление малиновой окраски раствора:
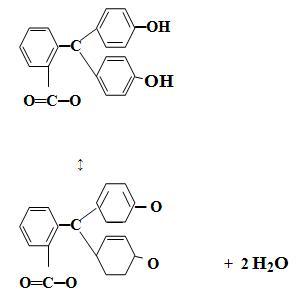
Дальнейшее увеличение рН до 13-14 вызывает другую пере-группировку, в результате чего получается трехзамещенная соль, лишённая хиноидной группировки и поэтому бесцветная:
Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи, например, натрия гидроксида. Типичным двухцветным индикатором является метиловый оранжевый:
(CH3)2N N═N SO3Na
При рН = 3,2...4,3 он оранжевый, при рН ≤ 3,1 приобретает красную, а при рН ≥ 4,4 - желтую окраску. Это объясняют присоединением ионов водорода кислоты к атому азота азогруппы индикатора, вследствие чего происходит смещение электронов по всей системе, сопровождающееся образованием хиноидной структуры, которая обусловливает появление красной окраски раствора. Таким образом, при действии кислот наблюдают переход желтой окраски индикатора в красную, а при действии щелочей - обратное превращение:
(CH3)2N ═ ═N―N
ОН ↔
[(CH3)2N N═N SO3 ] + Н2 О
Цветность органических соединений, согласно хромофорной теории, обусловливается не только хиноидной структурой молекул, но и присутствием в них других хромофорных группировок (-N=N-, -N02 , -NO, =С=С=, =С=О). При введении в молекулы органических веществ, содержащих хромофорные группы, ряда других групп - ауксохромов (-ОН, -Nh4 , -NHR, -NHR) происходит углубление цвета окрашенного вещества.
Ионно-хромофорная теория индикаторов. Согласно дополняющим друг друга ионной и хромофорной теориям, в раст-ворах кислотно-основных индикаторов одновременно сосущест-вуют равновесия, обусловливаемые диссоциацией молекул, и равновесия, связанные с внутримолекулярными перегруппировками (ионно-хромофорная теория). Для кислотно-основных индика-торов наиболее характерными факторами, вызывающими измене-ние окраски, являются изменение соотношения количеств молеку-лярной и ионной форм индикатора, происходящее под влиянием кислот и щелочей, и появление или исчезновение хромофорных групп или же превращение одних хромофорных групп в другие.
Способность молекул различных индикаторов диссоциировать в нейтральной среде характеризуют константами диссоциации. Например, у метилового оранжевого Кa≈ 10 -4, у лакмуса Кa ≈ 10 -8, а у фенолфталеина Кa ≈ 10-9. Следовательно, фенолфталеин является наиболее слабой органической кислотой из этих индикаторов.
Известно, что прибавление к любому раствору любой кислоты или щелочи влечет за собой изменение концентрации ионов Н+ в нем, а следовательно, и величины рН. Перемена окраски у индика-торов также связана с изменением рН раствора. Однако каждый индикатор изменяет окраску только в определенном, характерном для него интервале значений рН. Объясняется это тем, что окраска индикатора зависит от соотношения концентраций его диссоци-ированной и недиссоциированной форм, то есть от отношения:
KHInd=[H+][Ind-] / [HInd]
[Ind-] / [HInd] = KHInd / [H+] или [HInd] / [Ind-] = [H+] / KHInd .
Когда KHInd = [Н+], то [Ind-] / [HInd] = 1.
Если КHInd / [Н+] > 1, то в растворе превалирует диссоцииро-ванная форма индикатора, а если КHInd / [Н+] < 1, то превалирует недиссоциированная форма.
При одной и той же концентрации ионов водорода отношение КHInd / [Н+] будет тем больше, чем больше КHInd .
Для фенолфталеина КHInd = [Н+] [Ind-] / [HInd] ≈ 10-9.
При рН = 7 [Н+] = 10 -7, а [HInd] / [Ind-] = 10-7 / 10-9 , то есть при рН = 7 на каждые 100 бесцветных молекул фенолфталеина приходится лишь 1 окрашенный ион, следовательно, раствор - бесцветный. Если к раствору фенолфталеина прибавить щелочь и довести рН раствора до 8, то соотношение [HInd] / [Ind -] = 10 -8 /10-9 (уменьшится в 10 раз), и раствор станет бледно розовым. А при рН=9 соотношение [HInd] / [Ind-] = 10-9 / 10-9 = 1, то есть в растворе присутствуют равные количества бесцветных молекул индикатора и окрашенных в красный цвет ионов и раствор приобретает розовую окраску.
Таким образом, переходная окраска индикатора появляется при рН среды, равном рКHInd, но так как изменение цвета индикатора происходит постепенно, цвет недиссоциированных молекул индикатора начинает маскироваться цветом ионов задолго до достижения соотношения [HInd] / [Ind-] = 1.
Следовательно, цвет водного раствора индикатора определяется соотношением концентрации его молекулярной и ионной форм, отличающихся различной окраской, и зависит от [Н+]. Величину рН, до которой титруют раствор с данным индикатором, называют показателем титрования этого индикатора рТ.
Важнейшие индикаторы имеют следующие области перехода и показатели титрования:
Показатель титрования рТ Область перехода рН
Метиловый оранжевый…4,0…………… 3,1 - 4,4
Метиловый красный….. 5,5…………… 4,4 - 6,2
Лакмус……………… ……7,0…………… 5,0 - 8,0
Фенолфталеин……………9,0………….. 8,0 - 10,0
КРИВЫЕ ТИТРОВАНИЯ. ВЫБОР ИНДИКАТОРА
Кривая кислотно-основного титрования - это графическое изображение изменения рН раствора в ходе титрования.
Титрование сильной кислоты сильным основанием.
Допустим, что для титрования взяли 20 см3 раствора 0,1 моль/дм3 HCl, а в качестве титранта использовали раствор 0,1 моль/дм3 NaOH. Поскольку каждая молекула НСl дает при диссоциации один ион Н+, общая концентрация водородных ионов в 1 дм3 исходной 0,1 моль/дм3 кислоты составляет 0,1 (или 10 -1) моль-ион. Следовательно, рН этого раствора равен 1.
Когда 90 % соляной кислоты будет оттитровано, ионов Н+ останется 10 % от первоначального количества, то есть 0,01 (или 10-2) моль-ион в 1 дм3, а рН раствора станет равен 2. При нейтрализации 99,0 % соляной кислоты рН = 3; при нейтрализации 99,9 % кислоты рН = 4 и т. д. В момент полной нейтрализации соляной кислоты титруемый раствор содержит только натрия хлорид и имеет рН = 7. Прибавление избытка натрия гидроксида ведет к увеличению рН раствора, как это показано в табл. 3.1.
Результаты этих вычислений изображают графически. На оси абс-цисс откладывают избыток кислоты или щелочи в разные моменты титрования, а на оси ординат - соответствующие значения рН раствора. Получающийся график называют кривой титрования.
Ход этой кривой свидетельствует, что в конце титрования сильной кислоты сильным основанием происходит резкий скачок в измене-нии рН раствора. К моменту нейтрализации 99,9 % кислоты рН постепенно растет от 1 до 4, то есть всего на три единицы, а при переходе от 0,1 % остатка НСl к 0,1 % избытку NaOH рН раствора резко увеличивается с 4 до 10. Это означает, что добавление одной капли щелочи в конце титрования понижает концентрацию ионов Н+ с 10 -4 до 10 -10 моль в литре или в миллион раз.
Изменение рН раствора при титровании сильной кислоты сильным основанием
|
Прибавлено NaOH |
Осталось HCl |
[H+], моль/дм3 |
рН |
||||||||||
|
% |
мл |
% |
моль/дм3 |
||||||||||
|
0,0 90,0 99,0 99,9 |
0,0 18,00 19,80 19,98 |
100,0 10,0 1,0 0,1 |
0,1 0,01 0,001 0,0001 |
10 -1 10 -2 10 -3 10 -4 |
1 2 3 4 |
||||||||
|
100,0 |
20,00 |
0,0 |
10 -7 |
10-7 |
7 |
||||||||
|
Избыток NaOH |
|||||||||||||
|
100,1 101,0 110,0 200,0 |
20,02 20,20 22,00 40,00 |
0,1 1,0 10,0 100,0 |
0,0001 0,001 0,01 0,1 |
10 -10 10 -11 10 -12 10 -13 |
10 11 12 13 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
В результате резкого изменения рН раствора от последней капли раствора основания происходит и резкое изменение окраски индикатора. При отсутствии скачка рН на кривой титрования окраска индикатора изменялась бы постепенно и определить точку эквивалентности было бы невозможно.
