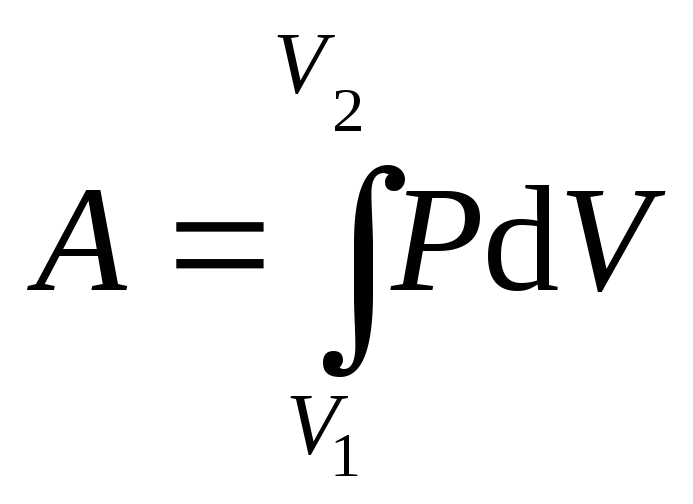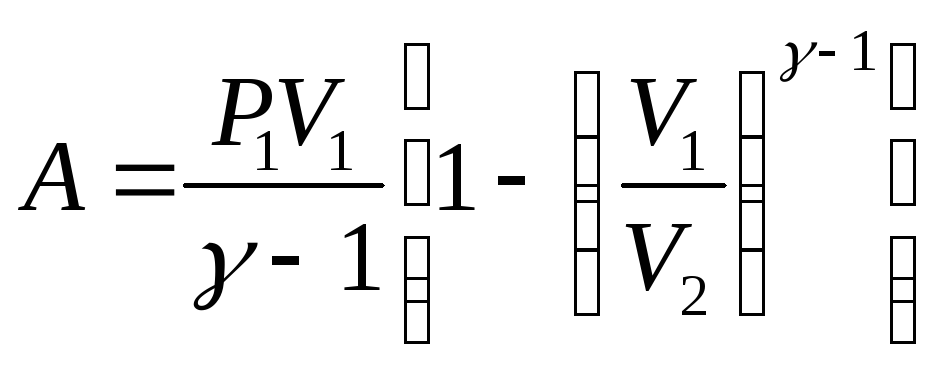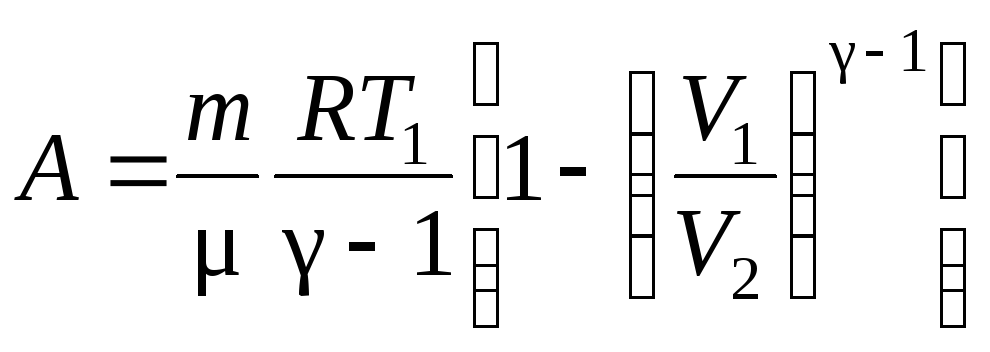- •Введение
- •Обозначения физических величин, используемые в справочнике
- •Греческий алфавит
- •Физические основы механики
- •Кинематика материальной точки Кинематика поступательного движения
- •Кинематика вращательно движения
- •Динамика материальнойточки
- •Силы в механике
- •Энергия. Работа. Законы сохранения
- •Динамика вращательного движения твердого тела
- •Теория тяготения ньютона
- •Законы кеплера
- •Механика жидкостей и газов
- •Специальная теория относительности (сто)
- •Основные положения общей теории относительности (ото)
- •Молекулярная физика и термодинамика
- •Молекулярно-кинетическая теория
- •Распределение газовых молекул по скоростям и энергиям
- •Элементы физической кинетики
- •Первое начало термодинамики
- •Круговые процессы. Тепловые машины
- •Второе и третье начала термодинамики
- •Термодинамические свойства реальных газов
- •Электростатика. Постоянный ток
- •Электрическое поле в вакууме
- •Теорема островского – гаусса и её применение
- •Потенциал и работа электростатического поля. Связь напряженности с потенциалом
- •Диэлектрики в электростатическом поле
- •Проводники в электростатическом поле
- •Эмиссия электронов из проводников. Контактные явления на границах проводников
- •Постоянный электрический ток
- •Электрический ток в газах металлах и электролитах
- •Электромагнетизм
- •Магнитное поле
- •Силы, действующие на движущиеся заряды в магнитном поле
- •Явление электромагнитной индукции
- •Ускорители заряженных частиц
- •Самоиндукция и взаимоиндукция
- •Магнитные свойства вещества
- •Уравнения максвелла
- •Колебания и волны. Геометрическая и волновая оптика
- •1. Гармонические колебания
- •Сложение гармонических колебаний
- •Влияние внешних сил на колебательные процессы
- •Электрические колебания
- •Упругие волны
- •Электромагнитные волны
- •Геометрическая оптика и фотометрия
- •Волновая оптика интерференция света
- •Дифракция света
- •Взаимодействие света с веществом
- •Поляризация света
- •Квантовая оптика. Атомная и ядерная физика. Физика элементарных частиц.
- •Квантовая природа излучения
- •Квантовые явления в оптике
- •Волновые свойства микрочастиц вещества
- •Элементы квантовой механики
- •Движение свободной частицы в одномерной потенциальной яме
- •Физика конденсированного состояния
- •Модели атомов. Атом водорода по теории бора
- •Водородоподобные системы в квантовой механике
- •Физика атомного ядра
- •Заключение
- •Список литературы Обязательная
- •Дополнительная
- •Учебно-методические пособия
-
Распределение газовых молекул по скоростям и энергиям
-
Скорость звука в газе:
![]() ,
,
где
![]() коэффициент
Пуассона,
коэффициент
Пуассона,
![]() плотность
газа.
плотность
газа.
-
Скорости газовых молекул:
-
наиболее вероятная:
![]() или
или
![]() ;
;
-
средняя квадратичная:
![]() или
или
![]() ;
;
-
средняя арифметическая:
![]() или
или
![]() ,
,
где
![]() –
масса молекулы;
–
масса молекулы;
![]() молярная
масса; k
– постоянная Больцмана; R
– газовая постоянная; Т
– абсолютная температура.
молярная
масса; k
– постоянная Больцмана; R
– газовая постоянная; Т
– абсолютная температура.
-
Относительная скорость:
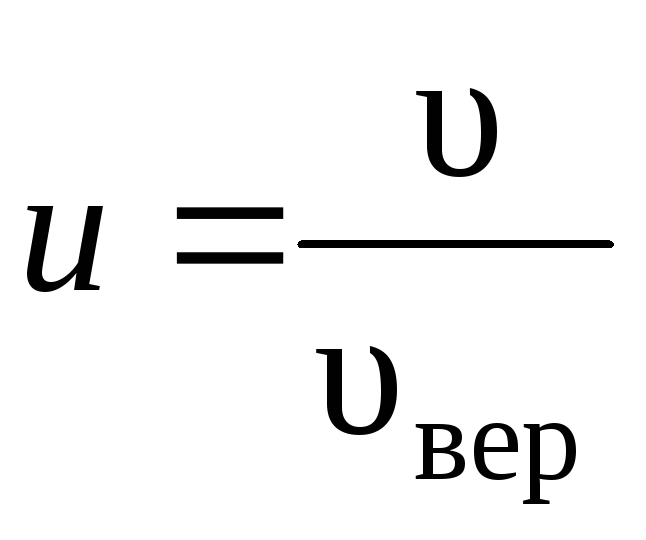 .
. -
Закон распределения молекул по абсолютным значениям скоростей:
![]()
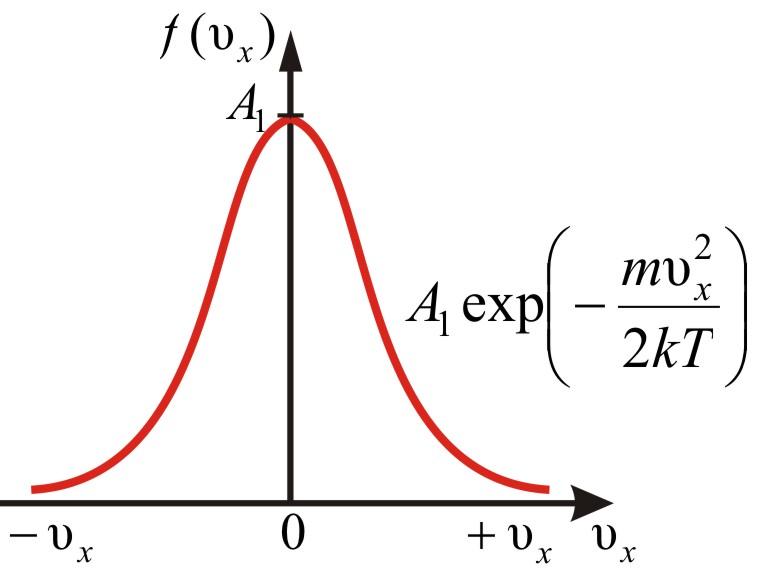
Функции распределения Максвелла обозначает долю молекул единичного объема газа, абсолютные скорости которых заключены в единичном интервале скоростей, включающем данную скорость.
-
для относительных скоростей:
![]() ;
;
-
по импульсам:
![]() .
.
-
Средняя кинетическая энергия поступательного движения молекул идеального газа:
![]()
-
Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения:
![]() .
.
-
Плотность газа:
![]() .
.
-
Барометрическая формула:
![]() ,
,
где Р0 – давление на высоте h = 0.
-
Распределение Больцмана – закон распределения молекул идеального газа по потенциальным энергиям:
![]() ,
,
где
![]() число
молекул в единице объема, там, где Еп
= 0.
число
молекул в единице объема, там, где Еп
= 0.
-
Закон Максвелла – Больцмана– закон распределения молекул идеального газа по полным энергиям Е = Еп + Ек:
![]() .
.
-
Квантовые статистики:
-
Распределение Бозе – Эйнштейна описывает квантовые частицы с целым спином (бозоны):
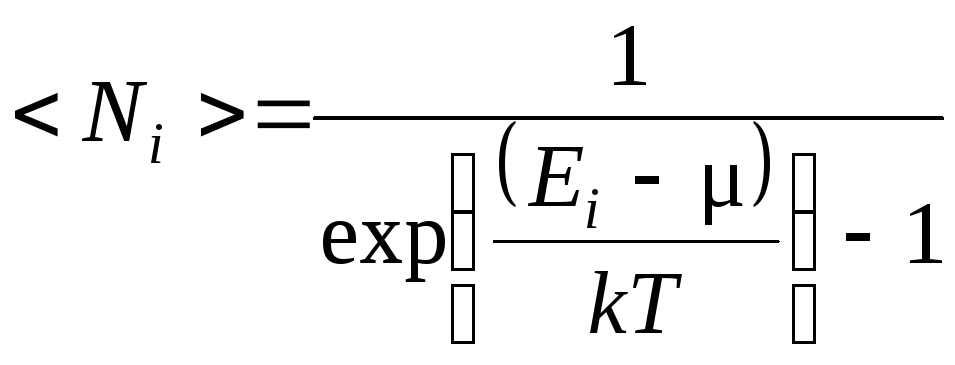 .
.
-
Распределение Ферми – Дирака описывает квантовые частицы с полуцелым спином (фермионы):
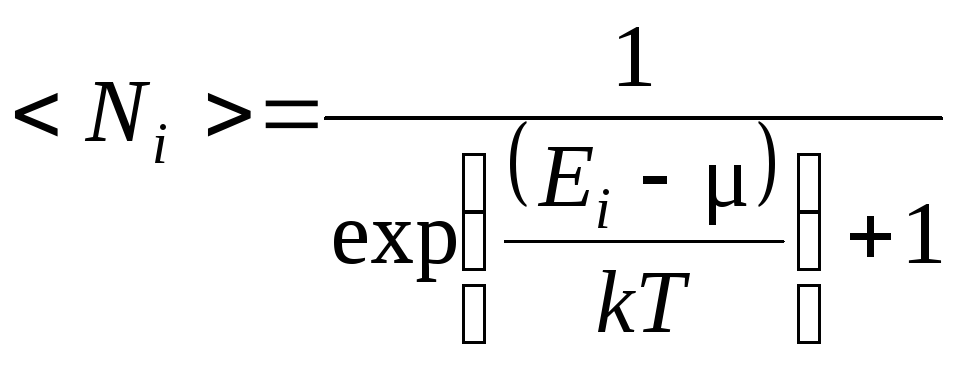 ,
,
где
![]() химический
потенциал.
химический
потенциал.
-
Элементы физической кинетики
-
Э
 ффективное
сечение молекулы
диаметром
d:
ффективное
сечение молекулы
диаметром
d:
![]() .
.
-
Среднее число столкновений в одну секунду:
![]() ,
,
где
п
– количество молекул,
![]() средняя скорость теплового движения.
средняя скорость теплового движения.
-
Средняя длина свободного пробега молекул газа:
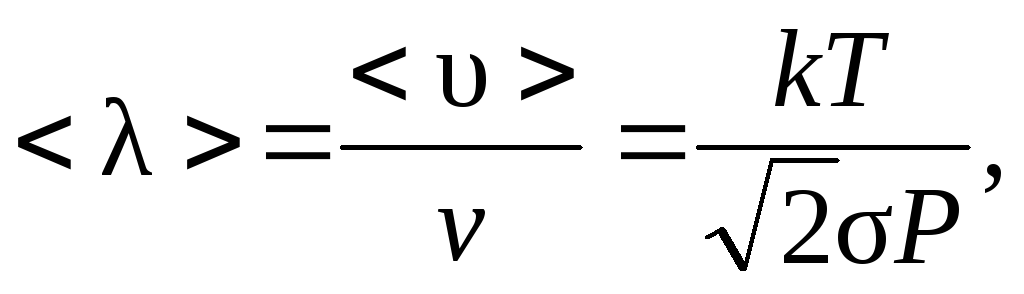
-
Закон диффузии Фика: плотность потока вещества J пропорциональна коэффициенту диффузии D и градиенту концентрации п:
![]() или
или
![]() .
.
-
Коэффициент диффузии:
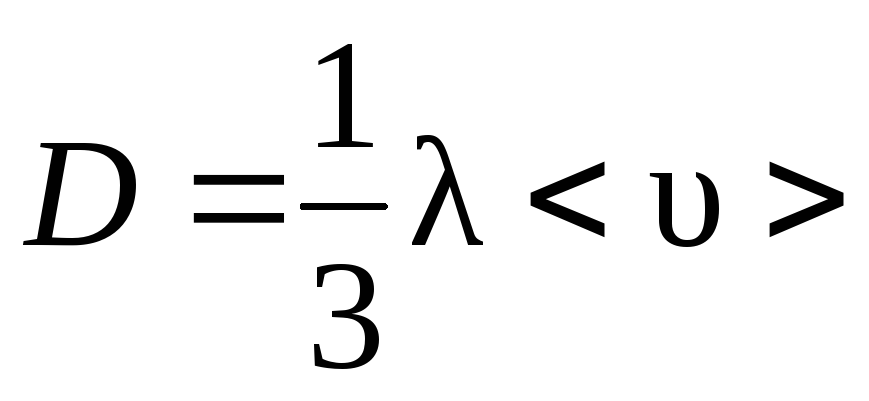 .
.
-
Закон Ньютона для внутреннего трения (вязкости) – сила трения пропорциональна градиенту скорости:
![]() или
или
![]() ,
,
где
![]() – сила, действующая на единицу площади
поверхности, разделяющей два соседних
слоя газа.
– сила, действующая на единицу площади
поверхности, разделяющей два соседних
слоя газа.
-
Коэффициент динамической вязкости:
![]() .
.
-
З
 акон
теплопроводности Фурье
– количество переносимой энергии,
определяемое как плотность теплового
потока q,
пропорционально градиенту температуры:
акон
теплопроводности Фурье
– количество переносимой энергии,
определяемое как плотность теплового
потока q,
пропорционально градиенту температуры:
![]() или
или
![]() .
.
-
Коэффициент теплопроводности:
![]() ,
,
-
Эффект Кнудсена:
![]() ,
,
где
![]() температуры газа в сосудах;
температуры газа в сосудах;
![]() давление
разреженного газа в обоих сосудах.
давление
разреженного газа в обоих сосудах.
-
Первое начало термодинамики
-
Первое начало термодинамики (закон сохранения энергии) – количество теплоты Q, сообщенное телу, идет на увеличение внутренней энергии ΔU и на совершение телом работы А:
![]() .
.
-
Изменение внутренней энергии U идеального газа (энергии теплового хаотического движения молекул):
![]() .
.
-
Внутренняя энергия произвольной массы газа:
![]() .
.
-
Приращение работы газа:
![]() .
.
-
Полная работа:
![]() .
.
-
Удельная теплоемкость – количество теплоты, которое получает или отдает 1 кг вещества при изменении его температуры на 1 К:
![]() .
.
-
Молярная теплоемкость – физическая величина, равная отношению теплоемкости вещества к количеству этого вещества:
![]() .
.
-
Теплоемкость при постоянном объеме:
![]() .
.
-
Теплоемкость при постоянном давлении:
![]() .
.
-
Уравнение Майера:
CP=CV+R.
-
Теплоемкость одноатомных газов при постоянном объеме и постоянном давлении:
![]() и
и
![]() .
.
-
Показатель адиабаты (коэффициент Пуассона):
![]() .
.
-
Молярные теплоемкости многоатомных газов при постоянном объеме и постоянном давлении:
![]() и
и
![]() ,
,
где i – число степеней свободы молекулы.
-
Показатель адиабаты для многоатомных газов:
![]() .
.
-
Внутренняя энергия идеального газа:
![]() .
.
-
Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы:
![]() .
.
-
Закон Больцмана о равномерном распределении энергии по степеням свободы:
![]() .
.
-
Изохорический процесс – процесс протекающий при постоянном объеме.
-
Количество теплоты, сообщенное в изохорическом процессе:
![]() или
или
![]() ,
,
где Т1, Т2 – соответственно начальная и конечная температура.
-
Изменение внутренней энергии в изохорическом процессе:
![]() или
U
=
Q.
или
U
=
Q.
-
Теплоемкость в изохорическом процессе:
![]() или
или
![]() .
.
-
Изобарический процесс – процесс протекающий при постоянном давлении.
-
Работа в изобарическом процессе:
![]() ,
,
где V1 и V2 – соответственно начальный и конечный объемы газа.
-
Количество теплоты, сообщенное в изобарическом процессе:
δQ
= СP
dT
или
![]() .
.
-
Изменение внутренней энергии в изобарическом процессе:
dЕп
= СV
dT
или
![]() .
.
-
Теплоемкость в изобарическом процессе:
![]() .
.
-
Изотермический процесс – процесс, протекающий при постоянной температуре.
-
Работа газа в изотермическом процессе:
![]() или
или
![]()
-
Характеристики изопроцессов в газах:
|
|
Название процесса |
|||
|
Изохорический |
Изобарический |
Изотермический |
Адиабатический |
|
|
Условие протекания процесса |
V = const |
P = const |
T = const |
δQ = 0
|
|
Связь между параметрами состояния |
|
|
|
|
|
Первое начало |
|
|
|
|
|
Работа в процессе |
|
|
|
δA = PdV = dU
А = −∆U = – CV(T2 T1)
|
|
Количество теплоты, сообщённое в процессе |
|
δQ = СP dT Q = СP (T2 T1)
|
δQ = δA Q = A |
δQ = 0 Q = 0 |
|
Изменение внутренней энергии |
dU = δQ
|
dU = СV dT
|
dU = 0 U = 0
|
dU = δA = = СV dT U = A = =СV (T2 T1)
|
|
Теплоёмкость |
|
|
CТ
=
|
Сад = 0 |
-
Политропный процесс – такой процесс, при котором изменяются все основные процессы, кроме теплоемкости.
-
Уравнение политропы:
![]() или
или
![]() ,
,
где п – показатель политропы.
-
Изменение внутренней энергии идеального газа:
![]()