
- •Введение.
- •Часть 1. Типовые задачи.
- •1.1.Основные понятия химии.
- •1.1.1. Количество вещества (n), масса (m), молярная масса (м), число Авогадро (nа)
- •1.1.2. Массовая доля элемента () в химическом соединении или в смеси.
- •1.1.2. Определение формулы вещества
- •1.1.3 Расчеты по уравнениям химических реакций. Выход () продукта в реакции или в процессе.
- •1.2. Задачи с участием газов.
- •Молярный объем газа – это объем, который занимает 1 моль газа
- •1.2.2.Абсолютная () и относительная (d) плотность газа
- •1.2.4.Расчеты по уравнениям реакций с участием газов
- •1.3. Растворы
- •1.3.2. Растворимость (s) и коэффициент растворимости (s)
- •1.3.3. Электролитическая диссоциация, степень диссоциации ()
- •1.4. Тепловые эффекты химических реакций (q)
- •Суммарный тепловой эффект многостадийного процесса равен алгебраической сумме тепловых эффектов отдельных стадий, например:
- •1.6. Химическое равновесие
- •1.7. Электрохимический ряд активности металлов
- •Закон Фарадея:
- •Часть 2. Подходы к решению сложных комбинированных задач
- •2.1. Общие рекомендации
- •2.1.1. Осмысление задачи
- •Решение:
- •56,4 Г осадка
- •2.1.2. Химизм процессов
- •2.1.3. Обработка цифровых данных.
- •2.1.4. Проверка правильности решения
- •2.2. Избыток и недостаток
- •2.2.3. Конечный результат и последовательность протекания химических реакций зависят от порядка смешивания реагентов.
- •2.3. Постадийное определение состава смеси
- •2.4. Введение неизвестных величин
- •2.4.1. Введение одного неизвестного
- •2.4.2.1. Примеры задач с системами из двух неизвестных:
- •2.4.2.2. Примеры задач с системами из трех неизвестных:
- •Примеры задач с квадратными уравнениями
- •2.5. Введение произвольного параметра
- •2.6. Метод подбора
- •2.7. Многовариантные задачи
- •2.8. Составление материального баланса
- •Часть 3. Конкурсные задачи
- •3.1. Газы
- •3.2. Растворы и смеси
- •3.2.1. Растворение простых веществ
- •3.2.2. Растворение сложных веществ
- •Растворение сплавов и смесей
- •3.2.4. Смешивание растворов
- •3.2.5. Растворимость
- •3.2.6. Последовательно соединенные промывные сосуды
- •Смешивание растворов в различных соотношениях
- •Равные массовые доли ионов в растворе
- •Изменение порядка смешивания реагентов
- •Три разных вещества реагируют с равными количествами одинаковых растворов
- •Термическое разложение солей
- •3.4. Определение формулы вещества
- •3.4.1. Определение элемента
- •3.4.2. Определение формулы неорганического вещества
- •3.4.3. Определение формулы органического вещества
- •3.4.4. Определение числа фрагментов в высокомолекулярном соединении
- •3.5. Тепловые эффекты химических реакций
- •3.6. Скорость химических реакций
- •3.7. Химическое равновесие.
- •3.8. Вытеснение одного металла другим
- •3.9. Электролиз
- •3.10. Некоторые новые задачи 2002 — 2005 г.Г.
- •Решения некоторых конкурсных задач
- •Номера задач по веществам и классам химических соединений
- •Приложения Условные обозначения, используемые в пособии
- •Расчетные формулы, используемые при решении задач
- •Содержание
2.4.2.2. Примеры задач с системами из трех неизвестных:
Пример 108. 260 мл кислорода при нормальных условиях смешали с 100 мл смеси диметилового эфира, этиламина и аммиака и взорвали. После приведения к нормальным условиям и конденсации паров воды объем газовой смеси составил 180 мл, а после пропускания ее через избыток раствора гидроксида бария объем газа уменьшился до 60 мл. Определите объемный состав исходной газовой смеси.
Решение:
-
Обозначим через х, у и z объемы диметилового эфира, этиламина и аммиака и запишем уравнения происшедших химических реакций:
Было: х 260
CH3OCH3 + 3 O2 2 CO2 + 3 H2O + (O2) (1)
Прореагировало: х 3х стало: 2х 260 – 3х
Было: у 260 – 3х
4 C2H5NH2 + 15 O2 8 CO2 + 2 N2 +14 H2O + (O2) (2)
Прореагировало: у 3,75у стало: 2у 0,5у 260 – 3х – 3,75у
Было: z 260–3х–3,75у
4 NH3 + 3 O2 2 N2 + 6 H2O + (O2) (3)
Прореагировало: z 0,75z стало: 0,5z 260–3х–3,75у–0,75z
Было: 2х+2y
CO2 + Ba(OH)2 BaCO3 + H2O + (N2) + (O2) (4)
Прореагировало: 2х+2y 2х+2y стало: 2х+2y 0,5y+0,5z 260–3х–3,75у–0,75z
-
Составляем систему уравнений и решаем ее:
а) x + y + z = 100. б) 2х+2y = 180 – 60 = 120.
в) 0,5y+0,5z + 260–3х–3,75у–0,75z = 60; 3х + 3,25у + 0,25z = 200.


 x
+ y
+ z
= 100 x
+ y
+ z
= 100 x
+ y
= 60 ∙ 3 3х
+ 3у
= 180
x
+ y
+ z
= 100 x
+ y
+ z
= 100 x
+ y
= 60 ∙ 3 3х
+ 3у
= 180
2х+2y = 120 : 2 x + y = 60 3х + 3,25у = 190 3х + 3,25у = 190
z = 40 0,25у = 10 у = 40
3х + 3,25у + 0,75z = 220 х = 20
Ответ: V(CH3OCH3) = 20 мл. V(C2H5NH2) = 40 мл. V(NH3) = 40мл.
Пример 109. На сжигание смеси метана, ацетилена и пропена с плотностью по водороду 12 требуется 1,8 л (н.у.) кислорода, а на полное гидрирование такого же количества исходной смеси — равный ей объем водорода. Определите объемный состав смеси после гидрирования.
Решение:
-
Обозначим объемы метана, ацетилена и пропена за х, у и z соответственно. Запишем уравнения химических реакций:
х
СН4 + 2 О2 СО2 + 2 Н2О (1)
2х
у
2 С2Н2 + 5 О2 4 СО2 + 2 Н2О (2)
2,5у
z
2 С3Н6 + 9 О2 6 СО2 + 6 Н2О (3)
4,5z
у
С2Н2 + 2 Н2 С2Н6 (4)
2у у
z
С3Н6 + Н2 С3Н8 (5)
z z
-
Рассчитываем среднюю молярную массу исходной газовой смеси, составляем систему уравнений и решаем ее:
Мср.(газовой смеси) = 12 ּ 2 = 24 г/моль.
16х / (х + у + z) + 26у / (х + у + z) + 42z / (х + у + z) = 24.
16х + 26у + 42z = 24х + 24у + 24z.
–

 8х
+ 2у
+ 18z
=
0
8х
+ 2у
+ 18z
=
0
– 8х + 2у + 18z = 0 – 8х + 2у + 18z = 0 х = 3z х = 0,3
2х + 2,5у + 4,5z = 1,8 2х + 2,5у + 4,5z = 1,8 6х = 1,8 у = 0,3
х + у + z = 2у + z х = у z = 0,1
Ответ: V(СН4) = 0,3 л, V(С2Н6) = 0,3 л, V(С3Н8) = 0,1 л .
Пример 110. 4,48 л (н.у.) смеси этилена с парами диенового углеводорода разветвленного строения обесцвечивает 148,1 мл раствора брома в тетрахлориде углерода с массовой долей брома 15 % и плотностью 1,8 г/мл. Определите структурную формулу диенового углеводорода, если известно, что при сжигании такого же количества исходной смеси образуется 9 г воды.
Решение:
-
Рассчитываем количества вещества исходной газовой смеси, брома и воды:
(газовой смеси) = 4,48 / 22,4 = 0,2 моль.
(Br2) = 148,1 ∙ 1,8 ∙ 0,15 / 160 = 0,25 моль.
(Н2О) = 9 / 18 = 0,5 моль.
-
Обозначим количества вещества этилена и диенового углеводорода за х и у соответственно. Запишем уравнения химических реакций с указанием количеств реагирующих и образующихся веществ:
х
С2Н4 + Br2 С2Н4Br2 (1)
х
у
CnH2n–2 + 2 Br2 CnH2n–2 Br4 (2)
2у
х
С2Н4 + 3 О2 2 СО2 + 2 Н2О (3)
2х
у
CnH2n–2 + (1,5n – 0,5) О2 n СО2 + (n – 1) Н2О (4)
(n – 1) ∙ у
-
С

 оставим
систему уравнений и найдем n:
оставим
систему уравнений и найдем n:
х + у = 0,2 у = 0,05 0,3 + 0,05n – 0,05 = 0,5
х + 2у = 0,25 х = 0,15 0,05n = 0,25
2х + (n – 1) ∙ у = 0,5 2х + (n – 1) ∙ у = 0,5 n = 0,25 / 0,05 = 5
-
Составим структурную формулу углеводорода С5Н8 :
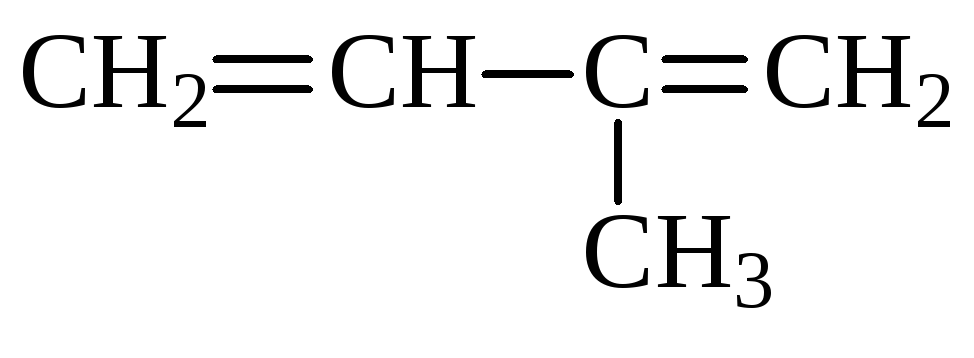 (изопрен)
(изопрен)
Ответ: изопрен.
Пример 111. В 400 г водного раствора содержится 41,8 г смеси фенола, уксусной кислоты и акриловой кислоты. Для полной нейтрализации 10 г этого раствора потребовалось 9,52 мл раствора гидроксида натрия с массовой долей щелочи 6% и плотностью 1,05 г/мл. При обработке 10 г того же раствора бромной водой с массовой долей брома 3% до прекращения ее обесцвечивания было затрачено 66,67 г бромной воды. Рассчитайте массовые доли веществ в исходном растворе.
Решение:
-
Рассчитываем массу смеси, содержащуюся в 10 г раствора, и количества вещества гидроксида натрия и брома:
m(смеси веществ в 10 г раствора) = 41,8 / 40 = 1,045 г .
(NaOH) = 9,52 ∙ 1,05 ∙ 0,06 / 40 = 0,015 моль.
(Br2) = 66,67 ∙ 0,03 / 180 = 0,0125 моль.
-
Обозначим количества вещества фенола, уксусной кислоты и акриловой кислоты за х, у и z соответственно. Запишем уравнения химических реакций с указанием количеств реагирующих веществ:
х
С6Н5ОН + NaOH С6Н5ОNa + Н2О (1)
х
у
СН3СООН + NaOH СН3СООNa + Н2О (2)
у
z
СН2= СНСООН + NaOH СН2= СНСООNa + Н2О (3)
z
х
С6Н5ОН + 3 Br2 С6Н2Br3ОН + 3 НBr (4)
3х
z
СН2= СНСООН + Br2 СН2Br – СНBrСООН (5)
z
-
Составляем систему уравнений и находим х, у и z:
х

 + у
+ z
= 0,015 ∙72 72х
+ 72у
+ 72z
= 1,08 у
– 2х
=
0,0025 ∙12 12у
– 24х
= 0,03
+ у
+ z
= 0,015 ∙72 72х
+ 72у
+ 72z
= 1,08 у
– 2х
=
0,0025 ∙12 12у
– 24х
= 0,03
3х + z = 0,0125 94х + 60у + 72z = 1,045 12у – 22х = 0,035 12у – 22х = 0,035
94х + 60у + 72z = 1,045
2х = 0,005. х = 0,0025. z = 0,0125 – 0,0075 = 0,005. у = 0,015 – 0,0025 – 0,005 = 0,0075.
-
Рассчитываем массы веществ в 10 г раствора и их массовые доли в исходном растворе:
m(С6Н5ОН) = 94 ∙ 0,0025 = 0,235 г.
(С6Н5ОН) = 0,235 / 10 = 0,0235.
m(СН3СООН) = 60 ∙ 0,0075 = 0,45 г.
(СН3СООН) = 0,45 / 10 = 0,045
m(СН2= СНСООН) = 72 ∙ 0,005 = 0,36 г.
(СН2= СНСООН) = 0,36 / 10 = 0,036.
Ответ: w(С6Н5ОН) = 2,35 %; w(СН3СООН) = 4,5 %; w(СН2= СНСООН) = 3,6 %.
Пример 112. На нейтрализацию 23,7 г смеси уксусной и насыщенной двухосновной карбоновой кислот потребовалось 66,1 мл раствора гидроксида натрия с массовой долей щелочи 20 % и плотностью 1,21 г/мл. Определите структурную формулу двухосновной кислоты и ее массовую долю в исходной смеси, если известно, что при сжигании такого же количества исходной смеси образуется 17,92 л оксида углерода (IV) (н.у.).
Решение:
-
Рассчитываем количества вещества гидроксида натрия и углекислого газа:
(NaOH) = 66,1 ∙ 1,21 ∙ 0,2 / 40 = 0,4 моль.
(СО2) = 17,92 / 22,4 = 0,8 моль.
-
Обозначим количества вещества уксусной и насыщенной двухосновной карбоновой кислоты за х и у соответственно. Запишем уравнения химических реакций с указанием количеств реагирующих и образующихся веществ:
х
СН3СООН + NaOH СН3СООNa + Н2О (1)
х
у
СnH2n(СООН)2 + 2 NaOH СnH2n(СООNa)2 + 2 Н2О (2)
2у
х
СН3СООН + 2 О2 2 СО2 + 2 Н2О (3)
2х
у
СnH2n(СООН)2 + (1,5n + 1,5) О2 (n + 2) СО2 + (n + 1) Н2О (4)
(n + 2) ∙ у
-
Составляем систему уравнений и находим х, у и n:
х
 + 2у
= 0,4 х
+ 2у
= 0,4 х
+ 2у
= 0,4
+ 2у
= 0,4 х
+ 2у
= 0,4 х
+ 2у
= 0,4
2х + (n + 2) ∙ у = 0,8 2х + nу + 2у = 0,8 nу = 0,8 – 2х – 2у
60х + (14n + 90) ∙ у = 23,7 60х + 14nу + 90у = 23,7 60х + 11,2 – 28х – 28у + 90у = 23,7
х

 + 2у
= 0,4 ∙ 32 32х
+ 64у
= 12,8 2у
= 0,3 х
= 0,4 – 0,3 = 0,1
+ 2у
= 0,4 ∙ 32 32х
+ 64у
= 12,8 2у
= 0,3 х
= 0,4 – 0,3 = 0,1
32х + 62у = 12,5 32х + 62у = 12,5 у = 0,15
n = (0,8 – 0,2 – 0,3) / 0,15 = 2
-
Составляем структурную формулу неизвестной кислоты и определяем ее массовую долю в смеси:
НООС—СН2—СН2—СООН (янтарная кислота)
m(янтарной кислоты) = 118 ∙ 0,15 = 17,7 г.
(янтарной кислоты) = 17,7 / 23,7 = 0,7468.
Ответ: (янтарной кислоты) = 74,68 %.
Задачи для самостоятельного решения
-
100 мл смеси азота, метиламина и этана смешали (н.у.) с 250 мл кислорода и подожгли. После приведения к нормальным условиям объем смеси составил 180 мл, а объемная доля кислорода в ней оказалась 11,11%. Определите состав исходной газовой смеси.
-
Объем водорода, необходимый для полного гидрирования смеси ацетилена, пропена и паров бензола, вдвое больше объема этой смеси при тех же условиях. Определите состав исходной смеси веществ в массовых долях, если известно, что для сжигания 9,3 г смеси продуктов гидрирования требуется 23,52 л кислорода (н.у.).
-
Смесь газообразного алкина с водородом с плотностью 0,4286 г/л (н.у.) пропустили над никелевым катализатором и получили газовую смесь, не обесцвечивающую бромную воду, с плотностью 0,7143 г/л (н.у.). Определите формулу исходного алкина.
-
4,88 г смеси стирола, фенола и анилина полностью прореагировало с 587 г бромной воды с массовой долей брома 3 %. На нейтрализацию продуктов реакции потребовалось 200 мл раствора гидроксида натрия с молярной концентрацией щелочи 0,5 моль/л. Определите состав исходной смеси веществ (в массовых долях).
-
При сжигании 34,6 г смеси муравьиной и насыщенной двухосновной органической кислоты образовалось 20,16 л оксида углерода (IV) (н.у.), а на нейтрализацию такого же количества этой смеси пошло 50 мл раствора гидроксида натрия с массовой долей щелочи 40 % и плотностью 1,4 г/мл. Определите структурную формулу двухосновной кислоты.
