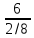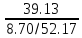- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Модуль №1 Основные понятия, основные законы химии
- •1.1 Основные понятия химии и законы сохранения
- •Первые химические термины
- •1.1.2 Закон сохранения массы.
- •Основные понятия химии и стехиометрические законы
- •1.2.1 Закон постоянства состава
- •1.2.2 Закон кратных отношений Атомистическая теория Дальтона
- •1.2.3 Закон небольших объемных отношений Гей-Люссака Молекулярная теория Авогадро
- •1.2.4 Реформа Канниццаро
- •Модуль №2 Основные положения атомно-молекулярного учения
- •2.1 Положение об атомном составе веществ
- •Положение о самопроизвольном связывании атомов
- •2.3 Положение о молекулах и молекулярном строении веществ
- •2.4 Положение немолекулярных веществах
- •2.5 Положение о тепловом движении атомов и молекул
- •Список литературы
- •Оглавление
1.2.4 Реформа Канниццаро
Вместе с тем, к середине XIХв. постепенно начали накапливаться проблемы, вырисовываться слабые места и в довольно стройной системе, выстроенной Я.Берцелиусом. В первую очередь это было связано с бурным развитием органической химии28: состав многих веществ не соответствовал не только постулированным Дальтоном, но и существенно расширенным, подкрепленным химическим анализом множества веществ вариантам атомных соотношений элементов в бинарных соединениях, которые предложил Я.Берцелиус. Накопление теоретических проблем послужило причиной того, что некоторые химики-органики стали активно пропагандировать новые основополагающие понятия (эквивалент, соединительные веса, пропорциональное число…), взамен или наряду с понятиями атом, молекула.
Конец многолетним дискуссиям, путанице в смысле понятий атом, молекула (и эквивалент), разночтениям в атомных массах элементов и формулах веществ29 удалось положить лишь в 1860г. на первом специальном Международном съезде химиков в австрийском г.Карлсруэ. Принятые на съезде решения были коллективными (коллегиальными), принимались голосованием, но большинство участников отметили выдающуюся роль в отстаивании атомно-молекулярных представлений итальянского профессора химии С.Канниццаро. Возродив идеи А.Авогадро, он выработал оригинальный метод определения атомных масс элементов, на основе которого в 1858г. пришел к выводу, который получил название закон атомов Канниццаро. В основе метода Канниццаро лежит анализ, сопоставление массовых долей одного и того же элемента в как можно более широкой группе его газообразных соединений. Причем сравнивается масса этого элемента, входящая в состав одного и того же объема разных газов. Сравним результаты, получающиеся, исходя из двух основных предположений:
-
в равных объемах газов при одинаковых условиях находится одинаковое число простых и сложных атомов (Дальтон, Берцелиус и мн. др.);
-
в равных объемах газов при одинаковых условиях находится одинаковое число молекул, состоящих из связанных атомов (Авогадро, Канниццаро и мн. др.).
Рассмотрим для начала ряд известных на тот момент водородных соединений. Для этого нам потребуется 1гр. водорода (~11.2л) и ~11.2л других взятых для анализа веществ. Далее необходимо определить массы этих веществ и с учетом массовых долей водорода рассчитать массу данного элемента в составе взятых объемов газов (табл. №1.3).
Таблица №1.3.
Масса элементарного водорода, содержащегося
в 11.2л (в пересчете на н.у.) различных газов и формулы этих веществ,
исходя из атомарного и молекулярного строения водорода
|
Название вещества |
m(в-ва), гр. |
ω(Н), % |
m(Н), гр |
Предпола-гаемая формула |
Предпола-гаемая формула |
|
водород |
1 |
100 |
1 |
H |
H2 |
|
метан |
8 |
25 |
2 |
CxH2 |
CxH4 |
|
этан |
15 |
20 |
3 |
CxH3 |
CxH6 |
|
вода |
9 |
11.11 |
1 |
HOx |
H2Ox |
|
сероводород |
17 |
5.88 |
1 |
HSx |
H2Sx |
|
циановодород |
13.5 |
3.70 |
0.5 |
H0.5CxN y |
HCxN y |
|
хлороводород |
17.75 |
2.74 |
~0.5 |
H0.5Clx |
HClx |
|
аммиак |
8.5 |
17.65 |
1.5 |
NxH1.5 |
NxH3 |
|
бромоводород |
40.5 |
1.23 |
0.5 |
H0.5Brx |
HBrx |
Видно, что предположение атомарного строения водорода приводит к абсурдной атомной доле этого элемента в ряде веществ (циановодород, хлороводород, бромоводород). Если признавать неделимость атомов и атомную массу водорода принять в качестве эталона за единицу, то следует признать водород молекулярным веществом, состоящим, как минимум из двухатомных молекул (другие "четные" по составу молекулы водорода тоже будут давать целочисленный атомный вклад этого элемента в формулы других веществ).
Рассмотрим некоторые кислородные соединения (табл. №1.4).
Таблица №1.4.
Масса элементарного кислорода, содержащегося
в 11.2л (в пересчете на н.у.) различных газов и формулы этих веществ,
исходя из атомарного и молекулярного строения кислорода
|
Название вещества |
m(в-ва), гр. |
ω(О)/ω(Н), % |
m(О)/ m(Н), гр |
Предпола-гаемая формула |
Предпола-гаемая формула |
|
кислород |
16 |
100 |
16 |
O |
O2 |
|
вода |
9 |
88.89/11.11 |
8 / 1 |
HO0.5 |
H2O, Н4О2… |
|
угарный газ |
14 |
57.14 |
8 |
CxO0.5 |
CxO |
|
углекислый газ |
22 |
72.73 |
16 |
CxO |
CxO2 |
|
закись азота |
22 |
36.36 |
8 |
NxO0.5 |
NxO |
|
окись азота |
15 |
53.33 |
8 |
NyO0.5 |
N yO |
|
сернистый газ |
32 |
50.00 |
16 |
SxO |
SxO2 |
|
метанол |
16 |
50.00/12.50 |
8 / 2 |
CxH2O0.5 |
CxH4O |
|
глицерин |
46 |
52.17/8.70 |
24 / 4 |
CxH4O1.5 |
CxH8O3 |
Анализ полученных результатов позволяет сделать несколько выводов. Во-первых, атомная масса кислорода составляет как минимум 16 относительных единиц (не исключены и другие, кратные 16-ти, значения). Во-вторых, кислород также имеет молекулярное строение и при выборе минимального разумного значения атомной массы кислорода (16 атомных единиц) ‒ молекула кислорода двухатомна. В-третьих, при выборе атомных масс водорода и кислорода (1 и 16) простейшая формула воды ‒ H2O.
В завершение рассмотрим некоторые соединения углерода (табл. №1.5).
Таблица №1.5.
Масса элементарного углерода, содержащегося
в 11.2л (в пересчете на н.у.) различных газов и формулы этих веществ,
исходя из минимального разумного значения атомной массы углерода
|
Название вещества |
m(в-ва), гр. |
% |
гр |
Предполагаемая формула |
|
|
|
|
||||
|
метан |
8 |
|
|
СН2 / СН4, С2Н8… |
|
|
этан |
15 |
|
|
С2Н3 / СН3, С2Н6… |
|
|
угарный газ |
14 |
|
|
CO0.5 / СО, С2О2… |
|
|
углекислый газ |
22 |
|
|
CO / СО2, С2О4… |
|
|
метанол |
16 |
|
|
СН2O0.5 / СН4О… |
|
|
уксусная кислота |
30 |
|
|
‒ / СН2О, С2Н4О2… |
|
|
глицерин |
46 |
|
|
‒ / С3Н8О3,С6Н16О6 |
|
Как видно, наименьший массовый вклад атомов углерода составляет 6 относительных единиц, но выбор этого числа в качестве относительной атомной массы углерода приводит в ряде случаев (угарный газ, метанол…) к "дробному" вкладу атомов других элементов (в последних двух строках соответствующие формулы не приведены). Такой проблемы не будет, если предположить атомную массу углерода, равную 12 атомным единицам. Вытекающие из этого предположения формулы рассмотренных веществ приведены в последней колонке после косой черты. Истинную формулу можно установить, например, выполняя дополнительно реакции сгорания соответствующих веществ и сравнивая, сколько молекул углекислого газа и воды получается из одной молекулы анализируемого соединения (сравнивая объемы реагентов и продуктов сгорания).
Данный метод применим только к газообразным веществам, поэтому с его помощью трудно определять (уточнять) атомные массы металлов, которые составляют большую часть элементов. Основная ценность работ Канниццаро состояла в возрождении идей А.Авогадро, в строгом, убедительном объединении атомистических и молекулярных представлений, в четком разграничении основополагающих химических понятий.
На конгрессе в Карлсруэ именно под влиянием неоднократных настойчивых и аргументированных выступлений С.Канниццаро были приняты формулировки-определения для атомов, молекул, эквивалента; было достигнуто согласие относительно системы атомных масс и формул веществ.
-
Исходя из современных представлений о строении веществ, необходимо отметить, что закон (гипотеза) Авогадро, строго говоря, применим к газам, находящимся в условиях пренебрежимо слабого межмолекулярного взаимодействия, т.е. при низком парциальном давлении, а еще надежнее – при высоких температурах, исключающих ассоциацию молекул. Эти же ограничения справедливы и для следствий из закона Авогадро. Абсолютно отсутствует межмолекулярное взаимодействие у, так называемого идеального газа30. Среди реальных газов этим условиям лучше всего удовлетворяют гелий, водород, азот.
В настоящее время общепринятыми следствиями из закона Авогадро считаются два утверждения:
-
Сформулированная и доказанная самим Авогадро (см.27 на стр.29) возможность расчета молярных масс газов по их относительным плотностям: плотности любых двух газов пропорциональны их молярным массам или молярная масса изучаемого газа прямо пропорциональна молярной массе эталона (коэффициентом пропорциональности является относительная плотность исследуемого газа по газу-эталону):
 (3)
(3)
-
Один моль любого газа при нормальных условиях (Т = 273 К, Р = 1атм или 101.3кПа) занимает объем, примерно равный 22.4л (молярный объем газов при н.у.
 = 22.4 л/моль)31.
= 22.4 л/моль)31.
Таблица №1.6.
Молярные объемы некоторых газов при н.у.
|
Газ |
|
Газ |
|
|
H2 |
22.43 |
CH4 |
22.36 |
|
He |
22.43 |
C4H10 |
21.50 |
|
N2 |
22.40 |
CO2 |
22.26 |
|
O2 |
22.39 |
SO2 |
21.89 |
|
Cl2 |
22.02 |
NH3 |
22.08 |
Проектное задание
Сформулируйте закон сохранения массы веществ и стехиометрические законы химии, определите границы их применимости и обоснуйте их справедливость с учетом современных представлений о составе и структуре веществ.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 1
|
1. Опыты Р.Бойля и М.Ломоносова отличались тем, что |
|
|
1. |
Выполнялись в атмосфере разных газов |
|
2. |
В опытах Бойля использовались предварительно прокаленные металлы |
|
3. |
Воздух ретортах находился под разным давлением |
|
4. |
Методом взвешивания и интерпретацией результатов |
|
|
|
|
2. Утверждения Ж.Л.Пруста и К.Бертолле |
|
|
1. |
Справедливы, т.к. были получены при изучении веществ с разной структурной организацией |
|
2. |
Справедливы, применительно к веществам с разной структурной организацией |
|
3. |
Есть результат разной строгости в постановке экспериментов |
|
4. |
Отчасти есть результат удачного и неудачного сочетания выбора объектов исследования и имевшихся на тот момент исследовательских возможностей |
|
|
|
|
3. Атомистическая теория Дальтона и Берцелиуса сформировались в результате… (имеются ли неверные продолжения?) |
|
|
1. |
Тщательного изучения состава веществ и грамотного толкования массовых соотношений |
|
2. |
Взаимодополняющего применения закона сохранения массы веществ (элементов) и объемных соотношений |
|
3. |
Взаимодополняющего применения данных о составе, структуре и тепловых свойствах веществ |
|
4. |
Применения всех открытых на тот момент химических законов |
|
|
|
|
4. Молекулярная теория А.Авогадро |
|
|
1. |
Находилась в противоречии с атомистической теорией Дальтона-Берцелиуса |
|
2. |
Опиралась на законы пневматической химии |
|
3. |
Была объединена с атомистической теорией Дальтона-Берцелиуса решением первого международного конгресса химиков |
|
4. |
Совместно с атомистической теорией Дальтона-Берцелиуса и некоторыми другими идеями составили основу атомно-молекулярного учения |
|
|
|
Бланк ответа
|
|
1 |
2 |
3 |
4 |
|
1 (5 баллов) |
|
|
|
|
|
2 (5 баллов) |
|
|
|
|
|
3 (5 баллов) |
|
|
|
|
|
4 (5 баллов) |
|
|
|
|
Критерии для самоконтроля степени усвоения материала модуля:
Оценка при выполнении теста: 6 – 10 баллов – удовлетворительно
11 – 16 баллов – хорошо
17 – 20 баллов - отлично.

 ,
, ,
,