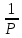- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Модуль №1 Основные понятия, основные законы химии
- •1.1 Основные понятия химии и законы сохранения
- •Первые химические термины
- •1.1.2 Закон сохранения массы.
- •Основные понятия химии и стехиометрические законы
- •1.2.1 Закон постоянства состава
- •1.2.2 Закон кратных отношений Атомистическая теория Дальтона
- •1.2.3 Закон небольших объемных отношений Гей-Люссака Молекулярная теория Авогадро
- •1.2.4 Реформа Канниццаро
- •Модуль №2 Основные положения атомно-молекулярного учения
- •2.1 Положение об атомном составе веществ
- •Положение о самопроизвольном связывании атомов
- •2.3 Положение о молекулах и молекулярном строении веществ
- •2.4 Положение немолекулярных веществах
- •2.5 Положение о тепловом движении атомов и молекул
- •Список литературы
- •Оглавление
2.5 Положение о тепловом движении атомов и молекул
Все частицы (атомы, молекулы, ионы) находятся в непрерывном тепловом движении (по мере увеличения подвижности: вращательном, колебательном или поступательном). Из молекулярно-кинетической теории газов, разработанной во второй половине XIXв.(Р.Клаузиус, Д.К.Максвелл, Л.Больцман), следует, что средняя кинетическая энергия отдельной молекулы прямо пропорциональна абсолютной температуре:
 ,
(4)
,
(4)
где k – константа Больцмана.
Учитывая, что кинетическая энергия связана со скоростью тела:
 ,
(5)
,
(5)
получаем
 ,
(6)
,
(6)
т.е. при фиксированной температуре наибольшей подвижностью (максимальными скоростями диффузии) обладают легкие молекулы водорода. Более удобный вид эти выражения приобретают, если пересчитать их на 1 моль вещества. Современное понятие моль было принято в 1971г. на XIV Генеральной конференции по мерам и весам:
1
моль вещества ‒ это такое число его
структурных единиц (атомов, молекул,
ионов), сколько атомов содержится в
 г углерода 12С.
Число это называется константой
Авогадро:
NA
=
6.02∙1023моль-1.
г углерода 12С.
Число это называется константой
Авогадро:
NA
=
6.02∙1023моль-1.
Из определения следует, что
 .
(7)
.
(7)
Если домножить числитель и знаменатель на массу отдельной молекулы (формульной единицы) вещества, то
 .
(8)
.
(8)
Отсюда видно, что, если теперь в выражении (6) домножить числитель и знаменатель под корнем на NA, то
 ,
(9)
,
(9)
где
R
‒ универсальная газовая постоянная,
 ‒ молярная масса вещества (масса одного
моль вещества).
‒ молярная масса вещества (масса одного
моль вещества).
Таблица №2.2
Средняя скорость молекул некоторых газов
при 25 ºС
|
|
H2 |
СН4 |
N2 |
O2 |
CO2 |
|
|
|
|
|
|
|
|
|
2 |
16 |
28 |
32 |
44 |
|
|
|
|
|
|
|
|
υ, м/с |
1930 |
680 |
515 |
480 |
410 |
|
|
|
|
|
|
|
|
υ, км/ч |
6950 |
2450 |
1850 |
1730 |
1480 |
Анализом уравнений молекулярно-кинетической теории можно получить уравнения всех газовых законов. Мы же поступим иначе: покажем, как из частных газовых законов может быть получено Уравнение Клапейрона-Менделеева.
Таблица №2.3.
Сводная таблица частных газовых законов
|
Закон Бойля-Мариотта |
При фиксированной температуре и неизменном количестве идеального газа его объем обратно пропорционален давлению. |
VT,ν
= K1
∙
|
|
закон Гей-Люссака |
При фиксированном давлении и неизменном количестве идеального газа его объем прямо пропорционален температуре. |
VР,ν = K2 ∙ Т |
|
закон Авогадро |
В равных объемах различных газов, находящихся при неизменных температуре и давлении, находится равное число молекул, или при фиксированных температуре и давлении объем идеального газа прямо пропорционален его количеству. |
VР,Т = K3 ∙ ν |
Если какая-то функция пропорциональна нескольким величинам в отдельности, то она пропорциональна произведению этих величин:
V
= KΣ
∙
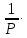 T
∙ ν
или
Р ∙ V
= KΣ
T
∙ ν
или
Р ∙ V
= KΣ
 T
∙ ν
или
Р
∙ V
= R
T
∙ ν
или
Р
∙ V
= R
 T
∙ ν.
(9)
T
∙ ν.
(9)
Теперь можно определить численное значение коэффициента пропорциональности KΣ, который называется универсальной газовой постоянной (R):
KΣ
=
R
=
 .
(10)
.
(10)
Так как по 2-му следствию из закона Авогадро 1моль идеального газа при температуре 0ºС (273К) и давлении 1атм (101.3 кПа) занимает объем 22.4 литра, то в системе СИ
R
=
 8.3144 Дж/моль∙К.
8.3144 Дж/моль∙К.
Из уравнения (9) следует, что объем одного моль идеального газа (молярный объем) при любых условиях, не нарушающих идеальности, может быть рассчитан:
 ,
(11)
,
(11)
тогда находим еще одну формулу для расчета количества вещества, но применимую только к идеальным газам и к тем реальным, которые по межмолекулярному взаимодействию мало отличаются от идеального:
 .
(12)
.
(12)
Таблица 10
Сводная таблица формул для расчета
количества вещества, полученных анализом газовых законов
|
|
Применима для расчета количества любых частиц (тел): молекул, атомов, электронов, звезд…. |
||
|
|
|
|
|
|
|
Применима для расчета количества любых веществ. |
||
|
|
Применима для расчета количества идеального газа и реальных с очень слабым межмолекулярным притяжением. |
||
|
|
|||
|
|
|
||
|
Варианты написания уравнения состояния идеального газа |
|||
|
|
|
|
|
|
|
P ∙ V = ν ∙ R ∙T |
P = СМ ∙ R ∙T |
|
Проектное задание
Используя представления о таких атомных свойствах, как энергия ионизации и электроотрицательность, а также учитывая характер их изменения в периодах, предложите объяснение закономерному изменению состава и структур простых веществ и оксидов (хлоридов), представленных в таблице №2.1.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 2
|
1. Все вещества в конечном итоге состоят из атомов, |
|
|
1. |
но структурной единицей веществ являются молекулы |
|
2. |
причем атомы являются и их структурными единицами |
|
3. |
но структурная организация веществ различна в зависимости от атомных свойств |
|
4. |
а атомы, в свою очередь, состоят из протонов и электронов |
|
|
|
|
2. Молекулы – это |
|
|
1. |
мельчайшая электронейтральная частица, состоящая из двух и более связанных атомов |
|
2. |
мельчайшие частицы, из которых состоят вещества в жидком и газообразном состояниях |
|
3. |
частицы, которые можно полностью идентифицировать, изучая законы их движения |
|
4. |
частицы, проявляющие все химические свойства молекулярных веществ |
|
|
|
|
3. Молекулярные вещества от ионных можно отличить по наличию таких биохимическим свойств, как |
|
|
1. |
запах |
|
2. |
окраска |
|
3. |
вкус |
|
4. |
все вышеперечисленное |
|
|
|
|
4. AlCl3 и Al2Cl6; CH2 и C2H4; Р2О5 и Р4О10 - это |
|
|
1. |
соответственно, правильные и неправильные формулы |
|
2. |
соответственно, неправильные и правильные формулы |
|
3. |
формулы мономерных и димерных частиц, стабильно существующих при обычных условиях |
|
4. |
формулы полимерной и молекулярной модификации вещества |
|
|
|
Бланк ответа
|
|
1 |
2 |
3 |
4 |
|
1 (5 баллов) |
|
|
|
|
|
2 (5 баллов) |
|
|
|
|
|
3 (5 баллов) |
|
|
|
|
|
4 (5 баллов) |
|
|
|
|
Критерии для самоконтроля степени усвоения материала модуля:
Оценка при выполнении теста: 6 – 10 баллов – удовлетворительно
11 – 16 баллов – хорошо
17 – 20 баллов - отлично.

 веществ,
г/моль
веществ,
г/моль