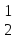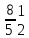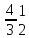- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Модуль №1 Основные понятия, основные законы химии
- •1.1 Основные понятия химии и законы сохранения
- •Первые химические термины
- •1.1.2 Закон сохранения массы.
- •Основные понятия химии и стехиометрические законы
- •1.2.1 Закон постоянства состава
- •1.2.2 Закон кратных отношений Атомистическая теория Дальтона
- •1.2.3 Закон небольших объемных отношений Гей-Люссака Молекулярная теория Авогадро
- •1.2.4 Реформа Канниццаро
- •Модуль №2 Основные положения атомно-молекулярного учения
- •2.1 Положение об атомном составе веществ
- •Положение о самопроизвольном связывании атомов
- •2.3 Положение о молекулах и молекулярном строении веществ
- •2.4 Положение немолекулярных веществах
- •2.5 Положение о тепловом движении атомов и молекул
- •Список литературы
- •Оглавление
2.4 Положение немолекулярных веществах
Атомы могут связываться в очень большие полимерные ассоциаты, которые, будучи очень крупными объектами, не могут участвовать в тепловом движении, а поэтому молекулами не являются (крупинки песка, поваренной соли, цинковые гранулы). Так устроенные вещества называются немолекулярными33. Единицу состава таких веществ называют формульной единицей. Единицей их структуры являются цепочечные, слоистые или трехмерные (объемные) элементарные фрагменты, регулярно продолжающиеся от "одного края" и до "противоположного края" кристаллического полимера34. Степень полимеризованности таких соединений зависит от нескольких факторов, важнейшими среди которых являются координационные числа (КЧ) атомов и степень ионности связей (структуры).
Координационное число атома (иона) – это число атомов (ионов), с которыми связана рассматриваемая частица. Молекулы состоят из ограниченного количества атомов. Это обязательно означает, что атомы в их составе имеют сравнительно низкие КЧ. В молекулах практически всегда имеются атомы, КЧ которых равно единице (концевые атомы). Чем меньше таких атомов в формульной единице вещества, тем более полимеризованной становится структура. В полимерных (немолекулярных веществах) КЧ атомов наоборот высокие (много мостиковых атомов).
Степень ионности (полярности) связи зависит от электроотрицательности атомов. Чем больше разность электроотрицательностей связанных атомов, тем легче они способны перераспределить между собой часть (или все валентные электроны). Межатомная связь в этом случае становится все более полярной. Усиление полярности (степени ионности) связей, предполагает растущую склонность к ненаправленному (делокализованному) взаимодействию, что, в свою очередь, предопределяет рост координационных чисел и переход к полимерным структурам.
Например,
СО и Н2О
содержат атомы неметаллических элементов,
которые по электроотрицательности
отличаются не так сильно, как атомы Na
и Ca,
с одной стороны, и F
и O
- с другой (CaO,
Na2O,
CaF2).
Поэтому оксид углерода (II)
– СО и вода – Н2О
являются ковалентными молекулярными
веществами
В
молекуле СО оба атома являются концевы-ми
(КЧ = 1), оксид углерода (II)
состоит из двухатомных молекул. В
молекуле Н2О
атом кислорода является мос-тиковым
(КЧ = 2), атомы водорода – концевыми
(КЧ = 1), вода состоит из трехатомных
молекул. В обычных условиях СО представляет
собой газ, т.к. соответствующие молекулы
друг к другу притягиваются плохо и
существуют обособленно. Вода является
жидкостью, т.к. молекулы Н2О
способны образовывать достаточно
прочные межмолекулярные водородные
связи. 
|
Рис.2.2 – Фрагмент структуры СаО (а) и CaF2 (б), Li2O (в). В структуре оксида кальция КЧ ионов равны 6. В кристалле CaF2 КЧ(Ca2+) = 8 (мелкие кружочки имеют кубическое окружение), КЧ(F‒) = 4 (крупные кружочки имеют тетраэдрическое окружение). Оксид Li2O имеет "обращенную" структуру CaF2: у катионов Li+ КЧ = 4, у анионов О2‒ КЧ = 8. |
Структуры приведенных на рис.2.2, веществ полимерны, показать их "целиком" нельзя. Для полимеров принято изображать фрагмент, который передает важнейшие особенности, закономерности структуры. В данном случае кристаллы полимеризованы в трех направлениях пространства.
Связность структуры (D) ‒ число направлений пространства, в которых развивается система равноценных (или мало отличающихся по энергии) связей, объединяющих атомы в полимерные цепи (D = 1), сетки (D = 2), каркасы (D = 3).
Более подробно эти вопросы будут разобраны в ходе подробного анализа теории строения веществ, а сейчас в таблице №2.1 приведены некоторые примеры для предварительного ознакомления. Видно, что структуры соединений закономерно меняются. С увеличением порядкового номера элемента постепенно уменьшаются КЧ атомов35, уменьшается степень полимеризованности веществ: трехмерные → сетчатые → цепочечные полимеры → соединения с молекулярной структурой.
Молекулярные и немолекулярные вещества могут иметь одинаковую (HCl ‒ NaCl (CaO)…, H2O ‒ Na2O…) или сходную стехиометрию (H2O – CaF2 (SiO2), SO2 ‒ Na2S). Но при этом нужно понимать, что формулы молекулярных веществ передают реальный состав молекул (HCl состоит из двухатомных молекул, H2O и SO2 ‒ из трехатомных). В то время как формулы полимерных соединений передают брутто состав кристаллов. Любая крупинка NaCl (CaO) состоит из колоссального числа атомов (ионов), причем, как следует из формул, катионов и анионов в структуре упомянутых кристаллов поровну (без учета
Таблица №2.1 Краткая информация о составе и структуре
некоторых соединений элементов III периода
(простые вещества, высшие оксиды, высшие хлориды)36
|
№ группы |
I |
II |
III |
IV |
V |
VI |
VII |
VIII |
|||||||||||||||
|
КЧ |
8+6 |
12 |
12 |
4 |
3 |
3 |
2 |
2 |
1 |
0 |
|||||||||||||
|
формульная единица |
Na |
Mg |
Al |
Si |
Pчерный |
P4 |
S8 |
Sпластическая |
Cl2 |
Ar |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
связность структуры |
D = 3 |
D = 3 |
D = 3 |
D = 3 |
D = 2 |
D = 0 |
D = 0 |
D = 1 |
D = 0 |
D = 0 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
КЧ |
4 8 |
6 6 |
6 4 |
4 2 |
4
|
4
|
4
|
4
|
3 1 |
4
|
|
||||||||||||
|
формульная единица |
Na2O |
MgO |
Al2О3 |
SiO2 |
P2O5 |
P4O10 |
SO3 (тв) |
S3O9 (ж) |
SO3 (г) |
Cl2O7 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
связность структуры |
D = 3 |
D = 3 |
D = 3 |
D = 3 |
D = 2 |
D = 0 |
D = 1 |
D = 0 |
D = 0 |
D = 0 |
|
||||||||||||
|
КЧ |
6 6 |
6 3 |
6 2 |
4 1 |
5 1 |
|
1 |
|
|||||||||||||||
|
формульная единица |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
PCl5 |
|
|
|
SCl6 |
|
|
|
Cl2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
связность структуры |
D = 3 |
D = 3 |
D = 2 |
D = 0 |
D = 0 |
не известен |
D = 0 |
|
|||||||||||||||
незначительного дефектообразования). В кристалле Na2O катионов вдвое больше, чем анионов, а в CaF2, SiO2 и Na2S, наоборот, вдвое больше анионов.