
- •Федеральное государственное образовательное учреждение высшего профессионального образования
- •Введение
- •Модуль №1 Основные понятия, основные законы химии
- •1.1 Основные понятия химии и законы сохранения
- •Первые химические термины
- •1.1.2 Закон сохранения массы.
- •Основные понятия химии и стехиометрические законы
- •1.2.1 Закон постоянства состава
- •1.2.2 Закон кратных отношений Атомистическая теория Дальтона
- •1.2.3 Закон небольших объемных отношений Гей-Люссака Молекулярная теория Авогадро
- •1.2.4 Реформа Канниццаро
- •Модуль №2 Основные положения атомно-молекулярного учения
- •2.1 Положение об атомном составе веществ
- •Положение о самопроизвольном связывании атомов
- •2.3 Положение о молекулах и молекулярном строении веществ
- •2.4 Положение немолекулярных веществах
- •2.5 Положение о тепловом движении атомов и молекул
- •Список литературы
- •Оглавление
Список литературы
-
Дей К., Селбин Д. Теоретическая неорганическая химия. // М.:Химия, 1976.–568с.
-
Коттон Ф., Уилкинсон Дж. Современная неорганическая химия. // М.:Мир, Т.1, 1969.–224с., Т.3, 1969.–593с.
-
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. // М.:Химия, 1987.–696с.
-
Ахметов Н.С., Общая и неорганическая химия, М., Высшая школа,1981.–679с.
-
Угай Я.А. Общая химия, М., «Высшая школа», 1977.–408с.
Оглавление
стр.
Аннотация ……………………………………………………………...…………3
Введение…………………………………………………………………………...4
Модуль №1 Основные понятия, основные законы химии…………………………..5
Комплексная цель………………………………………………………………...5
-
Основные понятия химии, законы сохранения…………………………………5
-
Первые химические термины…………………………………………5
-
Закон сохранения массы……………………………………………….8
-
-
Основные понятия и стехиометрические законы..………...………………….13
-
Закон постоянства состава……………………………………………13
-
Закон кратных отношений. Атомистическая теория Дальтона-Берцелиуса.…………………….18
-
Закон небольших объемных отношений Гей-Люссака. Молекулярная гипотеза Авогадро………………………………..…27
-
Реформа Канниццаро…………………………………………………30
-
Проектное задание……………………………………………………………...36
Тест рубежного контроля №1………….………………………………………36
Модуль №2 Основные положения атомно-молекулярного учения…………..........38
Комплексная цель………………………………………………………………38
2.1 Положение об атомном составе веществ…………………..………………..…38
2.2 Положение о самопроизвольном связывании атомов…..…………………….38
2.3 Положение о молекулах и молекулярных веществах..……………………….40
2.4 Положение о немолекулярных веществах…………………………………….42
2.5 Положение о тепловом движении атомов, ионов и молекул………………...47
Проектное задание…………...…………………………………………………51
Тест рубежного контроля №2………………………………………….………51
Список литературы……………………………………………………………………53
1 В переводе с древнегреческого атом означает "неделимый".
2 В 1745 г. М.В.Ломоносов писал: "При растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах из отверстия склянки выделяется горючий пар, который представляет собой флогистон". В 1766 г. английский химик Кавендиш, ничего не зная о работах Ломоносова, получил водород по реакции между железом и раствором серной кислоты и назвал его "горючим воздухом". В отличие от Ломоносова Кавендиш считал, что "горючий воздух" ‒ это соединение флогистона с водой.
3 Именно стремлением объяснить необычное изменение массы тел при их прокаливании на воздухе обусловлено одно из самых известных и самых критикуемых в большинстве современных учебных пособий положений об отрицательной массе флогистона!
4 Как будет показано ниже, все газообразные в обычных условиях вещества имеют молекулярное строение, такие вещества могут быть легче всего отделены от нелетучих, а в дальнейшем и друг от друга. Разделение газов может быть основано или на их избирательном растворении в жидкостях, или на разной склонности к сжижению.
5 В опытах Р.Бойля реторты часто взрывались за счет расширения воздуха, поэтому он обычно выполнял прокаливание в два этапа: вначале сильно прогревал открытую реторту с заранее взвешенной пластиной металла для удаления части воздуха, затем запаивал ее и прокаливал металл. Данные эксперименты были частью работ Бойля по изучению отношения различных веществ к нагреванию и поиску элементов, т.е. "веществ не способных к дальнейшему разложению". Кроме того представлял интерес и вопрос влияния на продукты прокаливания отсутствие непосредственного контакта металлов с пламенем. Наблюдавшееся в опытах появление окалины не противоречило бытовавшей в XVII веке алхимической точке зрения о том, что металлы представляют собой сложные тела (элементами, принципами считались сера, соль, ртуть). Однако сам Бойль такое превращение металлов, а также увеличение массы пластин объяснял присоединением огненной материи, которая, по его мнению, проходила сквозь поры стеклянной посуды в отличие от воздуха. Герметичность установки в отношении воздуха доказывало всасывание воздуха после вскрытия реторты, а сам факт всасывания Бойль объяснял тем, что перед запаиванием атмосфера реторты была разреженной за счет удаления части воздуха на первом этапе эксперимента.
6 При этом, соответственно, увеличивалась и общая масса.
7 Многие полагали, что воздух представляет собой некую не имеющую массы субстанцию. Газы, выделявшиеся в разнообразных реакциях, называли разными сортами воздуха (если, конечно, не возникало соблазна считать его, как, например, продукт взаимодействия металлов с растворами серной и соляной кислот, флогистоном).
8 В правой части выражения (1) второй сомножитель – квадрат скорости света в вакууме ‒ абсолютная константа. Поэтому изменение энергии может быть связано только с изменением массы тела (системы).
9
В термоядерных реакциях наблюдаются
колоссальные энергетические эффекты,
поэтому дефекты массы составляют весьма
значительную величину. Например, реакция
термоядерного синтеза, протекающая в
солнечной плазме, может быть суммарно
представлена в виде:
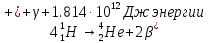 .
При этом каждые 4г водорода дают лишь
3.9998г продуктов (гелий и позитроны;
γ-частицы не имеют массы ни в покое,
ни в движении).
.
При этом каждые 4г водорода дают лишь
3.9998г продуктов (гелий и позитроны;
γ-частицы не имеют массы ни в покое,
ни в движении).
10 Важную роль в окончательном формировании новой теории стало установление состава воды (А.Л.Лавуазье совместно с Ж.Б.Менье) по реакциям ее разложения и синтеза.
11 Он полагал, что кислоты образуются при соединении кислотообразующего начала (оксиген – рождающий кислоту или кислород) и горючими веществами (неметаллами). Состав некоторых кислот, предложенный в работах Лавуазье, в современных обозначениях выглядит следующим образом: углекислота - СО2, азотная кислота - NO2, фосфорная кислота – Р2О5. Несколько лет Лавуазье безуспешно пытался обнаружить кислотные свойства у воды. В ходе этих экспериментов он установил объемные соотношения водорода и кислорода, выделяемых при разложении воды (22.9:12, т.е. почти 2:1), но не придал этому значения. Полагая, что и соляная кислота является кислородсодержащей, Лавуазье вынужден был предположить, что в ее состав в окисленном состоянии входит элемент "мурий". Это затруднило, на некоторое время отдалило правильную интерпретацию некоторых газовых законов (закона простых объемных отношений, закона А.Авогадро). Несколько позднее К.Л.Бертолле обнаружил, синтезировал две бескислородные кислоты (синильную и сероводородную), однако анализ соляной кислоты (точнее, ее радикала – "мурия") укрепил его во мнении, что из его состава может быть выделен кислород (примерно 13 масс.%). Этим выводам не противоречил тот надежно установленный Бертолле факт, что при поглощении "мурия" (хлора) горячими растворами щелочей получается смесь двух солей (хлорид и соль кислородсодержащей кислоты – хлорат), одна из которых (KClO3) и поныне называется бертоллетовой. Только в 1809г. Ж.Гей-Люссак высказал предположение, что "муриевая" кислота не содержит кислорода, а в 1810г. Г.Дэви это доказал экспериментально (как оказалось "мурий", в отличие от воды и других газообразных оксидов, не взаимодействовал с раскаленным углем). Только в 1812г. с этими выводами согласился и Бертолле, а по предложению Гей-Люссака название "мурий" было заменено на хлор.
12 Жизнь самого А.Л.Лавуазье оборвалась в 1794г. Он был казнен в годы Французской буржуазной революции. В 1796г посмертно реабилитирован.
13 В этом можно было убедиться по тому факту, что при действии избытка соляной кислоты на порцию соды одинаковой массы выделяется разный объем углекислого газа. Сейчас этот факт легко может быть объяснен тем, что из раствора Na2СО3 действительно в зависимости от ряда факторов кристаллизуются либо безводный карбонат, либо его кристаллогидраты: Na2СО3∙Н2О, Na2СО3∙4Н2О, Na2СО3∙7Н2О, Na2СО3∙10Н2О.
14 Немолекулярные вещества построены из огромного числа связанных в единый кристалл ионов, атомов. Как будет показано в теме "Химическая термодинамика", для таких систем очень характерно стремление к увеличению энтропии - S (проще говоря, к увеличению беспорядка). Вероятность дефектообразования сильно возрастает при нагревании, а синтез подобных соединений практически всегда предполагает использование высоких температур.
15 В состав таких веществ входят атомы только двух элементов. Позднее было показано, бертоллидами являются многие вещества и с более сложным элементным составом.
16 В этих участках кристалла структура несколько искажается, половина атомов Fe3+ перемещаются из октаэдрических позиций, характерных для ионов Fe2+ в Fe1-хO (Fe1-хO имеет дефектную структуру NaCl), в тетраэдрические.
17 Атомная структура веществ Дальтоном подразумевалась изначально, как и многими учеными того времени (достаточно вспомнить работы Бертолле о химическом сродстве). Другое дело, что размеры атомов предполагались настолько малыми, что вряд ли кто-то всерьез полагал, что их удастся в ближайшее время обнаружить прямыми экспериментами. В итоге, как показала практика, доказательство атомного строения веществ было получено по косвенным данным.
18 При этом Дальтон поначалу опирался на массовые соотношения компонентов сложных соединений (воды, аммиака, оксидов углерода, азота…), установленные во многих случаях А.Лавуазье и другими химиками. Первая таблица содержала сведения о 5 элементах и 9 сложных веществах.
19 Подобные символы элементов и формулы веществ были предложены несколько позднее шведским химиком Й.Я.Берцеллиусом и немецким ‒ Ю.Либихом.
20 В 1802г. Дальтон сформулировал закон парциальных давлений газов: Давление газовой смеси равно сумме парциальных давлений составляющих ее газов. В 1803г. независимо от У.Генри ‒ зависимость растворимости газов от их парциальных давлений в газовой смеси: Растворимость газа прямо пропорциональна его парциальному давлению над раствором (закон справедлив для не очень высоких давлений и при отсутствии сильных химических взаимодействий газа с растворителем).
21 Нетрудно убедиться, что эти соотношения несколько отличаются от истинных (известных в настоящее время).
22 Что стало поводом для поиска условий синтеза новых оксидов азота, состав которых соответствовал бы другим, в том числе недостающим, массовым соотношениям элементов. В 1808г. Дальтон демонстрирует справедливость закона кратных отношений уже на примере всех пяти оксидов.
23 Дальтон приписывал им другие формулы, предполагая, что данные газы состоят из двойных и тройных атомов.
24 Понятие валентность как свойство атомов, определяющее их способность связываться друг с другом в определенных количественных соотношениях, было предложено Г.Вихельхаусом в 1868г.
25 Не нужно путать такие вещества с твердыми растворами. Каждый из этих оксидов имеет отличную от других структуру: TiO0.68-0.75 (дефектная структура ε-TaN), Ti1±0.15O1±0.15 (дефектная структура NaCl), Ti2O3 (структура α-Al2O3), TiO1.75-1.90 (гомологический ряд оксидов состава TinO2n-1), TiO2 (рутил – сам является родоначальником для многих оксидов состава МеО2). Твердые растворы кислорода в титане имеют состав TiO0-0.5. Взаимное расположение атомов металла в их составе такое же, как и в структуре чистого титана. Атомы кислорода заселяют межатомные пустоты, поэтому такие твердые растворы часто называют фазами внедрения.
26 В 1811-1813гг. Гей-Люссак установил состав синильной кислоты, провел аналогию с галогеноводородами, сероводородом и пришел к выводу о решающей роли атомов водорода в специфических свойствах кислот.
27
Пользуясь принятыми в настоящее время
обозначениями, сравним молекулярные
и атомные массы водорода и кислорода.
Абсолютные значения плотностей обоих
газов могут быть найдены экспериментально.
При комнатных температурах и давлении
1атм. они составляют 0.082г/л и 1.309г/л,
соответственно.

Полагая, что в равных объемах находится одинаковое число (количество) молекул, получаем:
 ,
,
где
 Если атомная масса водорода принята
за 1, через соотношение молярных
масс получается, что атомная масса
кислорода равна 16.
Если атомная масса водорода принята
за 1, через соотношение молярных
масс получается, что атомная масса
кислорода равна 16.
28 Термин органическая химия впервые использовал Я.Берцеллиус в 1806г.
29 Достаточно сказать, что воде приписывали четыре разные формулы, а, скажем, уксусной кислоте – девятнадцать!!!
30
Идеальным
считается газ, объем которого устремляется
к нулю, как при сильном повышении
давления, так и при приближении
температуры к абсолютному нулю (0 К).
Оба эти критерия идеальности
согласуются
с уравнением Клапейрона-Менделеева (с
уравнением состояния идеального газа):
 .
Обращение объема газа в этих условиях
в ноль качественно подчеркивает
отсутствие межмолекулярного
взаимодействия. невозможность конденсации
(перевода в жидкое или твердое агрегатное
состояния).
.
Обращение объема газа в этих условиях
в ноль качественно подчеркивает
отсутствие межмолекулярного
взаимодействия. невозможность конденсации
(перевода в жидкое или твердое агрегатное
состояния).
31 Если верно утверждение о том, что в равных объемах различных газов при одинаковых условиях содержится равное число молекул, то будет справедливо и обратное – если взять равное число молекул разных газов и поместить их в одинаковые условия, то они займут равные объемы. Если теперь молекул взять вполне конкретное число (NA = 6.02∙1023 моль-1), и поместить их во вполне конкретные условия (Т = 273 К, Р = 1атм или 101.3кПа), то и объем окажется не просто одинаковым, а вполне конкретным (22.4л): он легко рассчитывается из уравнения состояния идеального газа, из уравнений молекулярно-кинетической теории газов.
32 Такие агрегатные состояния, бесспорно, указывают на молекулярную природу вещества и достаточно слабое межмолекулярное связывание (особенно в случае газов). При более сильном межмолекулярном притяжении такие вещества могут оказаться в обычных условиях и твердыми, но тогда обязательно легкоплавкими, порой легковозгоняющимися, т.е. перевести их в другие агрегатные состояния, заметно повысить подвижность молекул, нетрудно.
33 Отдельную промежуточную группу образуют органические полимеры естественного (жиры, белки, полисахара, каучук) и синтетического происхождения (полиэтилен, фенолформальдегидные смолы, резина). Их часто называют высокомолекулярными соединениями.
34 Особенности структуры неокристаллизованных гелеобразных, стекольных соединений будут рассмотрены позднее.
35 Координационные числа атомов в бинарном соединении АаВв связаны между собой соотношением КЧ(А)∙а = КЧ(В)∙в. Координационные числа, исходя из смысла этого понятия, могут быть только целочисленными. Если при расчете по приведенному выше соотношению получаются дробные числа, значит в данной структуре соответствующие атомы (в табл.№2.1 – это атомы кислорода в некоторых оксидах) отличаются друг от друга (неравноценны). Часть из них имеет чуть меньшее целочисленное значение КЧ, а другая часть – чуть большее и тоже целочисленное.
36 Из-за ограниченности места в таблице не приведена информация о структурных модификациях ряда веществ (Ркрасный, SiO2(стишовит), γ-Al2О3, Al2Cl6). В случае фосфора, серы и их оксидов первыми упоминаются самые стабильные при комнатной температуре формы.
