
- •Государственное образовательное учреждение высшего профессионального образования «Пензенский Государственный Университет»
- •5.1 Основные законы
- •6.1 История
- •Классическая механика
- •Основные понятия
- •Основные законы Принцип относительности Галилея
- •Законы Ньютона
- •Новое время
- •Новейшее время
- •Электромагнитное взаимодействие
- •Термодинамика
- •Разделы термодинамики
- •Физический смысл термодинамики Необходимость термодинамики
- •[Законы — начала термодинамики
- •Основные формулы термодинамики Условные обозначения
- •Формулы термодинамики идеального газа
- •Термодинамика сплошных сред
- •Статистическая физика
- •Основные понятия
- •Статистическая физика и термодинамика
- •Математические методы в статистической физике
- •Учёные и университеты
- •Достижения
- •Классические работы
- •Квантовая механика
- •История
- •Математические основания квантовой механики
- •Шрёдингеровское описание
- •Стационарное уравнение Шрёдингера
- •Неопределенность между координатой и импульсом
- •Неопределенность между энергией и временем
- •Необычные явления, мысленные эксперименты и парадоксы квантовой механики
- •Разделы квантовой механики
- •Интерпретации квантовой механики
- •Комментарии
- •Теория относительности
- •Область применения
- •Принятие научным сообществом
- •Специальная теория относительности
- •Общая теория относительности
Формулы термодинамики идеального газа
|
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) |
|
|
Изменение внутренней энергии газа |
|
|
Работа газа |
|
|
Средняя энергия молекулы газа |
|
|
Средняя кинетическая энергия молекулы газа: |
|
|
Внутренняя энергия газа |
|
|
Вывод формулы |
|
|
Теплоёмкость газа при постоянном объёме |
|
|
Вывод формулы |
|
|
Теплоёмкость газа при постоянном давлении |
|
|
Вывод формулы |
|
Выражение основных величин через термодинамические потенциалы
Все термодинамические потенциалы имеют свои канонические наборы переменных и используются для анализа процессов при соответствующих условиях. Так, для изотермических изохорических процессов (T,V = const) удобно использовать F(N,T,V), для изотермических изобарических (T,P = const) — G(N,T,P), а для изолированных систем (U,V = const) — S(N,U,V).
Термодинамический потенциал S(N,U,V) (энтропия)
-
 —
независимые переменные;
—
независимые переменные; -
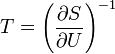 ;
; -
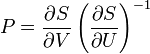 ;
; -
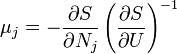 ;
; -
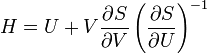 ;
; -
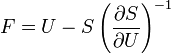 ;
; -
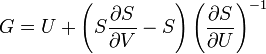 .
.
Термодинамический потенциал F(N,T,V) (свободная энергия Гельмгольца)
-
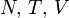 —
независимые переменные;
—
независимые переменные; -
 ;
; -
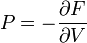 ;
; -
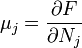 ;
; -
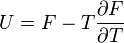 ;
; -
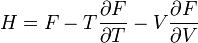 ;
; -
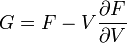 .
.
Термодинамический потенциал G(N,T,P) (энергия Гиббса)
-
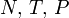 —
независимые переменные;
—
независимые переменные; -
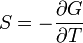 ;
; -
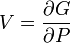 ;
; -
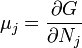 ;
; -
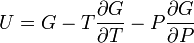 ;
; -
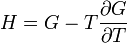 ;
; -
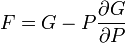 .
.
Термодинамический потенциал U(N,S,V) (внутренняя энергия)
-
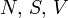 —
независимые переменные;
—
независимые переменные; -
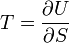 ;
; -
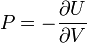 ;
; -
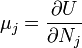 ;
; -
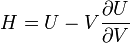 ;
; -
 ;
; -
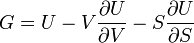 .
.
Уравнение Гиббса, экстенсивность и уравнение Гиббса — Дюгема
Выражение для полного дифференциала внутренней энергии называется уравнением Гиббса:
![]()
С использованием других термодинамических потенциалов уравнение Гиббса можно переписать в следующих эквивалентных формах:
![]()
![]()
Среди термодинамических величин выделяют экстенсивные (внутренняя энергия, энтропия, объём и др.) и интенсивные (давление, температура и др.) величины. Величина называется экстенсивной, если ее значение для системы, сложенной из нескольких частей, равно сумме значений этой величины для каждой части. Предположением об экстенсивности термодинамических величин, однако, можно пользоваться, если рассматриваемые системы достаточно большие и можно пренебречь различными краевыми эффектами при соединении нескольких систем, например, энергией поверхностного натяжения. Пусть U (экстенсивная величина) является однородной функцией первого порядка от своих экстенсивных аргументов (математическое выражение аксиомы экстенсивности): для любого α > 0
![]()
Для любой дифференцируемой однородной функции первого порядка Φ(x1,...,xn) выполняется теорема Эйлера:
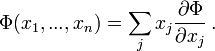
Для энергии U(N,S,V) теорема Эйлера имеет вид:
![]()
Отсюда легко следует уравнение Гиббса — Дюгема:
![]()
Это уравнение показывает, что между интенсивными переменными существует одна связь, являющаяся следствием предположения об аддитивности свойств системы. В частности, непосредственным следствием соотношений Гиббса-Дюгема является выражение для термодинамического потенциала Гиббса через химические потенциалы μi компонент смеси:
![]()
