
- •Физико-химические основы технологии электронных средств
- •Раздел 1. Химическая термодинамика
- •Введение
- •Внутренняя энергия. Как уже отмечалось уравнением ( ), внутренняя энергия является характеристической функцией при независимых переменных V и s, т. Е.
- •Энтальпия. Энтальпия является характеристической функцией при независимых переменных р и s, т. Е.
- •Раздел 2. Технологические процессы
- •1. Эпитаксия кремния Введение
- •1.1. Хлоридный метод
- •1.1.2.Кинетика и микромеханизм кристаллизации азс
- •1.1.3. Температурная зависимость скорости роста. Механизм хлоридного процесса.
- •1.1.4 Взаимосвязь условий формирования эпитаксиальных слоев и их структурных параметров.
- •1.2. Гидридный метод
- •1.2.1. Термодинамический анализ пиролиза силана.
- •1.2.2. Кинетика и микромеханизм кристаллизации аэс при пиролизе силана
- •1.2.3. Гетероэпитаксия кремния на сапфире
- •2.3. Диффузия из конечного ( ограниченного ) источника.
- •2.4. Методы осуществления диффузии.
- •2.5. Создание диодных структур.
- •2.6. Распределение примесей в транзисторной структуре.
- •3. Ионное легирование
- •3.1. Теоретические сведения
- •3.2. Распределение концентрации примеси в слое.
- •3.3. Образование радиационных деффектов.
- •3.4. Отжиг легированных структур.
- •3.5. Формирование диодных и транзисторных структур.
- •3.6. Оборудование для ионного легирования.
- •3.7. Преимущества и недостатки ионного легирования
- •4. Метализация
- •4.2. Конденсация.
- •4.3. Влияние температуры и пересыщения на скорость роста пленки
- •Исходные данные для расчетов при металлизации по кремнию
- •4.4. Установка для металлизации.
- •5. Формирование химических источников тока
- •5.1. Теоретические предпосылки
- •5.2. Термодинамика гальванического элемента.
- •5.3. Температурная зависимость э.Д.С.
- •5.4. Зависимость э.Д.С. От концентрации электролитов
- •Литература
Раздел 2. Технологические процессы
1. Эпитаксия кремния Введение
Эпитаксия (от греческого "эпи"(epu)-"на" и "таксис" (taxus)- формы прошедшего времени от глагола "тайкен" (taueu)-располагать в порядке) заключается в осаждении атомарного полупроводника на монокристаллическую подложку из того же (гомоэпитаксия) или другого (гетероэпитаксия) материала с близкой кристаллической структурой и высокой степенью химического сродства, осуществляемого таким образом, чтобы растущая пленка достраивала кристаллическую структуру подложки.
Химические реакции, происходящие в газовой фазе над кристаллом-подложкой или на поверхности кристалла, а затем эпитаксиальной пленки должны обеспечить выделение моноатомов вещества, так как в случае осаждения конгломератов свойства пленки ухудшаются. Процесс эпитаксии, т.е.образование монокристалла из одноатомного пара, происходит самопроизвольно, так как свободная энергия системы кристалл-пар при этом уменьшается и выделяется энергия, равная энергии атомизации:
Si(g) = Si(S) + 452,2 кДж/моль
В зависимости от используемых реагентов и типа основной химической реакции выделения моноатомов различают следующие методы получения эпитаксиальных структур:
1)Термическое разложение соединений (гидридный).
2)Диспропорционирование до четырехвалентных соединений(иодидный).
3)Восстановление хлоридов (хлоридный).
Наибольшее применение получили хлоридный и гидридный методы.
1.1. Хлоридный метод
Хлоридный метод имеет большое значение в технологии микроэлектроники, поскольку является в настоящее время единственным промышленным методом, позволяющим получать АЭС кремния с параметрами, полностью удовлетворяющими требованиям современной микроэлектроники. Широкое применение этого метода связано с доступностью получения в промышленных масштабах высокочистого тетрахлорида кремния и водорода, изученностью процесса восстановления кремния из тетрахлорида, сравнительно низкими затратами, относительной безопасностью процесса и возможностью управления его основными параметрами.
Процесс осуществляется в системе проточного типа (рис.1), рост АЭС из паро-газовой смеси (SiCl4+ H2) происходит на поверхности кремниевой подложки, разогретой до температуры выше 1373 К.

Рис.1 Вертикальная реакционная камера: 1-окно дляфотопирометра; 2,7-уплотняющие фланцы;
3-кварцевый реактор; 4-индук-тор; 5-пьедестал в виде трехъярусной пирамиды; 6-подложка.
Парогазовая смесь получается насыщением водорода парами тетрахлорида кремния при пропускании водорода через испаритель. Легирование эпитаксиальных слоев осуществляется контролируемым введением паров легколетучих соединений элементов 111 и V групп периодической системы в парогазовую смесь (SiCl4+ H2). Способы легирования могут быть различными:
-введение легатуры непосредственно в SiCl4;(BCl3,PCl3 и др.);
-использование системы двух испарителей - тетрахлорида кремния и легирующей добавки (ВС13, РС13, АsС13 и др.);
-использование гидридов легирующих элементов (В2Н6, РН3, АsН3).
Подложки, на поверхности которых идет процесс автоэпитаксии, нарезаются из монокристаллических слитков кремния, рабочая поверхность по чистоте соответствует 14-му классу обработки. Непосредственно перед процессом нанесения подложки подвергаются травлению в ПГС (НС1+Н2).
Большое значение для получения высококачественных АЭС кремния имеет содержание примесей в исходных материалах. Используемый тетрахлорид кремния должен иметь суммарное содержание примесей менее 10%(по массе), содержание влаги в водороде соответствует "точке росы" не выше 208К.
Качество АЭС кремния и экономичность процесса в целом определяются правильным выбором технологических условий - температуры, состава исходных компонентов, подаваемых в реактор, их количества. Физико-химические исследования дают возможность правильно установить оптимальные условия проведения процесса. При этом выясняют три основных вопроса:
-строение, характер и структуру взаимодействующих фаз и границ раздела;
-условия, при которых возможны относительные состояния равновесия системы;
-скорость и путь, по которому система стремится к равновесию.
Для решения этих вопросов физическая химия применяет два метода - молекулярно-кинетический и термодинамический.
Термодинамический анализ позволяет определить принципиальную осуществимость реакции в интересующем нас процессе и предельно возможный выход продуктов реакции в выбранных условиях.
1.1.1.Термодинамический анализ системы SiCl4+ H2.
Основная задача термодинамического анализа - определить максимально возможный выход элементарного кремния в зависимости от температуры и состава ПГС. Общая реакция процесса имеет вид
SiCl4 + 2H2 <===> Si + 4HCl
Рассчитать истинный выход продуктов реакции, состав равновесной смеси по общему уравнению реакции не представляется возможным, поскольку при этом нельзя учесть продукты промежуточных стадий процесса, присутствующие в зоне реакции в момент равновесия. Для выполнения расчетов необходимо знать механизм процесса, т.е. совокупность элементарных стадий, из которых состоит процесс.
Познание механизмов химических реакций относится к числу сложных проблем. Главная трудность заключается в определении природы одного из трех типов состояний, участвующих в реакционном процессе. В общем виде течение реакции можно изобразить следующим образом: исходные реагенты --> переходные состояния --> продукты реакции.
Только исходные реагенты и продукты реакции являются стабильными химическими соединениями, свойства которых можно изучить экспериментальным путем. Соображения относительно переходных состояний являются не следствием прямого наблюдения, а основываются на косвенных данных. Учитывая это, механизм реакции справедливо считать лишь наилучшей гипотезой, которая может быть предложена на основании имеющихся в наличии данных.
Обсуждение механизма реакции уместно начать с термодинамической оценки вероятности протекания реакций, возможных в выбранных условиях в исследуемой системе. Для этого рассчитывается величина уменьшения свободной энергии системы G для изотермического изменения состояния, которое согласно уравнению G =H -S, определяется изменением энтальпии Н и энтропии S. Хорошее экспериментальное подтверждение находит механизм процесса взаимодействия тетрахлорида кремния с водородом, который может быть представлен состоящим из следующих элементарных стадий:
SiCl4(g) + H2 <==> SiHCl3(g) + HCl (1.1)
SiHCl3(g) <==> SiCl2(g) + HCl (1.2)
SiCl2(g) <==> 1/2 Si(s) + 1/2 SiCl4(g) (1.3)
SiCl2(g) + H2 <==> Si(s) + 2HCl (1.4)
Для расчета выхода продуктов реакций прежде всего используются константы равновесия kp этих реакций, которые рассчитывают из уравнения
lnKP = - ΔZT /RT
Значения констант равновесия реакций (1-4) представлены в таблице
Таблица
-
Т, К
Номер реакции
1
2
3
4
1273
0,2
0,00115
71,0
1,74
1373
0,457
0,025
10
1,2
1473
0,63
0,12
3,8
1,0
1573
0,78
0,48
1,66
0,84
1673
1,0
1,67
0,657
0,72
Если концентрация каждого вещества в момент равновесия удовлетворяет всем уравнениям равновесия для реакций, возможных в данном процессе, то, решая составленную таким образом систему уравнений относительно всех неизвестных, получают значения равновесных концентраций продуктов данного процесса. При расчете необходимо учитывать только независимые реакции, т.е. те константы равновесия которых нельзя получить из констант равновесия других реакций, возможных в данном процессе. Только в этом случае число уравнений будет равно числу неизвестных.
Если количество молей компонентов в момент равновесия обозначить n(HCl3)-m1, n(HCl)-m2, n(SiCl4)-m3, n(SiCl2)-m4, n(H2)-m5, n(Si)-m6, то сумма молей в газовой фазе в момент равновесия
Σm = m1 + m2 + m3 + m4 + m5
и уравнения констант равновесия реакций, протекающих при взаимодействии SiCl4 c H2, можно записать следующим образом:
![]() ;
;
![]()
![]()
![]()
Поскольку Кp1 Кp2 Kp32 = Kp4 , то мы располагаем только тремя уравнениями с шестью неизвестными. Недостающие три уравнения получаем, составляя уравнение баланса для кремния, водорода, хлора (числа молей до достижения равновесия и в момент равновесия равны).
Для молярного отношения [Н2:SiCl4] = N:1 уравнения баланса имеют вид:
по кремнию
1 = m1 + m4 + m3m6;
по водороду
N = 0,5m1 + 0,5m2 + m5;
по хлору
2 = 1,5m1 + 0,5m2 + 2m3 + m4.
Полученная система из шести уравнений с шестью неизвестными приводится к двум уравнениям с двумя неизвестными
m2(2N - 2m5 - m2)
Kp32Kp1 m5[2 - 3N - 2 --------------------- + m2 + 3m5]2 -
K1 m5
(2N - 2m5 - m2)m2
-(2N - 2m5 - m2)m2[(2m5 + m2 - N + 2) - ------------------------ ]=0 (1.5) Kp1 m5
2m2(2N - 2m5 - m2)
m22 - Kp4[2 - 3N ------------------------- + m2 + 3m5]m5 = 0 (1.6)
Kp1 m5
Совместное решение уравнений позволяет определить равновесные концентрации всех продуктов процесса(рис.2).
Выход элементарного кремния, рассчитанный данным способом, изменяется с изменением температуры и состава ПГС следующим образом. Как видно из рис.2а максимальный выход элементарного кремния из ПГС [SiCl4+ H2] следует ожидать при температуре около 1473К и мольном отношении Н2:SiCl2, большем, чем 200:1. Элементарный кремний практически не образуется, если мольное отношение SiCl4: H2 ниже, чем 1:5. С увеличением температуры и по мере разбавления ПГС водородом возрастает доля НС1 в газовой смеси и соответственно снижается доля SiCl4.
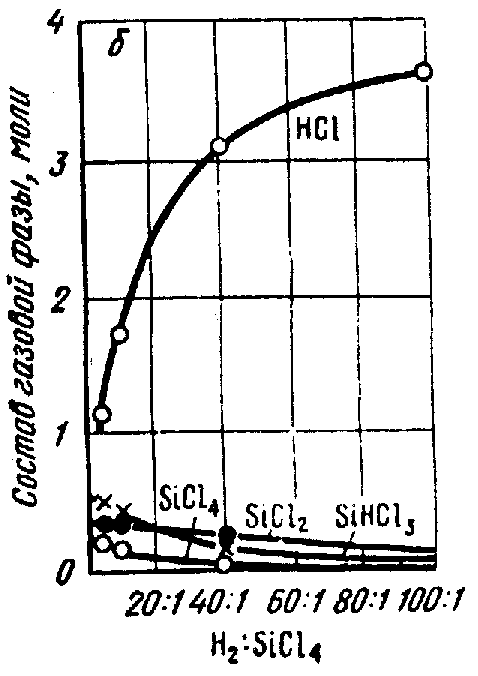

Рис.2 Влияние температуры и состава паро-газовой смеси на выход продуктов химического взаимодействия в хлоридном процессе: а)-выход элементарного кремния; б)-в)-изменение равновесного состава газовой фазы в зависимости от молярного соотношения Н2:SiCl4 при температуре 1473 К и от температуры при Н2:SiCl4 = 40:1 соответственно.
Для определения условий, при которых достигается равновесие, и для оценки соответствия равновесных концентраций рассчитанным теоретически проводится ИК спектроскопия газообразных продуктов реакций. Тетрахлорид кремния дает пик поглощения при длине волны 1040 см-, трихлорсилан имеет много пиков, из которых наиболее заметны пики при 2270 и 1610 см соответственно для малых и высоких концентраций. Наиболее отчетливый пик дихлорсилана (SiH2Cl2) наблюдается при 883см, хотя частично перекрыт более сильным пиком (SiHCl3) при 800 см. Метод ИК-спектроскопии позволяет определять содержание тетрахлорида кремния и трихлорсилана до 1-2%, а дихлорсилана - до 5%. Субхлорид кремния SiCl2 в газовой фазе не обнаруживается, т.к. он имеет очень малое время жизни и при понижении температуры быстро полимеризуется в жидкие продукты типа SinCl2n 2 и H2SinCl2n. Эти продукты имеют низкое давление насыщенного пара и их анализ очень сложен.
