
- •Загальні правила роботи в мікробіологічній лабораторії
- •Дезінфекція
- •Причини пожежі у мікробіологічній лабораторії і способи її гасіння
- •Правила безпечної роботи із застосуванням пального
- •Невідкладна медична допомога в лабораторії
- •Лабораторна робота № 1
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 2
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 3
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 4
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 5
- •Порядок виконання роботи
- •1. Фарбування капсул
- •2. Виявлення ендоспор у бактерій
- •3. Визначення внутрішньоплазматичних включень бактерій
- •Лабораторна робота №6
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 7
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 8
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 9
- •Теоретичні положення
- •Виділення чистих культур за методом Коха
- •Порядок виконання роботи
- •Лабораторна робота № 10
- •Теоретичні положення Метод кількісного обліку мікроорганізмів на твердих середовищах
- •Підрахунок чисельності кліток мікроорганізмів у рахункових камерах
- •Порядок виконання роботи
- •Лабораторна робота № 11
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 12
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 13
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 14
- •Теоретичні положення
- •Порядок виконання роботи:
- •Лабораторна робота № 15
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота № 16
- •Теоретичні положення
- •Порядок виконання роботи
- •Лабораторна робота №17
- •Порядок виконання роботи
- •Лабораторна робота №18
- •Теоретичні положення
- •Порядок виконання роботи
- •Додатки Додаток 1 (до лр №1) Правила роботи із культурами мікроорганізмів
- •Будова бактеріальної клітини
- •Способи стерилізації живильних середовищ, посуду й інших лабораторних матеріалів
Лабораторна робота № 11
Тема: Дослідження культуральних властивостей мікроорганізмів. Перевірка чистоти культур
Мета: Визначити характер росту мікроорганізмів на твердому живильному середовищі. Описати отримані колонії мікроорганізмів, що засіяні на попередньому занятті. Провести мікроскопічне дослідження мазків різних колоній, забарвлених за Грамом. Пересіяти мікроорагнізми вивчених колоній на косий агар для виділення чистих культур.
Матеріали й устаткування: колонії мікроорганізмів на твердих середовищах у чашках Петрі, мікробіологічні пробірки зі стерильним скошеним сусло-агаровим середовищем, МПА, вівсяним агаром, спиртівка (брикети сухого пального), мікробіологічна петля, мікроскоп МБР, предметні і покривні стекла, барвники для фарбування за Грамом – генціанвіолет, фуксин, розчин Люголя, 96% -ний спирт, пробірки, поплавці, (трубочки діаметром 5-7 мм, довжиною 35-45мм, запаяні з одного кінця), ваги, пептон, К2НРО4, агар, індикатор бромкризолпурпур чи бромтимолблау (1,6 % -ний спиртовий розчин), вуглеводи (глюкоза, лактоза, маніт, сахароза й ін.).
Теоретичні положення
До культуральних, чи макроморфологічних, властивостей відносяться характерні риси росту мікроорганізмів на твердому й рідкому живильному середовищах. На поверхні твердих живильних середовищ мікроорганізми можуть рости у вигляді характерних колоній, чи штрихів суцільного газону. Колонією називають ізольоване скупчення кліток одного виду, що виросло в більшості випадків з однієї клітини. У залежності від того, де росте мікроорганізм ( на поверхні густого живильного середовища, в товщі її чи на дні судини), розрізняють поверхневі, глибинні і донні колонії. Колонії, що виросли на поверхні середовища, відрізняються великою різноманітністю і є найбільш істотною особливістю росту багатьох мікроорганізмів на твердому субстраті. В описі колоній враховують наступні ознаки: форму, профіль, край, структуру, розмір, поверхню, колір колонії. Культуральні властивості є діагностичними для ідентифікації мікроорганізмів.
Чистота культури мікроорганізмів повинна бути ретельно перевірена. Це здійснюється, як правило, декількома способами – візуальним (дослідження колоній), мікроскопічним контролем і висівом на ряд живильних . середовищ
Звичайно колонії з кліток чистої культури, що висіяна на густе середовище, схожі одна на іншу, що є доказом чистоти культури (але є виключення, наприклад, у випадку дисоціації колоній на гладкі (S -) і складчасті (R - форми).
Інший критерій чистоти культури – це морфологія кліток. Для чистої культури характерний високий ступінь морфологічної подібності кліток у забарвлених препаратах. Однак бувають виключення у залежності від віку культури, використовуваного середовища й інших умов росту.
Порядок виконання роботи
-
Переглянути колонії на чашках Петрі. Колонії, що виросли на твердому живильному середовищі, проглянути спочатку неозброєним оком чи через лупу. Потім помістити чашки на столик мікроскопа нагору дном і вивчити колонії у прохідному світлі з об'єктивом 8х. Відзначити, описати й замалювати переважні форми (3-5 видів), вибираючи ізольовані колонії. Опис колоній проводять за схемою, що наведена нижче. Ознаки колоній заносять у таблицю 2.2.
В описі колоній враховують наступні ознаки:
Форму колонії (рис. 2.9) – округла, амебоподібна, ризоїдна, неправильна і т.д.
Структура колонії (рис. 2.10.) – однорідна, дрібно- чи грубозерниста, струминна і т.д.
Розмір (діаметр) колонії вимірюють у мм; якщо розміри колонії не перевищує 1 мм, то їх називають крапковими.
Оптичні властивості (блиск і прозорість) колонії – блискуча, матова, тьмяна, борошниста, прозора, напівпрозора, непрозора, флуоресціююча.
Колір колонії – безбарвна (грязно-білі колонії відносять до безбарвних) чи пігментована – біла, жовта, золотава, жовтогаряча, бузкова, червона, чорна і т.д. В описі колоній актиноміцетів відзначають пігментацію повітряного і субстратного міцелію. Особливо відзначають виділення пігменту в субстрат.
Поверхня колонії – гладка, шорсткувата, борозниста (горбиста), складчаста, зморшкувата, із концентричними колами чи радіально покреслена.
Профіль колонії (рис. 2.11) – плоский, опуклий, кратероподібний, конусоподібний.
Край колонії (рис. 2.12) – рівний, хвилястий, зубцюватий, торочкуватий і т.д.
Консистенцію колонії визначають, доторкаючись до її поверхні петлею. Колонія може легко зніматися з агару, бути густою, м'якою чи такою, що вросла в агар, слизуватою (прилипати до петлі), тягучою, плівчастою (знімається цілком), тендітною (легко ламається за умов дотику петлею).
Край і структуру колонії визначають із невеликим збільшенням мікроскопа. Для цього чашку поміщають на столик мікроскопа кришкою вниз. Консистенцію визначають під час відсівання колоній, доторкаючись до поверхні петлею.

Рис. 2.9 -. Форма колоній:
1 – кругла; 2 – кругла з фестончастим краєм; 3 – кругла з валиком; 4 і 5 – ризоїдні; 6 – із ризоїдним краєм: 7 – амебоподібна; 8 – нитковидна; 9 – складчаста; 10 – неправильна; 11 – концентрична; 12 – складна.
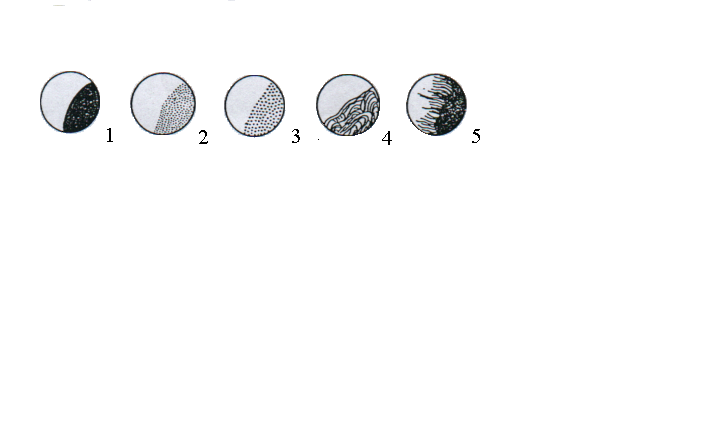
Рис. 2.10 - Структура колоній:
1 – однорідна; 2 – дрібнозерниста; 3 – грубозерниста; 4 - струминна; 5 – волокниста.

Рис. 2.11 - Профіль колонії:
1 – вигнутий; 2 – кратероподібний; 3 – горбистий; 4 – колонія, що вростає у субстрат; 5 – плоский; 6 – опуклий; 7 – краплеподібний; 8 –конусоподібний.

Рис. 2.12 - Край колонії:
1 – гладкий; 2 – хвилястий; 3 – зубцюватий; 4 - лопатевий; 5 – неправильний; 6 – війчастий; 7 – нитчастий; 8 – ворсинчастий; 9 – гіллястий.
Розміри й деякі інші особливості колоній змінюються з віком і залежать від складу середовища, тому в їхньому описі указують вік культури, склад середовища й температуру культивування.
Здатність до емульгування – рівномірна чи зерниста суспензія у воді, слабко чи зовсім не суспендується у воді.
-
Після опису колонії піддаються мікроскопічному дослідженню. З кожної групи колоній, що виросли на густих середовищах, для вивчення морфології і тинкторіальних властивостей мікроорганізмів приготувати препарати «роздавлена крапля», виконати мазки й забарвити за Грамом. Препарати переглянути з об'єктивами 40х і 90х, відзначити форму й сполучення кліток, наявність чи відсутність спор, визначити, до яких морфологічних груп мікроорганізмів вони відносяться. Мікроскопічну картину замалювати.
-
Зробити підрахунок колоній, що виросли з посівів ґрунтових розведень, за результатами підрахунку визначити чисельність мікроорганізмів в 1 м ґрунти (формула 2.2).
-
Здійснити третій етап виділення чистої культури.
Для одержання чистих культур мікроорганізмів зробити відсівання з трьох колоній з чашок Петрі в пробірки зі стерильнним скошеним агаризованим середовищем. Під час пересівання мікроорганізмів на косий агар необхідно петлею відібрати культуру тільки з відзначеної досліджуваної колонії, не торкаючись найближчих. Посівний матеріал легким штрихом утирають у скошену поверхню живильного середовища. Для кожної колонії використовувати окрему пробірку.
Ріст за штрихом – одна з культуральних ознак, необхідна для ідентифікації мікроорганізму.
-
Засіяні пробірки підписати й поставити в термостат на культивування за режимами, що залежать від виду мікроорганізму (температура від 20 до 37°С, час культивування – від 2 до 7 діб). Результати всіх посівів розглянути на наступному занятті.
-
Приготувати живильні середовища для одержання короткого кольорового ряду з метою наступного вивчення біохімічних властивостей виділених чистих культур.
Для визначення здатності мікроорганізмів використовувати вуглеводи готують основне фонове середовище, що найчастіше має наступний склад (г/л): пептон –5,0; К2НРО4 – 1,0; для одержання напіврідкого середовища додати агар – 5,0 г/л. До основного фону додають індикатор із розрахунку 2 мл 1,6 %-ного спиртового розчину на 1 л середовища. Як індикатор застосовують бромтимолблау, що змінює забарвлення від жовтого до синього в інтервалі рН 6,0-7,6, чи бромкрезолпурпур, що змінює колір від пурпурного до жовтого в інтервалі рН 5,2-8,6.
Основний фон розливають у пробірки по 9 мл, опускають на дно кожної пробірки поплавець (у випадку рідкого середовища) і стерилізують тиском 1 атм.
Вуглеводи (глюкоза, лактоза, маніт, сахароза й ін.) готують у виді 10 %-них розчинів і стерилізують окремо від основного фонового середовища автоклавуванням тиском 0,5 атм. Стерильні розчини додають до основного фону перед посівом мікроорганізмів в такій кількості, щоб концентрація цукру в середовищі складала 1 г на 100 мл.
Приготувати стовпчики з МПА і МПЖ для наступного дослідження відношення мікроорганізмів до кисню і протеолітичної активності. МПЖ готують, додаючи 10-15 г желатини до 100 мл МПБ, залишають на 30 хвилин для набрякання, нагрівають на водяній бані до повного розчинення желатини, розливають у пробірки по 10 мл, стерилізують тиском 0,5 атм 15 хв. Середовище розливають у кілька пробірок на ½ її висоти і стерилізують тиском 1 атм.
Оформити протокол роботи.
