- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
Лекция 4 Фенолы
Это производные ароматических УВ, в которых один или несколько атомов Н замещены на –ОН группу.
|
|
|
|
|
|
|
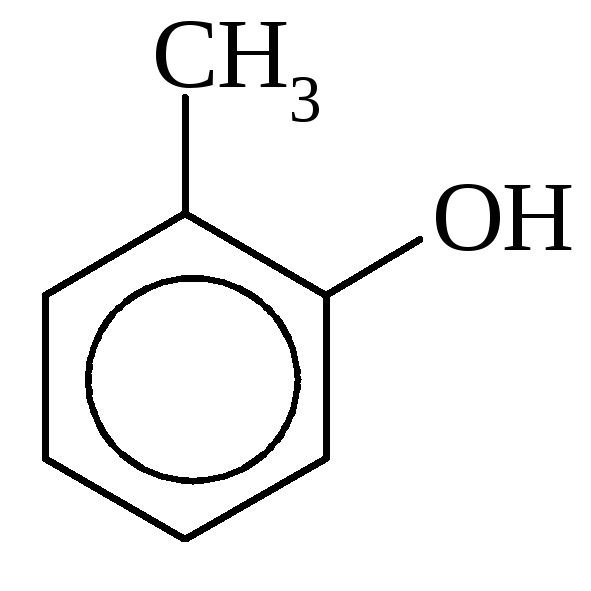
Ф |
I-Гидрокси- 2-метилбензол, О-крезол |
I-Гидрокси-3-метилбензол, М-крезол |
I-Гидрокси-4-метилбензол, n-крезол |
Бензиловый спирт |
Изомеры положения
Двухатомные фенолы:
|
|
|
|
|
|
|
Пирокатехин, 1,2-Дигидрокси- бензол |
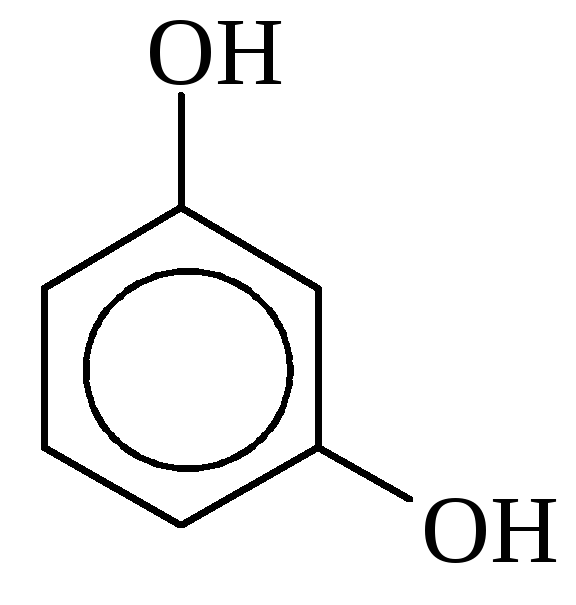
|
Резорцин, 1,3-Дигидрокси- бензол |
|
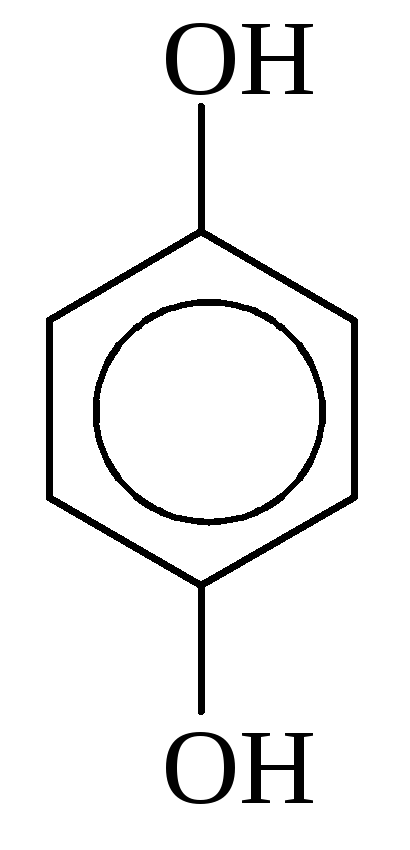
Гидрохинон, 1,4-Дигидрокси- бензол |
|
| ||||
|
Изомеры положения | ||||
Трехзамещенные
фенолы: рядовой (пирогаллол), симметричный
и несимметричный. 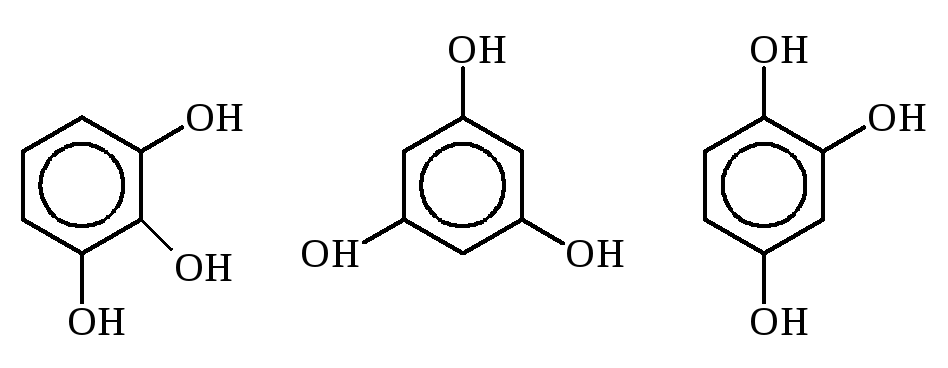
Пирогаллол
Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13:
Фенол Фиолетовое, Гидрохинон Грязно-зеленое,
Пирокатехин Зеленое, Пирогаллол Красное.
Резорцин Фиолетовое,
С троение
молекулы
троение
молекулы
Связь
очень прочная
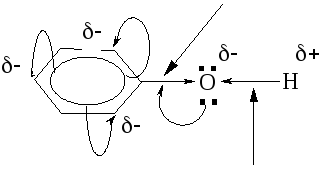
. . ..
H
Связь
менее прочная
–ОН группа проявляет + М >, чем –I, являясь ЭД.
Р-ции SЕ протекают легко за счет +М гр. –ОН, р-ции SN не характерны.
Химические свойства
I. Реакции замещения Н в группе –ОН
Это проявляется при образовании фенолятов, простых и сложных эфиров.
1) Фенолы за счет р, -сопряжения являются более сильными к-тами, чем спирты и образуют соли (феноляты) в р-циях с Ме, МеОН и даже солями:
С6Н5ОН + NаОН С6Н5ОNа + Н2О
Фенолят натрия,
феноксид натрия
Однако фенолы более слабые к-ты, чем Н2СО3, поэтому при действии Н2СО3 (СО2 + Н2О) и др. к-т феноляты легко разлагаются и обратная р-ция не возможна.
С6Н5ОNа + СО2 + Н2О С6Н5ОН + NаНСО3
3С6Н5ОН + FеС13 (С6Н5О)3Fе + 3НС1
Фиолетовое окрашивание
|
2) |
Простой эфир |
На практике используют феноляты.
|
3) |
Сложный
эфир |
|
|
4) Р-ция восстановления с цинковой пылью при нагревании:
С6Н5ОН
+ 3Н2
![]() С6Н12
+ ZnО
С6Н12
+ ZnО
Р-ции по –ОН группе не характерны!
II. Р-ции по бензольному кольцу (SЕ)
–ОН группа – ориентант I рода, облегчает р-ции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и пара- положения:
3HBr
Пикриновая к-та близка по силе (степени диссоциации) к соляной к-те, т.к. содержит три ЭА группы, усиливающие кислотность.
Механизм р-ции бромирования:
-
а)


1) Поляризация 2) -комплекс
-
б)
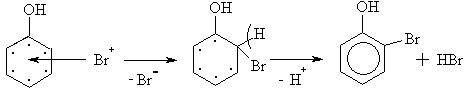 3)
-комплекс
3)
-комплекс
4. Р-ция конденсации


Фрагмент
фенолоформальдегидной
смолы
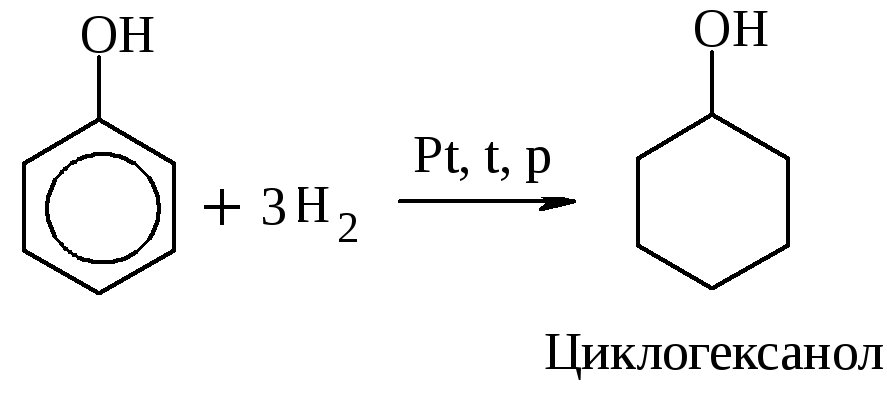
Р-ция гидрирования
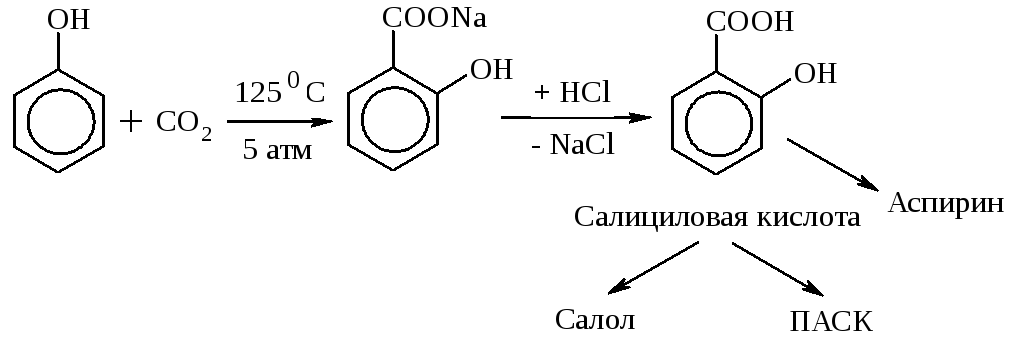
6. Из фенолята натрия легко получается салициловая к-та (важный продукт фармацевтической промышленности):
Фенол и его производные обладают дезинфицирующим свойством. Резорцин – антисептик при кожных заболеваниях. Карболовая к-та – 3%-ный раствор фенола – для дезинфекции хирургических инструментов. Пирокатехин применяется для синтеза адреналина – гормона надпочечников. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей.
Увеличение групп –ОН в фенолах увеличивает их активность в р-циях SЕ. Такие фенолы очень легко окисляются, являясь хорошими восстановителями (гидрохинон в фотографии). Двухатомные фенолы легко окисляются под действием слабых окислителей [FеС13, Аg2О, Сu(ОН)2] и даже кислородом воздуха, образуя хиноны. Последние легко восстанавливаются в дигидрохиноны:
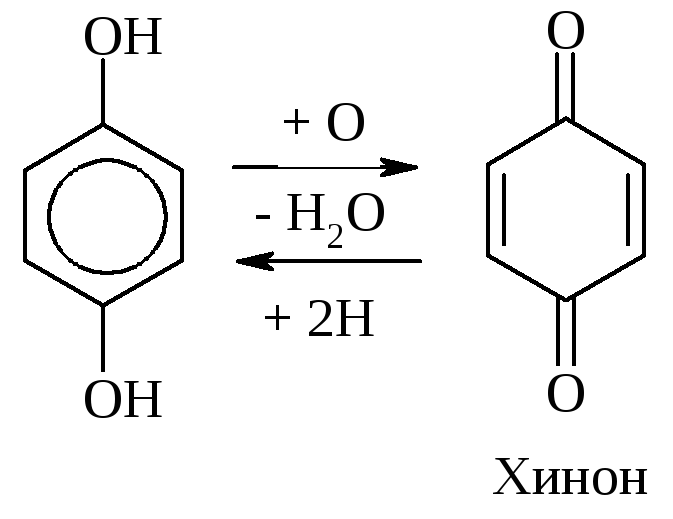
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.





 енол
енол