- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
С
Простой эфир
 Н3СН2+
+
Н3СН2+
+

СН3СН2+
СН3СН2+
![]()
Н
Н
![]() СН3СН2ОR
СН3СН2ОR
Это р-ция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2.
По такому механизму легче реагируют третичные спирты.
Р-цией SЕ по отношению к молекуле спирта является р-ция образования сложных эфиров с органическими и минеральными к-тами:
R – О Н + Н О –
– О Н + Н О –
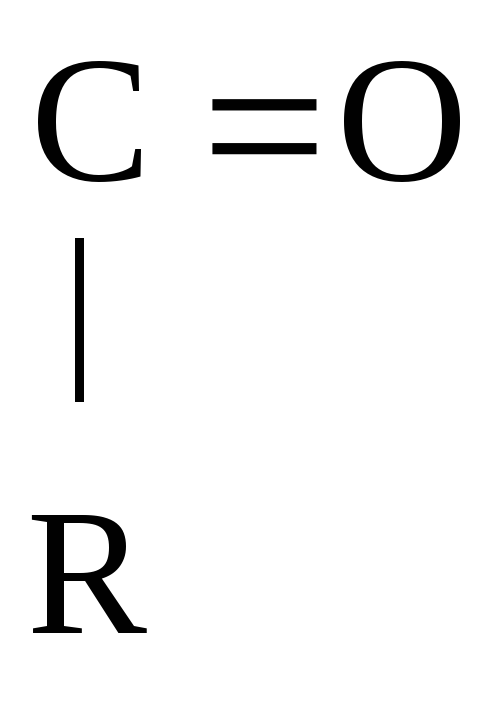
![]() R
– О –
R
– О –
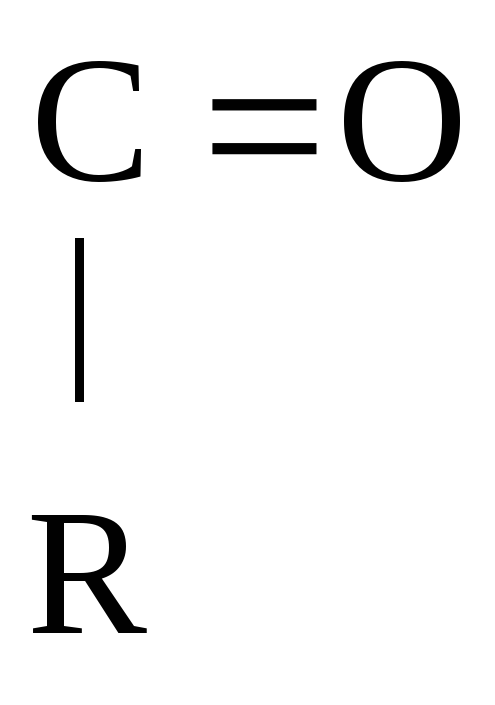 + Н2О
+ Н2О
Сложный эфир
Это р-ция ацилирования – введение ацила в молекулу.
R
R
– О Н + Н О – NО2
![]() R
– О –NО2
+ Н2О
R
– О –NО2
+ Н2О -
-

Азотная Сложный
к-та эфир
III. Р-ции Е (отщепления, или элиминирования)
Эти р-ции конкурируют с реакциями SN.
С
ЭтанолБутен-2
![]() Н3СН2ОН
+ Н+
Н3СН2ОН
+ Н+
 СН3СН2
СН3СН2![]() Н
Н
![]() СН3СН2+
СН3СН2+
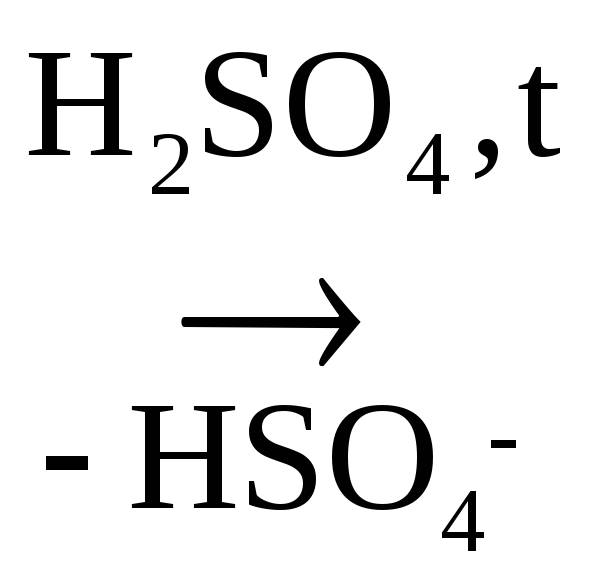
При избытке Н2SО4 и более высокой температуре, чем в случае р-ции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3СН2+ + НSО4 СН2 = СН2 + Н2SО4
Легче идет р-ция Е для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных р-циях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».
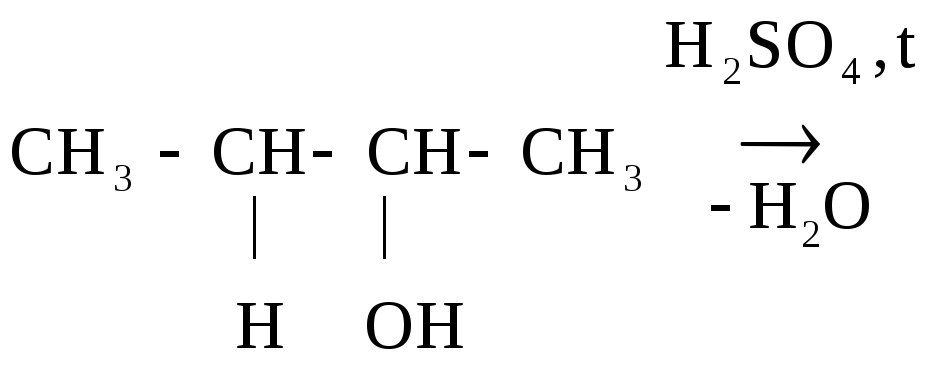
 СН3СН
= СН СН3
СН3СН
= СН СН3
Бутанол-2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
С
ЭтанолЭтилфосфат
Н3СН2ОН
+ НО–РО3Н2
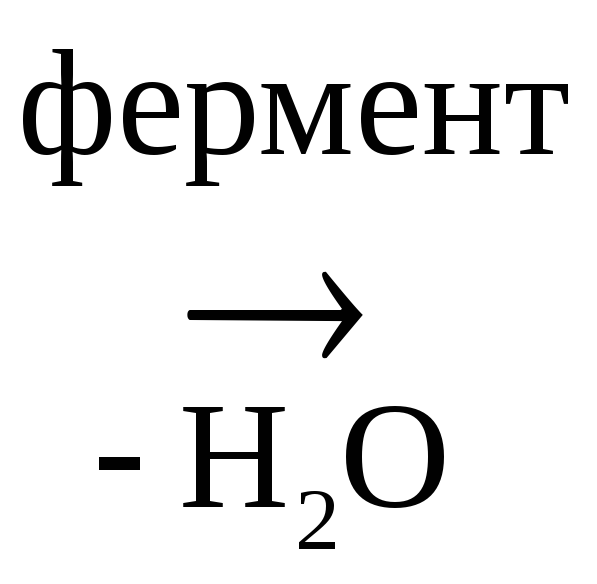 СН3СН2ОРО3Н2
СН3СН2ОРО3Н2
IV. Р-ции окисления
 1)
Первичные и вторичные спирты окисляются
СuО,
растворами КМnО4,
К2Сr2О7
при нагревании с образованием
соответствующих карбонилсодержащих
соединений:
1)
Первичные и вторичные спирты окисляются
СuО,
растворами КМnО4,
К2Сr2О7
при нагревании с образованием
соответствующих карбонилсодержащих
соединений:
С
Пропионовый
альдегид
Пропанол-1
 Н3СН2
Н3СН2![]() ОН
+ О
ОН
+ О![]() СН3CH2
СН3CH2![]() ОН
ОН
![]() СН3СН2
СН3СН2![]() Н
Н
С
Пропанол-2

 Н3
Н3
![]()
СН3 +
О
СН3 +
О![]() СН3
СН3![]()
СН3
СН3![]() СН3
СН3
![]() СН3
СН3
Ацетон (кетон)
2) Третичные спирты окисляются с трудом.
К реакциям окисления относятся и р-ции дегидрирования:
С
Этаналь
Н3 ![]()
ОН
ОН
![]() СН3
СН3 ![]() =
О + Н2
=
О + Н2
Этанол
V. По радикалу (R) протекают р-ции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
СН3СН2ОН
+ 3Вr2
![]() СВr3СН2ОН
+ 3НВr
СВr3СН2ОН
+ 3НВr
Этанол Нарколан
СН2
= СНСН2ОН
+ Вr2
![]() СН2
Вr–СНВr–СН2ОН
СН2
Вr–СНВr–СН2ОН
Аллиловый спирт 2,3-Дибромпропанол

Бензиловый спирт n-Нитрофенилметанол
Многоатомные спирты
Для этих спиртов характерны все р-ции одноатомных спиртов, однако имеется ряд особенностей.
1) За счет – I гр. –ОН многоатомные спирты обладают более выраженными кислотными свойствами. Они образуют алкоголяты не только с щелочными Ме, но и с щелочами:
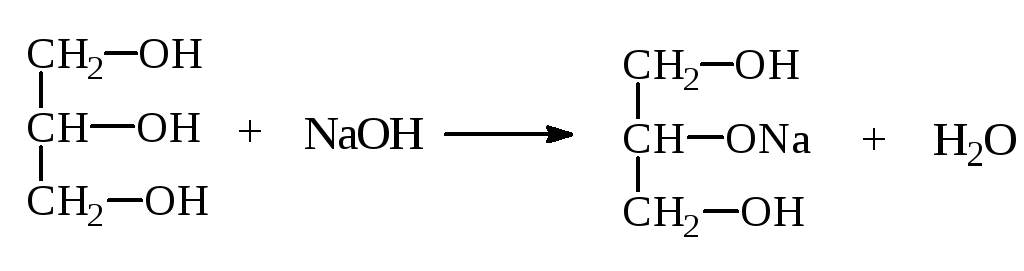
Глицерин
Качественной р-цией на двухатомные и многоатомные спирты (диольный фрагмент) является р-ция с Сu(ОН)2 в щелочной среде:
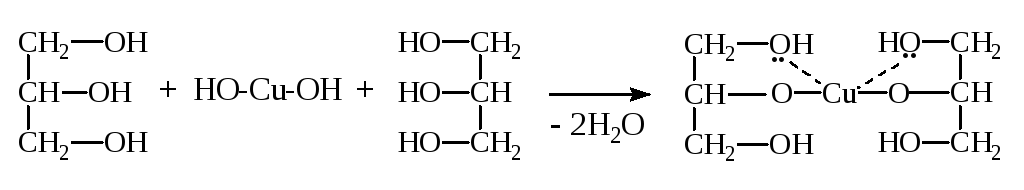
Глицерин Гликолят меди (II)
-
или
 К2
К2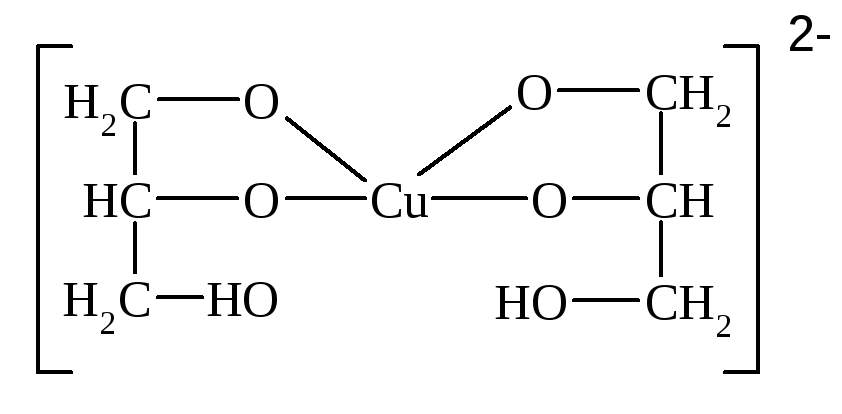
Синее окрашивание
Р-ции многоатомных спиртов могут протекать по одной или всем группам –ОН. Они образуют алкоголяты, простые и сложные эфиры, дегидратируются, окисляются.
-
2)
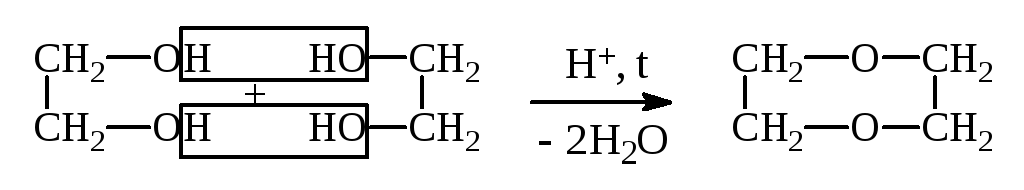
Элилен- Диоксан
гликоль (Циклический диэфир)
-
3)
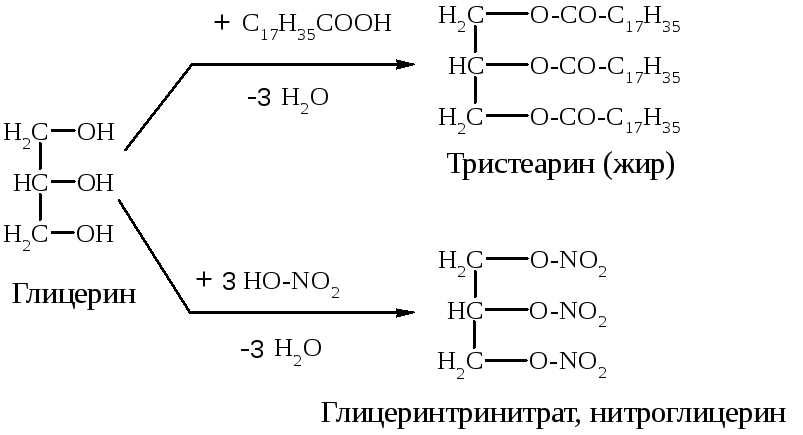
Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1%) применяется при стенокардии, т.к. оказывает сосудорасширяющее действие. Нитроглицерин – сильное взрывчатое вещество, способное взрываться от удара или при нагревании. При этом в малом объеме, который занимает жидкое вещество, мгновенно образуется очень большой объем газов, что и вызывает сильную взрывную волну. Нитроглицерин входит в состав динамита, пороха.

Представители пентитов и гекситов – ксилит и сорбит – соответственно, пяти- и шестиатомные спирты с открытой цепью. Накопление –ОН групп ведет к появлению сладкого вкуса. Ксилит и сорбит – заменители сахара для больных диабетом.
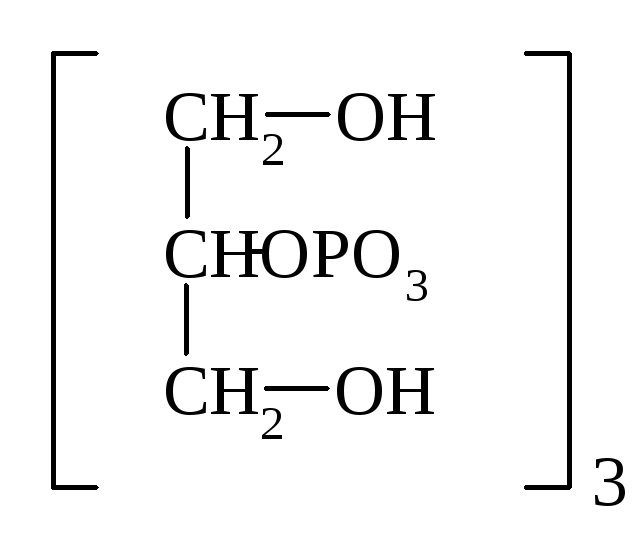
Глицерофосфаты – структурные фрагменты фосфолипидов, применяются как общеукрепляющее средство.
В результате действия Н3РО4 на глицерин получают смесь - и -глицерофосфатов:
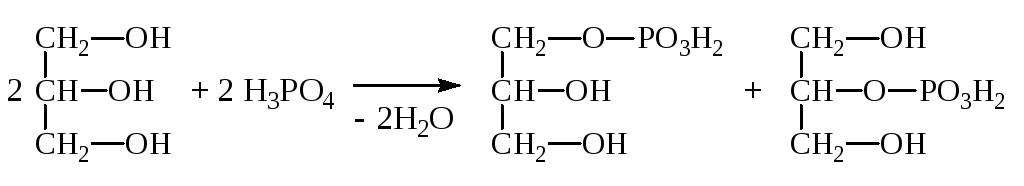
- -
Глицерофосфаты
Глицерофосфат железа (III) – при анемии, астении, общем упадке сил. Детям по 0,3 – 0,5 г 2 – 3 раза в день, взрослым по 1 г 3 – 4 раза:
|
|
Fе2+3 nН2О |
Глицерофосфат кальция – при переутомлении, рахите, упадке питания. Детям по 0,05 – 0,2 г на прием, взрослым 0,2 – 0,5 г.
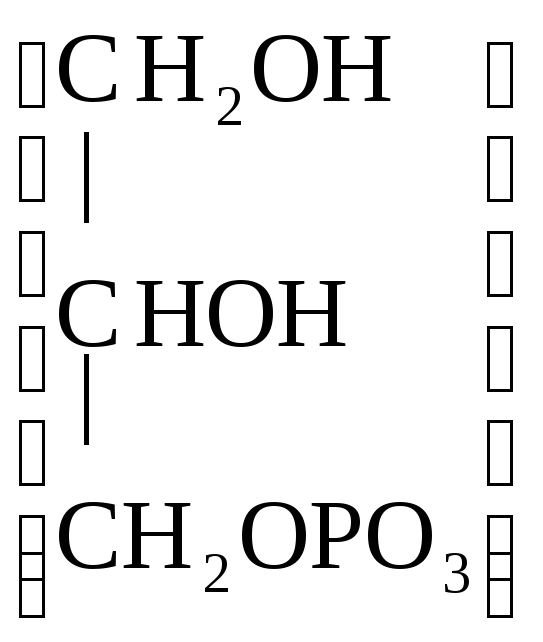 Са
Н2О
+
Са
Н2О
+
 Са
nН2О
Са
nН2О
При действии КНSО4 и при нагревании – образуется акролеин:
Акролеин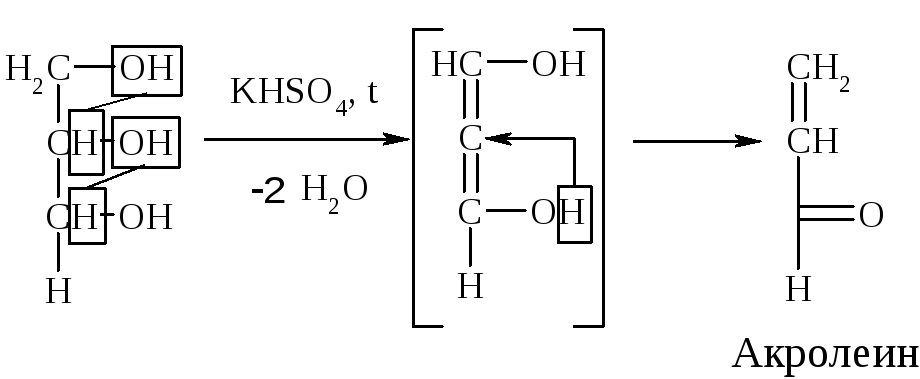

При окислении глицерина образуется ряд продуктов. При мягком окислении – глицериновый альдегид (1) и дигидроксиацетон (2):

При окислении в жестких условиях образуется 1,3-диоксоацетон.
Химические свойства непредельных спиртов аналогичны предельным, однако за счет двойных или тройных связей они вступают в р-ции присоединения, полимеризации, окисления.