
- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
Кислоты Бренстеда
К-ты Бренстеда делятся на 4 вида в зависимости от кислотного центра:
 SН
к-ты (тиолы),
SН
к-ты (тиолы),
ОН к-ты (спирты, фенолы, карбоновые к-ты),
NН к-ты (амины, амиды),
СН к-ты (УВ).
В этом ряду сверху вниз кислотность уменьшается.
Сила к-ты определяется стабильностью образующегося аниона. Чем стабильнее анион, тем сильнее к-та. Стабильность аниона зависит от делокализации (распределения) «» заряда по всей частице (аниону). Чем больше делокализован «» заряд, тем стабильнее анион и сильнее к-та.
Делокализация заряда зависит:
от электроотрицательности (ЭО) гетероатома. Чем больше ЭО гетероатома, тем сильнее соответствующая к-та.
Например: R – ОН и R – NН2
Спирты более сильные к-ты, чем амины, т.к. ЭО (О) > ЭО (N).
б) от поляризуемости гетероатома. Чем больше поляризуемость гетероатома, тем сильнее соответствующая к-та.
Например: R – SН и R – ОН
Тиолы более сильные к-ты, чем спирты, т.к. атом S более поляризован, чем атом О.
в) от характера заместителя R (длины его, наличие сопряженной системы, делокализации электронной плотности).
Например: СН3 – ОН, СН3 – СН2 – ОН, СН3 – СН2 – СН2 – ОН
 Кислотность
<, т.к. увеличивается длина радикала
Кислотность
<, т.к. увеличивается длина радикала
П ри
одинаковом кислотном центре сила
спиртов, фенолов и карбоновых к-т не
одинакова. Например,
ри
одинаковом кислотном центре сила
спиртов, фенолов и карбоновых к-т не
одинакова. Например,
СН3 – ОН, С6Н5 – ОН,

Сила к-ты увеличивается
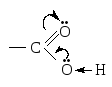
Фенолы являются более сильными к-тами, чем спирты за счет р, -сопряжения (+М) группы –ОН.
 Связь
О–Н более поляризуется в фенолах. Фенолы
могут взаимодействовать даже с солями
(FеС13) – качественная
реакция на фенолы. Карбоновые
к-ты по
сравнению со спиртами, содержащими
одинаковыйR, являются
более сильными к-тами, т.к. связь О–Н
значительно поляризована за счет –М
эффекта группы > С = О:
Связь
О–Н более поляризуется в фенолах. Фенолы
могут взаимодействовать даже с солями
(FеС13) – качественная
реакция на фенолы. Карбоновые
к-ты по
сравнению со спиртами, содержащими
одинаковыйR, являются
более сильными к-тами, т.к. связь О–Н
значительно поляризована за счет –М
эффекта группы > С = О:
Кроме того карбоксилат-анион более стабилен, чем анион спирта за счет р,-сопряжения в карбоксильной группе.
г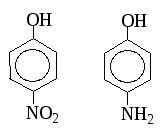 )
от введения заместителей в радикал. ЭА
заместители увеличивают кислотность,
ЭД заместители уменьшают кислотность.
)
от введения заместителей в радикал. ЭА
заместители увеличивают кислотность,
ЭД заместители уменьшают кислотность.
Например:
р-Нитрофенол более сильная к-та, чем р-аминофенол, т.к. группа –NО2 является ЭА.
СН3–СООН ССl3–СООН
рК 4,7 рК 0,65
Трихлоруксусная к-та во много раз сильнее СН3СООН за счет – I атомов Сl как ЭА.
Муравьиная к-та Н–СООН сильнее СН3СООН за счет +I группы СН3– уксусной к-ты.
д) от характера растворителя.
Если растворитель является хорошим акцептором протонов Н+, то сила к-ты увеличивается и наоборот.
Основания Бренстеда
Они делятся на:
а) -основания (соединения с кратными связями);
б)
n-основания
(аммониевые, содержащие атом
![]() ,
,
оксониевые,
содержащие атом
![]() ,
,
сульфониевые,
содержащие атом
![]() )
)
Сила основания определяется стабильностью образующегося катиона. Чем стабильнее катион, тем сильнее основание. Другими словами, сила основания тем больше, чем менее прочная связь с гетероатомом (О, S, N), имеющим свободную электронную пару, атакуемую Н+.
Стабильность катиона зависит от тех же факторов, что и стабильность аниона, но с обратным действием. Все факторы, усиливающие кислотность, уменьшают основность.
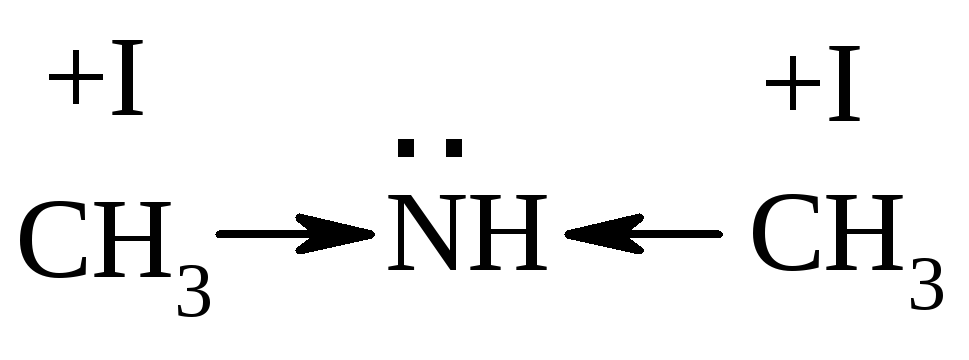
Самыми сильными основаниями являются амины, т.к. атом азота имеет меньшую ЭО по сравнению с О. При этом вторичные амины более сильные основания, чем первичные, третичные амины слабее вторичных за счет стерического фактора, затрудняющего доступ протона к N.
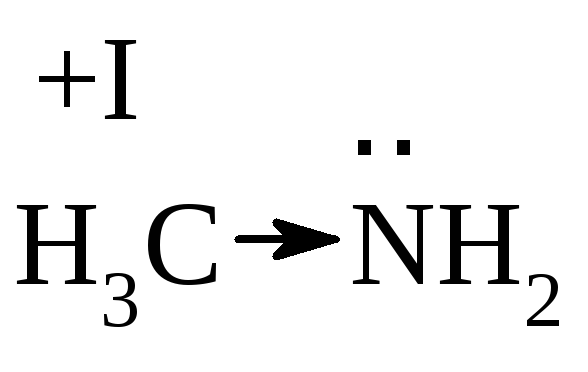

Ароматические амины более слабые основания, чем алифатические, что объясняется +М группы –NН2. Электронная пара азота, участвуя в сопряжении, становится малоподвижной.
Стабильность сопряженной системы затрудняет присоединение Н+.
В мочевине NН2–СО– NН2 присутствует ЭА группа > С = О, которая значительно снижает оснóвные св-ва и мочевина образует соли только с одним эквивалентом к-ты.
Т.о., чем сильнее к-та, тем слабее образуемое ею основание и наоборот.
