- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
Физические св-ва
Низшие монокарбоновые к-ты (С1 – С9) – бесцветные жидкости, высшие алифатические и ароматические к-ты – твердые вещ-ва. Первые гомологи – муравьиная, уксусная, пропионовая к-ты – обладают резким раздражающим запахом; с водой смешиваются в любых соотношениях. По мере увеличения гидрофобной углеводородной части молекулы растворимость в воде уменьшается, что объясняется уменьшением сольвации молекул к-ты молекулами воды.
Температура кипения к-т значительно выше температур кипения спиртов и альдегидов с тем же числом атомов С. Это объясняется тем, что к-ты образуют ассоциаты за счет межмолекулярных Н-связей.
Химические св-ва
I. Р-ции атома Н в карбоксиле
Диссоциация
![]()
Образование солей с активными Ме, МеО, МеОН, солями

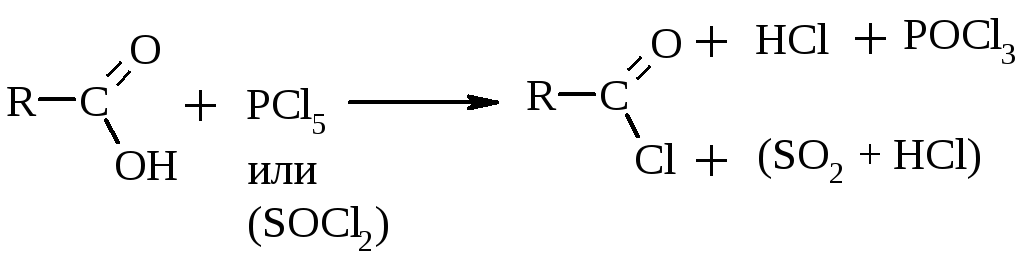
II. Р-ции SN (нуклеофильного замещения) гр. –ОН
Это наиболее важные, легко протекающие р-ции, приводящие к образованию различных производных КК (галогенангидридов, ангидридов, амидов, сложных эфиров):
|
1) |
Хлорангидрид |
|
2) |
Ангидрид |
|
3) |
Соль аммония Амид |
Характерным св-вом амидов является р-ция гидролиза их. Поэтому практически амиды получают из ацилхлоридов. Р-ция образования амидов играет большую роль в организме: за счет этой р-ции происходит обезвреживание токсичного NH3.
|
4) |
Сложный эфир |
Механизм: + на атоме С карбоксильной гр. очень мал, спирт – слабый нуклеофил, поэтому р-цию ведут в присутствии неорганической к-ты:
![]()
Стадия образования карбоксилат-иона
+
Стадия присоединения молекулы спирта

Стадия стабилизации иона

Стадия выброса Н+

Наиболее легко этерифицируются к-ты с прямой углеродной цепью и первичные спирты.
Суммарно:
![]()

Важным св-вом сложных эфиров является р-ция гидролиза их в кислой или щелочной среде (процесс омыления).
Механизм:

Схематично:


Подобно сложным эфирам подвергаются гидролизу и др. производные КК. Например, амиды:

Т.к. эти р-ции обратимы, то сложные эфиры и амиды получают на практике из производных КК:

Кабоксилат Алкил-
натрия хлорид
Для двухосновных к-т характерны те же р-ции, но с образованием моно- и дипроизводных – кислых и средних солей, неполных и полных эфиров, ангидридов, амидов:
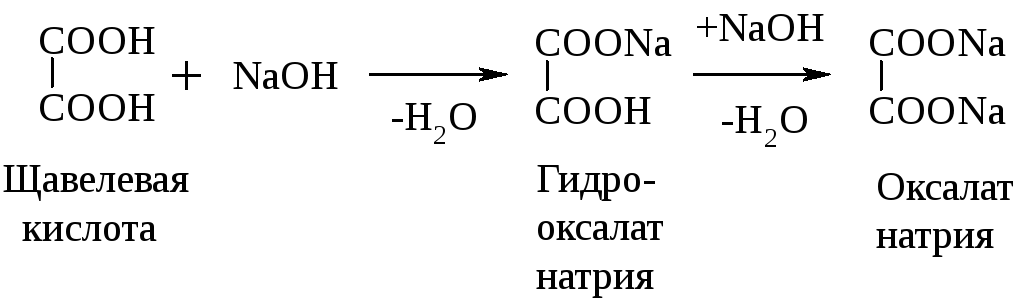


Из особых (специфических) св-в дикарбоновых КК следует отметить их поведение при нагревании.
Результат нагревания дикарбоновых к-т зависит от расположения –СООН групп в цепи.
Если гр. – СООН расположены близко друг к другу, то происходит декарбоксилирование, т.е. удаление карбоксильной гр. путем отщепления СО2. Это характерно для щавелевой и малоновой к-т.

Если гр. –СООН удалены друг от друга, то при нагревании образуются внутренние ангидриды:

Аналогично образуются ангидриды малеиновой и фталевой к-ты:

Терефталевая
к-та  такого ангидрида не образует.
такого ангидрида не образует.
Фумаровая (транс-бутендионовая) к-та не образует ангидрида, т.к. гр. –СООН расположены по разные стороны от двойной связи, т.е. отсутствуют благоприятные стерические факторы.
Одноосновные КК устойчивы к нагреванию. Однако в случае нахождения у -углеродного атома сильной ЭА группы при 100 – 150 оС также идет декарбоксилирование:
![]()