- •Лекция 1 Биоорганическая химия (бох), ее значение в медицине
- •Органическая химия
- •Структурная изомерия
- •Пространственная изомерия (стереоизомерия)
- •Формулы Ньюмена
- •Конфигурационные изомеры
- •Лекция 2 Сопряженные системы
- •Ароматичность
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Лекция 3 Кислотность и основность
- •Кислоты Бренстеда
- •Основания Бренстеда
- •Монофункциональные соединения Спирты
- •Физические св-ва
- •Химические св-ва
- •Карбокатион
- •Простой эфир
- •Бутен-2
- •Этилфосфат
- •Этаналь
- •Многоатомные спирты
- •Лекция 4 Фенолы
- •Химические свойства
- •Тиоспирты и тиоэфиры
- •Химические св-ва
- •Роль в организме
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Строение молекулы амина
- •Химические св-ва
- •Алкиламид
- •Замещенный имин
- •Лекция 5 Альдегиды и кетоны
- •Номенклатура
- •Изомерия
- •Физические св-ва
- •Химические свойства
- •Лекция 6 Карбоновые кислоты (кк)
- •Классификация
- •Номенклатура
- •Физические св-ва
- •Химические св-ва
- •Трихлоруксусная Хлороформ
- •Угольная к-та и ее производные
- •Мочевина
- •Химические св-ва
Монофункциональные соединения Спирты
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3СН2ОН
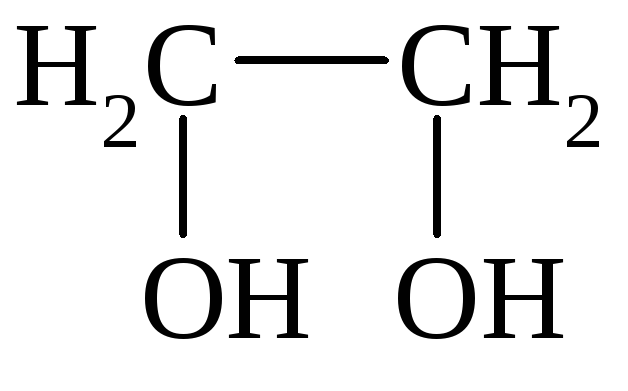

Этанол Этиленгликоль Глицерин

Сорбит
II. По характеру R различают: 1) предельные, 2) непредельные, 3) циклические, 4) ароматические.
2) СН2 = СНСН2ОН
Аллиловый спирт
 3)К
непредельным циклическим спиртам
относятся:
3)К
непредельным циклическим спиртам
относятся:
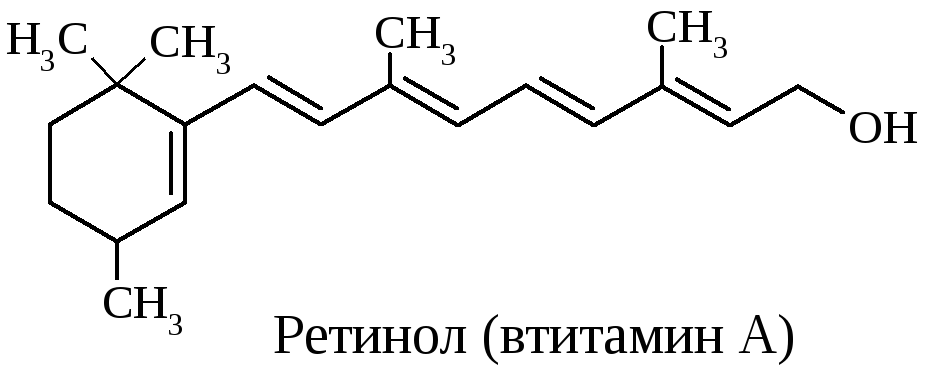
ретинол (витамин А) и холестерин
 Инозит
Инозит
витаминоподобное в-во
группы В
Холестерин
|
4) |
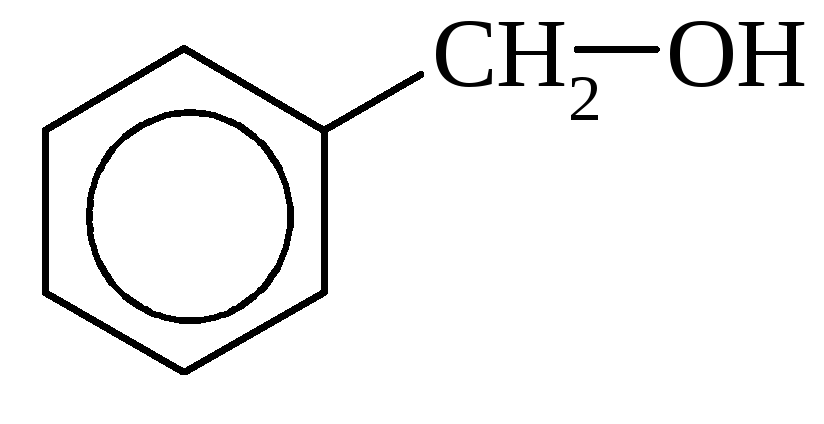
Бензиловый спирт |
III. По положению гр. –ОН различают первичные, вторичные и третичные спирты.
IV. По количеству атомов С различают низкомолекулярные и высокомолекулярные.
СН3–( СН2)14 –СН2–ОН (С16Н33ОН) СН3–( СН2)29 –СН2ОН (С31Н63ОН)
Цетиловый спирт Мирициловый спирт
Цетилпальмитат – основа спермацета, мирицилпальмитат содержится в пчелином воске.
Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта


 СН-кислотныйNuцентр
СН-кислотныйNuцентр
SN SЕ
'+ - +
.. ..
R СН2 О Н
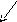
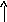
Электрофильный Центр Кислотный
центр основности центр
Р-ции окисления
и Е
Спирты – слабые кислоты.
Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
–I эффект гр. –ОН увеличивает подвижность Н у соседнего углеродного атома. Углерод приобретает + (электрофильный центр, SЕ) и становится центром нуклеофильной атаки (Nu). Связь С–О рвется более легко, чем Н–О, поэтому характерными для спиртов явл-ся р-ции SN. Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает + атома углерода и облегчает разрыв связи. К этому типу относятся р-ции образования эфиров, галогенопроизводных.
Смещение элекронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут р-ции окисления и элиминирования (Е).
Физические св-ва
Низшие спирты (С1–С12) – жидкости, высшие – твердые вещ-ва. Многие св-ва спиртов объясняются образованием Н-связи:
![]()
Химические св-ва
Кислотно-оснóвные
Cпирты – слабые амфотерные соединения.
2R–ОН + 2Nа 2R–ОNа + Н2
Алкоголят
натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
R– ОNа + НОН R–ОН + NаОН
Оснóвный центр в спиртах – гетероатом О:
С
Осн-ие К-та![]() Н
+
Н
+![]() Сl
[СН3СН2
Сl
[СН3СН2![]() Н]Сl
Н]Сl
Этилоксонийхлорид
II. Реакции SN по гр. –ОН
Гр. ОН является плохоуходящей группой (связь мало полярна), поэтому большинство р-ций проводят в кислой среде. Механизм р-ции:
С
Карбокатион
 Н3СН2ОН
+ Н+
СН3СН2
Н3СН2ОН
+ Н+
СН3СН2![]() Н
СН3СН2+
+ Н2О
Н
СН3СН2+
+ Н2О
Если р-ция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3СН2+ + Сl СН3СН2Сl
НС1 RОН R-СООН NН3 С6Н5ОNа
С1 R-О R-СОО NН2 С6Н5О
Анионы



Анионы в таких р-циях выступают в качестве нуклеофилов (Nu) за счет «» заряда или неподеленной электронной пары. Анионы являются более сильными основаниями и нуклеофильными реагентами, чем сами спирты. Поэтому на практике для получения простых и сложных эфиров используются –алкоголяты, а не сами спирты. Если нуклеофилом является другая молекула спирта, то она присоединяется к карбокатиону: