
А Е Щеголев Органическая химия 2016 / 12 Гетероциклические соединения
.pdf
Строение катиона пирилия подобно строению катиона пиридиния (и молекулы пиридина). Здесь имеет место циклическая сопряжѐнная 6- - электронная система. Отличие от молекулы пиридина — это присутствие в катионе пирилия сильно электроотрицательного атома кислорода в оксониевой форме. Это вызывает сильнейшую поляризацию связей и высокую реакционную способность по отношению к нуклеофилам. Реакции электрофильного замещения для них неизвестны.
Обычно местом нуклеофильной атаки в катионе пирилия является атом С2, но возможны реакции и по атому С4. Присоединение нуклеофила в положение 2 влечѐт за собой, как правило, раскрытие цикла, но возможно последующее его замыкание с образованием другой циклической системы:
R |
|
R |
|
|
|
R |
|
NH3 / H2O, 293 K |
NH2 |
|
|
|
|
|
+ |
|
|
|
H |
|
+ |
-H |
O |
|
H |
O |
|
O |
|
H |
NH2 |
|||
|
|
|
|
|||
|
R |
R |
|
|
|
|
H |
|
-H2O |
|
|
|
|
HO |
N |
N |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
-Пироны являются одновременно -лактонами и сопряжѐнными диенами. Поэтому они проявляют свойства сложных эфиров и вступают, например, в реакцию диенового синтеза как сопряжѐнные диены.
-Пироны способны расщепляться под действием щѐлочи, аммиака, аминов. Местом нуклеофильной атаки является положение 2. Механизм процесса аналогичен приведѐнному выше взаимодействию катиона пирилия с аммиаком.
12.4.7. СПОСОБЫ ПОЛУЧЕНИЯ
Пиридин, хинолин, изохинолин и их метильные производные содержатся в каменноугольной смоле, откуда их выделяют при промышленном получении.
Пиридиновое кольцо входит в структуру многих природных соединений — витаминов, алкалоидов, нуклеиновых кислот, и поэтому некото-
650

рые производные пиридина могут быть получены путѐм превращений исходных природных соединений.
Для синтетического получения пиридина, хинолина, изохинолина, их производных, а также кислородосодержащих гетероциклических соединений используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Некоторые примеры таких синтезов.
1. Частично гидрированные алкилпиридины могут быть получены конденсацией -дикарбонильных соединений с аммиаком.
R |
O O + R' |
|
|
|
|
|
H |
||
|
|
|
R |
|
N R' |
||||
C |
C |
|
|
|
|
|
|
|
|
|
+ |
:NH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H2C |
CH2 |
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH2 |
|
|
|
|
|
|
|
|
Реакция начинается как нуклеофильное присоединение аммиака к молекуле дикарбонильного соединения, образованием иминосоединения и затем внутримолекулярное нуклеофильное присоединение с атакой иминогруппы по карбонильной группе.
2. Синтез Ганча представляет собой получение замещѐнных пиридинов конденсацией эфиров -оксокислот с альдегидами и аммиаком.
|
O |
|
|
R" + H |
|
|
|
|
O |
|
|
|
|
O |
|
R" |
O |
||||||||||||||
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
RO C HC |
CHCH |
C OR |
|||||||||||||
RO |
C |
CH |
|
|
CH |
C |
OR |
||||||||||||||||||||||||
|
|
|
O |
+ |
|
|
|
|
|
|
+ |
|
+ |
|
|
|
|
:NH3 |
|||||||||||||
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
R |
|
|
|
|
|
|
||||
|
R' C O |
|
|
O C R' |
-H2O |
|
R' |
C |
|
|
|
|
|
-2H2O |
|||||||||||||||||
|
|
|
|
O O |
|
|
|
|
|
|
|||||||||||||||||||||
R"
ROOC COOR
R' 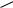
 N
N  R'
R'
H
Образовавшийся по данной схеме цикл дигидропиридина может быть далее дегидрирован до пиридинового цикла. Вместо эфира -кетокислот здесь могут быть использованы другие -дикарбонильные соединения (малоновый эфир, ацетилацетон) и эфиры циануксусной кислоты.
3. Пиридин может быть получен циклизацией ацетилена с циановодородом:
651

2 CH  CH + H C
CH + H C  N
N
N
Реакция аналогична получению бензола, протекает при высоких температурах, но представляет только теоретический интерес.
4. Синтез хинолина по Скраупу* (синтез Скраупа или реакция Скраупа) осуществляют, используя первичные ароматические амины, глицерин и концентрированную серную кислоту (60 85%-ю) в присутствии слабых окислителей (нитробензола или соответствующих ароматических нитросоединений или других окислителей).
Первоначально из глицерина под действием серной кислоты образуется акролеин, который затем взаимодействует с ариламином:
CH2-CH-CH2 H2SO4 |
|
|
|
O |
|
|
|
||
CH =CH C |
|
+ |
2 H2O |
||||||
|
|
|
|
||||||
OH OH OH |
|
|
2 |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|||
|
+ |
|
O - |
|
|
|
H C O |
||
+ |
CH =CH |
C |
|
|
|
|
|
- |
CH |
|
2 |
|
H |
|
|
|
+ |
|
|
NH2 |
|
|
|
|
|
|
NH2 |
CH2 |
|
|
|
|
|
|
OH |
|
|
|
|
- |
+ O |
|
|
|
CH |
|
|
|
|
H |
C |
|
|
|
CH2 |
|
|
|
|
|
CH2 |
|
|
|
CH2 |
-H2O |
|
|
|
NH CH2 |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
[O] |
|
|
|
|
|
|
|
|
N |
|
|
|
|
N |
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
5. Одним из синтетических способов получения изохинолина является реакция Бишлера*–Напиральского, в которой в качестве исходного используется 2-фенилэтан-1-амин:
CH2 |
CH2 |
|
O |
CH2 |
|
+ R C |
|
CH2 |
|||
|
|
X |
R |
||
|
NH2 |
|
|||
|
|
|
|
||
|
-HX |
C NH |
|||
|
|
||||
O
652
CH2 CH2 |
P2O5 |
|
|
|
C |
NH |
-HPO3 |
N -H2 |
N |
|
||||
R OH |
|
R |
R |
|
|
|
|
||
6. Соли пирилия (производные пирана) обычно получают из , - ненасыщенных карбонильных соединений и метилкетонов в присутствии уксусного ангидрида и сильной кислоты (HClO4) :
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
|
|
O |
|
|
|
CH |
|
|
|
|
- |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
HC |
|
|
+ |
H3C |
|
C R |
|
|
|
|
HC |
+ |
|
+ |
|
|
|
CH2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O C R |
|
|
|
|
|||||
R C O |
|
|
|
|
|
|
|
|
|
|
|
R C |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|||||||||||
R |
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|||||
|
CH2 |
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
CH |
|
|
|
|
|
CH |
|
|
HC |
CH |
CH2 |
||||||||||||||||
HC |
+ |
|
|
|
|
HC |
+ |
|
|
|
|
|
|||||||||||||||
R C |
C |
R |
|
|
|
R C - |
|
C R |
|
|
|
|
|
|
|
|
|
R |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
O |
|
|
|
|
|
OH |
|
|
R |
C |
O |
|
|||||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
OH |
|||||||||||||||||||
O |
H |
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
(CH3CO)2O |
|
-CH3COOH |
R |
R O |
|
+ |
|
|
|
|
|
- |
|
|
|
|
|
|
|
|||
|
R-CH=CH-CR=O + HClO4 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
ClO4 |
|
- R-CH2CH2-CR=O |
|
|
+ |
|
|||
|
R |
|
|
R |
||||
|
|
|
|
O |
|
|||
12.4.8.ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ И МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Пиридин — бесцветная жидкость с неприятным запахом, температурой кипения 116 С. Растворим в воде, ядовит.
Получают пиридин при коксовании каменного угля.
Пиколины — бесцветные жидкости с неприятным запахом, температурами кипения 130 С, 144 С и 145 С (для -, - и -изомеров соответственно). Хорошо растворимы в воде.
Пиколины получают из каменноугольной смолы.
653

Пиридинкарбоновые кислоты представляют собой бесцветные кристаллические вещества, растворимые в воде. Их получают окислением производных пиридина (главным образом, пиколинов).
Никотиновая ( -пиридинкарбоновая) кислота является провитамином РР, а еѐ амид — витамином РР. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой.
O

 C-NH2
C-NH2
N
никотинамид (витамин РР)
Гидразид изоникотиновой кислоты (изониазид, тубазид) является структурной основой противотуберкулѐзных препаратов. Его производные используются при лечении туберкулѐза.
O
N 
 C-NH-NH2
C-NH-NH2
изониазид
Пиридоксин (витамин В6) — бесцветное кристаллическое вещество, хорошо растворимое в воде. Содержится в различных природных продуктах (дрожжах, бобах, печени). В организме превращается в пиридоксаль-5- фосфат, участвующий в метаболизме аминокислот.
X
HOH2C

 OH
OH
 N
N 
 CH3
CH3
витамин В6
где Х = -CH2NH2 — пиридоксамин -CH2OH — пиридоксол -CHO — пиридоксаль
Хинолин — бесцветная жидкость с температурой кипения 237 С и неприятным запахом.
Получают хинолин при переработке каменноугольной смолы. Используют в качестве растворителя и исходного вещества для получения аналитических реагентов и лекарственных веществ.
Хинальдин (2-метилхинолин) — бесцветная жидкость с температурой кипения 247 С и запахом хинолина. Получают из каменноугольной смолы. Используют для синтеза красителей.
Изохинолин — бесцветное вещество с температурой плавления 24 С, кипения 242 С. Получают из каменноугольной смолы.
654

Антоцианидины—
бензо[b]пирилия.
OH
OH
HO 

 O
O
гидроксипроизводные солей замещѐнного
OH
|
OH |
X |
где Х = -ОН или –Н |
Антоцианидины являются основой пигментов цветов, ягод, овощей, в состав которых они входят в виде гликозидов моносахаридов, называемых антоцианами.
12.5. ШЕСТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ
Из шестичленных гетероциклических соединений с двумя гетероатомами наиболее важны в практическом отношении производные пиримидина и конденсированные системы на его основе (в частности, пурин). Однако находят применение и встречаются в составе природных соединений и другие гетероциклы с двумя атомами азота, с атомами кислорода и пр. Примеры:
|
|
N |
|
|
|
|
|
N |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N N |
||
|
|
N |
|
|
|
|
|
N |
|
||||||||
пиримидин |
|
|
|
|
|
пиразин |
|
пиридазин |
|||||||||
(1,3-диазин) |
|
|
|
|
|
(1,4-диазин) |
|
(1,2-диазин) |
|||||||||
|
|
|
N |
|
|
|
N |
|
O |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
N |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
N |
|
O |
||||||||||
|
|
|
|
|
H |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
пурин |
|
|
|
|
|
диоксан |
||||||
(имидазо[4,5-d]пиримидин) |
(пергидро-1,4-диоксин) |
||||||||||||||||
Диоксан по химической структуре является простым насыщенным циклическим диэфиром. Циклические простые эфиры изучались ранее (гл. 3.4) и поэтому здесь рассматриваться не будут.
Пиримидин, пиразин и пиридазин в соответствии с номенклатурными правилами являются изомерными диазинами, и далее для них будет ис-
655

пользоваться это собирательное название. Нумерация атомов в их циклах соответствует номенклатурным правилам:
|
4 |
|
|
|
|
4 |
|
|
4 |
|
|
||
|
|
|
3 |
|
|
N |
|
|
|
|
|||
5 |
|
|
N |
5 |
|
3 |
5 |
|
|
3 |
|||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
2 |
|
N 2 |
||
6 |
|
|
2 |
|
|
6 |
|||||||
|
N |
|
N1 |
|
N |
||||||||
|
|
|
|
|
|
|
|
|
|||||
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
|
12.5.1. СТРОЕНИЕ И СВОЙСТВА ДИАЗИНОВ
Пиримидин, пиразин и пиридазин представляют собой бесцветные вещества, растворимые в воде. Пиридазин отличается от других диазинов высокой температурой кипения (207 С), это на 80 90 С выше температур кипения пиримидина (123 С) и пиразина (118 С). Такая высокая температура кипения пиридазина является следствием близкого расположения двух атомов азота в молекуле, сильной поляризации молекул, приводящей к значительной ассоциации их в жидкости.
Строение диазинов подобно строению пиридина. Каждая из молекул диазинов представляет собой плоский шестиугольник, содержащий сопряжѐнную -электронную систему, удовлетворяющую всем критериям ароматичности, в том числе и правилу Хюккеля (6 -электронов). Валентные углы и длины связей искажены по сравнению с бензолом. В целом диазины менее ароматичны, чем пиридин.
Акцепторное влияние двух гетероатомов в диазинах значительно сильнее, чем одного атома азота в пиридине. При этом в пиримидине влияние атомов азота согласованное, и электронная плотность сильно понижена в положениях 2, 4 и 6. В молекулах 1,2- и 1,4-диазинах несогласованное влияние гетероатомов приводит к понижению электронной плотности на всех углеродных атомах.
|
+ |
|
|
|
|
N |
+ |
|
|
|
|
+ |
|
'+ |
+ |
N |
|
||
|
|
|
N
N
|
|
+ |
+ |
+ |
'+ |
+ |
'+ |
N N |
Вследствие этого диазины ещѐ менее склонны к реакциям электрофильного замещения, чем пиридин. Но понижение электронной плотности на атомах углерода приводит к облегчению атаки нуклеофильными реагентами по сравнению с пиридином.
Химические свойства диазинов (как самих гетероциклов, так и их производных), по аналогии с пиридином, включают в себя и реакции не-
656
посредственно по атому азота (основные свойства, реакции алкилирования, окисления), и реакции с участием ароматического кольца (электрофильное и нуклеофильное замещение, гидрирование). Рассмотрим их на примере пиримидина.
12.5.1.1. Основность
Пиримидин, как и другие диазины, — это преимущественно однокислотное основание. Его основность (рКb = 12.7) значительно слабее выражена, чем основность пиридина (рКb = 8.8). Это связано с электроноакцепторным влиянием другого атома азота.
+
N H+ NH
+
 N
N  N
N
пиримидиний-катион
Присоединение второго протона — чрезвычайно сложный процесс, и возможен лишь в концентрированных растворах очень сильных кислот.
12.5.1.2. Реакции алкилирования по атому азота
Пиримидин реагирует с алкилгалогенидами труднее, чем пиридин, с образованием N-алкилониевых солей:
|
|
|
+ |
||||
N |
|
|
|
NR |
|||
|
|
|
|||||
|
|
|
|
I- |
|||
|
+ RI |
|
|
|
|
|
|
|
|
|
|
|
|||
N |
|
|
|
N |
|||
|
|
|
|
йодид N-алкилпиримидиния |
|||
Диалкилпроизводные в этих условиях получить не удаѐтся.
12.5.1.3. Реакции электрофильного замещения
В молекуле пиримидина положение 5 — это единственное положение во всех трѐх диазинах, которое не является - или -положением по отношению к атому азота, и оно аналогично -положению пиридина. Величина -электронной плотности на этом атоме углерода остаѐтся самой высокой из всех углеродных атомов диазинов — см. выше строение диазинов. Тем не менее, осуществить реакции нитрования, сульфирования, ацилирования практически не удаѐтся. Незамещѐнный пиримидин в SE- реакции не вступает. Однако галогенирование в ряде случаев может протекать в достаточно мягких условиях и с хорошим выходом (80 90%) как для пиримидина, так и для других диазинов:
657
|
+ |
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|||
|
NH |
|
|
|
C6H5NO2 / 400 K |
|
N |
|||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
Cl- |
+ |
Br2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
- HCl |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
N |
|
|
|
|
|
|
|
|
|
- HBr |
|
N |
||||||
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
Cl |
||
|
|
|
|
|
+ |
Cl2 |
CCl4 / 313 K |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
- HCl |
|
|
|
|
CH3 |
|||||
N |
|
|
|
CH |
|
|
|
|
|
N |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Объяснить это можно тем, что в данных случаях реализуется механизм присоединения–отщепления, а не классического электрофильного замещения. Например, бромирование хлорида пиримидиния может протекать так:
|
NH+ |
+ |
|
|
|
|
NH |
+ |
- |
|||
|
|
- |
Br |
Br |
-BrCl |
|
|
H |
+ Br |
Cl |
||
|
|
Cl |
|
|
|
|
|
|
|
|
||
|
N |
|
|
|
|
|
|
|
N |
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H |
+ |
|
|
|
|
|
H |
|
|
Br |
|
|
|
|
NH |
|
- |
|
|
|
N |
|
|
N |
|
Br |
|
Cl |
|
|
Br |
|
|
|
||||
|
|
H |
|
-HCl |
|
|
|
H -HBr |
|
|
||
|
N |
Br |
|
|
|
|
|
N |
Br |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|||
Наличие в кольце пиримидина хотя бы одной сильной электронодонорной группы во многих случаях достаточно для облегчения SE-реакций; две аминогруппы активируют молекулу настолько, что становятся возможными реакции даже со слабыми электрофилами, такими, как катионы диазония. Например:
NH2 |
|
|
|
|
|
NH2 |
N |
|
|
|
Cl |
N=N |
N |
+ |
|
|
|
|
||
+ |
N2 |
Cl |
-H |
+ |
|
|
N NH2 |
|
|
|
|
N NH2 |
|
|
|
|
|
|
12.5.1.4. Реакции нуклеофильного замещения
По причине сильного электроноакцепторного влияния двух атомов азота в молекулах диазинов более характерными более характерными для них являются реакции нуклеофильного (а не электрофильного) замещения. Для диазинов эти реакции протекают легче, чем для пиридина. Например, легко осуществляется нуклеофильная атака амид-анионом в реакции Чи-
658
чибабина: лимитирующей стадией является отрыв гидрид-иона, и необходимо использование (перманганата калия или другого окислителя) для отщепления нуклеофугной группы:
|
|
+ |
|
|
|
|
|
|
|
|
|
H NH2 |
|
|
|
|
NH2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
N |
|
|
- |
|
|
|
|
N- |
|
+ KMnO |
|
|
N |
||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
+ |
K |
|
NH2 |
|
|
|
|
|
K+ |
4 |
|
|
|
|
|
+ |
|
|
|
'+ |
|
|
|
|
|
|
|
|
|
|
-MnO2, -H2O, -KOH |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
N |
|
|
N |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
По этой же причине нуклеофильное замещение преимущественно наблюдается в положении 4, а не в положении 2 (гидрид-ион у атома С2 сильнее удерживается акцепторным влиянием двух атомов азота).
Замещение других уходящих групп в молекулах производных пиримидина может происходить легко, в мягких условиях, если отщепляемый анион достаточно устойчив. Так, например, происходит с 2-, 4- или 6-га- логенозамещѐнными пиримидинами. (Положение 5 не активировано для нуклеофильной атаки, и галоген там может замещаться в жѐстких условиях, подобно тому, как это происходит в галогенаренах.) Взаимодействие 2,4-дихлорпиримидинов с аммиаком в этаноле в обычных условиях (20 С) протекает не селективно:
Cl |
|
|
|
|
NH2 |
|
|
Cl |
|||||||
|
N |
+ NH3 |
C2H5OH |
|
|
|
N |
+ |
|
|
N |
||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||||||
N Cl |
|
|
|
|
N |
|
Cl |
|
|
N NH2 |
|||||
В общем случае селективность других реакций нуклеофильного замещения производных пиримидина зависит от природы нуклеофильного реагента и условий проведения процесса.
12.5.1.5. Реакции окисления и восстановления
Пиримидиновый цикл, так же как и пиридиновый, устойчив к окислителям; образование N-оксидов пиримидина протекает значительно труднее, чем для пиридина. Алкилпроизводные при действии CrO3 или KMnO4 окисляются до карбоновых кислот:
R |
|
HOOC |
N |
[O] |
N |
|
|
|
N |
|
N |
659
