
А Е Щеголев Органическая химия 2016 / 12 Гетероциклические соединения
.pdf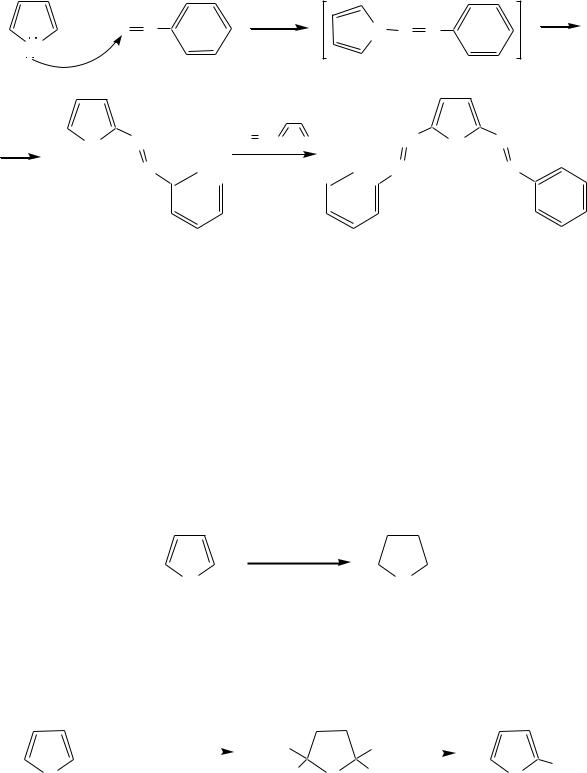
рН раствора выше 10 в реакции участвует пирролид-анион, и она в этом случае протекает в 108 раз быстрее. В более щелочных условиях происходит образование 2,5-бис-диазопроизводных.
- |
+ |
+ |
273 K |
N N N |
N N |
|
N
+
N N N N 
 N N N
N N N
H N 

 N H N
N H N
Взаимодействие пирролида калия с диоксидом углерода протекает по механизму, аналогичному реакции Кольбе–Шмитта (гл. 10.5.3.3), с образованием пиррол-2-карбоновой кислоты.
12.2.3.3. Реакции присоединения
В этих реакциях проявляется диеновый характер гетероциклов. Поэтому такие реакции наиболее характерны для фурана. Примерами могут быть присоединение водорода, галогенов и реакция диенового синтеза.
Водород присоединяется в присутствии катализаторов (Ni, Pd, Pt) при нагревании и под давлением. Из пиррола, фурана и тиофена образуются соответствующие тетрагидропроизводные — пирролидин, тетрагидрофуран и тиофан:
H2 / kat, P, T
X X
(X = NR, O, S)
Труднее всех гидрируется тиофен и его производные, а легче — фуран. Присоединение галогенов наиболее характерно для фурана, причѐм
продукт присоединения может отщеплять молекулу галогеноводорода, давая продукт формального замещения, например:
+ |
Br2 |
|
|
Br |
|
Br |
|
|
|
|
Br |
|
|
H |
O H |
- HBr |
|
||||||
O |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|||||
|
|
|
|
2,5-дибром-2,5-дигидрофуран |
2-бромфуран |
||||||
610

Реакции диенового синтеза характерны, главным образом, для фурана. Это, например, взаимодействие с малеиновым ангидридом:
|
O |
O |
O |
|
|
|
|
O + |
O |
|
O |
|
O |
|
O |
|
|
|
Тиофен с малеиновым ангидридом не реагирует, но он может быть введѐн в реакцию Дильса–Альдера при использовании очень реакционноспособных алкинов, например дицианоацетилена; но продукт присоединения легко теряет атом серы и превращается во фталодинитрил:
|
CN |
|
|||
|
|
|
to |
||
S + |
C |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|||
|
CN |
|
|||
S |
CN |
|


 CN
CN
- S

 CN CN
CN CN
Пиррол взаимодействует с малеиновым ангидридом как с электрофилом:
|
|
O |
|
O |
|
|
|
|
|
|
+ |
|
|
O |
|
+ |
O |
|
|
|
|
|
||
N |
+ |
|
N |
O |
H |
|
O |
H |
|
|
|
12.2.3.4. Реакции замены гетероатома
Эти реакции представляют взаимное превращение пиррола, фурана и тиофена:
NH3
O |
|
H2O |
N |
|
H2S |
NH3 |
H |
|
|
|
|
|
H O |
|
H2S |
|
2 |
|
|
S
Они были открыты в 1936 году Ю.К. Юрьевым* и называются также син-
тезом Юрьева или циклом Юрьева.
611

Реакции осуществляются при температуре 400 500 С в присутствии катализатора Al2O3. Практическое значение имеют только превращения фурана в пиррол и тиофен (с выходом 40%):
|
|
+ NH3 |
+ H2O |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|||
|
|
|||||
|
|
|
+ H2S |
+ H2O |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
В остальных четырѐх реакциях (с участием пиррола и тиофена) выход продуктов не превышает 2%.
Причиной предпочтительного участия фурана во взаимопревращениях в другие гетероциклы можно считать его меньшую ароматичность, а также наибольшую жѐсткость атома кислорода как оснόвного центра (по Р. Пирсону) в сравнении с азотом и серой в пирроле и тиофене. Тогда механизм превращения фурана, например в тиофен, можно представить в следующем виде:
+ O=Al O Al=O |
|
AlO2 |
- |
H2S |
+ |
|
|||
|
-HAlO2 |
|||
O |
O |
|
|
|
|
Al=O |
|
|
|
HC HC
O
+
S
H
CH
+ CH
Al=O
AlO2-
|
-SH |
HC |
CH |
+ |
HC |
CH |
|
|
|
O |
SH |
|
|
O=Al |
|
-HAlO2 S
(2 HAlO2 Al2O3 + H2O)
612

12.2.4. ОСОБЕННОСТИ ИНДОЛА
Название индола как конденсированной системы, содержащей гетероциклическое кольцо пиррола, — бензо[b]пиррол.



 ba N
ba N
H
Нумерацию атомов в индоле начинают с гетероатома, атомы углерода в пиррольном цикле могут быть обозначены также греческими буквами:
|
4 |
3 |
|
|
|
||
5 |
|
|
|
|
|
2 |
|
6 |
|
N |
1 |
|
7 |
||
|
H |
|
|
|
|
|
|
Индол и его производные — это бесцветные кристаллические вещества, не растворяющиеся в воде и имеющие своеобразный неприятный запах.
12.2.4.1. Строение
Молекула индола представляет 10- -электронную бициклическую сопряжѐнную систему, в которой участвует гетероатом со своей неподелѐнной электронной парой. В результате электронодонорного мезомерного эффекта атома азота повышается электронная плотность в положениях
3, 5 и 7:
-
-
 N- H
N- H
12.2.4.2. Кислотно-осόвные свойства
Сильные кислоты протонируют индол в положение 3, тем самым нарушается сопряжѐнная система пиррольного цикла, что приводит к его раскрытию и дальнейшим превращениям (димеризация, олигомеризация):
- |
H |
H |
H |
H |
|
|
|
|
|
|
+ H+ |
+ |
+ |
. . . |
N |
|
|
||
N |
|
N |
|
|
H |
H |
|
H |
|
613

Индол является слабой NH-кислотой (по кислотности сравним с пирролом). Он образует соли при действии щелочей, алкоголятов и металлорганических соединений (аналогично пирролу).
12.2.4.3. Реакции с электрофилами
Ввиду выраженных ацидофобных свойств индола его реакции с сильными электрофилами в кислой среде приводят к продуктам олигомеризации. С более мягкими электрофилами осуществляется замещение в-положение. Если оно занято, то реакция протекает в -положение. Объяснить такое направление электрофильного замещения можно сравнением устойчивости образующихся -комплексов:
|
+ |
E |
|
+ |
E+ |
H |
|
N |
N |
||
|
|||
H |
H |
|
H E |
H E |
+ |
|
|
+ |
N |
N |
H |
H |
(Здесь не приведены граничные структуры с участием -электронной плотности бензольного кольца по причине их значительно меньшего вклада, но таких структур было бы в каждом случае на три больше.)
Как видно из приведѐнных направлений взаимодействия индола с электрофильной частицей, делокализация положительного заряда в случае атаки по -атому (второе направление) полнее и такой -комплекс устойчивее.
Нитрование индола осуществляется так же, как и пиррола, через образование солей, сульфирование — пиридинсульфотриоксидом, а для бромирования используется комплекс брома с диоксаном:
NO2
|
+ |
|
|
|
|||
|
|
|
|
||||
- |
+ H5C2O-NO2 |
|
-C2H5OK |
|
|
|
|
|
|
|
|
|
|
||
N K+ |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
H |
614

|
|
|
|
SO3- |
|
|
N: SO3 |
|
|
N |
- |
+ |
|
N |
N:H |
|
|||
H |
|
|
|
H |
|
|
|
|
Br |
|
O |
O: Br+ Br- |
|
|
|
-HBr, |
- O |
O |
N |
|
|
|
|
H |
Алкилирование может осуществляться как по атому азота, так и по атому углерода. Направление реакции определяется главным образом температурой, а также природой металла и растворителем. Это можно изобразить схемой:
R
|
+ |
R-I |
|
|
T |
- |
-MI |
|
|
||
|
|
N |
|
||
N M+ |
|
|
|
N |
|
|
|
|
|
R |
H |
12.2.4.4. Реакции окисления
Мягкое окисление индола даѐт синий краситель индиго:
2 |
[O] |
2 |
|
||
N |
|
|
H |
|
|
O |
H |
|
|
N |
|
N |
|
|
H |
O |
|
индиго (синего цвета)
OH |
|
O |
|
2 |
[O] |
|
|
|
N |
|
N |
H |
|
H |
|
|
ONa H |
Na2S2O4, NaOH |
|
N |
|
|
|
O2 |
|
N |
|
|
H NaO |
|
|
соль белого индиго |
Сильными окислителями (KMnO4) индиго окисляется до изатина:
615

O |
H |
|
O |
|
N |
|
|
|
[O] |
2 |
O |
|
|
||
N |
|
|
N |
H |
O |
|
H |
изатин
12.2.5.СПОСОБЫ ПОЛУЧЕНИЯ ПИРРОЛА, ФУРАНА, ТИОФЕНА, ИНДОЛА
Внебольших количествах пиррол и тиофен содержатся в каменноугольной смоле. При этом тиофен выгоняется из неѐ вместе с бензолом.
К синтетическим способам получения можно отнести следующие.
1. Общим способом получения пиррола, фурана и тиофена и их производных является циклизация -дикарбонильных соединений. Механизм кислотно-катализируемого образования фуранов можно представить в следующем виде:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H+ |
+ |
|
|
R-C-CH2-CH2-C-R |
|
|
|
|
R-C-CH2-CH=C-R |
|
R-C-CH2-CH=C-R |
|||||||||||
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
|
|
|
O |
OH |
|
OH |
OH |
|||||||||
|
H |
|
H |
|
|
|
|
|
|
H |
|
|
H |
|
|
|
|
|
|
R |
+ |
R |
R + O |
R |
-H O |
R |
|
R |
|
O |
2 |
+ |
O |
||||||
HO |
|
|
HOH |
|
-H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
В синтезе пирролов необходима нуклеофильная атака аммиаком, а для получения тиофенов используются сульфиды фосфора. Например, механизм образования пирролов:
R-C-CH2-CH2-C-R |
|
|
+ :NH3 |
|
|
|
|
|
R-C-CH2-CH2-C-R |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
- |
+ |
|
|
|
|
|
|
|
|
||||||||
|
|
O |
|
|
|
|
|
|
|
|
|
|
O |
NH3 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R-C-CH2-CH2-C-R |
|
|
|
|
R-C-CH2-CH2-C-R |
|
|
|
|
H |
|
|
|
+ |
|
|
|
|||||||||||||||||||
-H2O |
|
|
|
|
R- |
|
|
|
|
R |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
O |
OH NH2 |
|
|
O |
|
|
NH |
|
|
|
O |
N |
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|||
616
H
H |
|
|
|
|
|
|
R |
N |
R |
-H2O |
R |
N |
R |
|
||||||
HO |
|
|
|
|
||
H |
|
|
|
H |
|
2. Для получения фурана и его производных используют природные моносахариды. При нагревании в присутствии минеральных кислот может образоваться фурфурол:
|
HC=O |
|
|
|
|
|||
H |
|
|
|
OH |
H+/ T |
|
O |
|
|
|
|
|
|||||
HO |
|
|
|
H |
|
|
|
C |
|
|
|
-3H2O |
|
||||
H |
|
|
|
OH |
O |
|||
|
|
|
H |
|||||
|
|
|
||||||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
CH2OH |
|
|
|
|
||
D-ксилоза |
|
|
фурфурол |
|||||
или другие производные фурана в зависимости от природы исходного моносахарида (гл. 7.1.2.3).
3. При нагревании гликаровых (гл. 7.1.2.1) кислот образуется пирослизевая кислота:
|
HOOC-CHOH-CHOH-CHOH-CHOH-COOH |
|
H+, t o |
||||||||||||
|
|
|
|
||||||||||||
|
-3H2O |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
t o |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
HOOC |
O |
COOH |
-CO2 |
O |
COOH |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
пирослизевая кислота
4. Пиррол образуется при нагревании аммониевых солей гликаровых кислот:
|
+ - |
|
|
|
|
- + |
NH t o |
|||||||
|
NH4 OOC-CHOH-CHOH-CHOH-CHOH-COO NH4 |
|
3 |
|
||||||||||
|
-4H2O |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
t o |
|
|
|
|
|
|
|
+NH4-OOC |
|
COO-NH4+ |
|
|
|
|
|
||||
|
|
|
N |
|
|
|
|
|
N |
|||||
|
|
|
|
-NH3,-CO2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
H |
|
5. Универсальным и удобным в практическом выполнении методом получения производных пиррола является взаимодействие -амино-
617

кетонов с кетонами, содержащими реакционноспособную метиленовую группу (синтез Кнорра*). Например:
O |
|
H |
COOC2H5 |
|
H3C |
|
COOC2H5 |
|
H3C C |
H |
|
C |
|
OH- / 293 K |
|
|
|
|
|
|
|
|||||
H C |
+ |
|
C |
CH3 |
|
|
N |
CH3 |
|
|
|
||||||
|
|
|
|
|||||
2 |
|
|
|
|
|
|
||
NH2 |
|
O |
|
|
|
H |
|
|
6. При получении производных пиррола по Ганчу* в отличие от синтеза Кнорра используют конденсацию -хлоркетонов с аммиаком (или аминами) и ацетоуксусным эфиром.
|
|
COOC2H5 |
|
|
|
|
|
|
|
|
|
|
|
||||
H2C |
|
|
|
|
|
COOC2H5 |
|
O |
|
COOC2H5 |
|||||||
+ |
NH3 |
|
|
|
HC |
|
R C |
|
CH2Cl |
|
|
||||||
|
|
|
|||||||||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
C |
|
|
|
C |
|
|
|
R |
|
CH3 |
|||||||
|
|
|
|
|
|
|
|
|
|||||||||
O CH3 |
|
|
|
|
H2N CH3 |
|
|
|
|
N |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||||
H
7.Пиррол и тиофен могут быть получены из фурана с помощью ре-
акций Юрьева (см. выше).
8.Для получения индола и его производных практическое значение имеет реакция Фишера, которая ещѐ называется синтезом индолов по Фи-
шеру. Это метод получения производных индола из фенилгидразонов альдегидов или кетонов. Реакция протекает при нагревании арилгидразонов в
присутствии таких катализаторов, как ZnCl2, разбавленная H2SO4, концентрированная CH3COOH, спиртовый раствор HCl:
H2C |
R |
|
|
R |
C |
R' |
|
|
|
|
450 470 K |
|
||
|
|
R' |
||
|
|
|
||
|
N |
|
- NH3 |
|
N |
|
N |
||
|
|
|
||
H |
|
|
|
H |
Общепринятый в настоящее время механизм этой реакции можно представить в следующем виде:
H2C |
R |
HC |
R |
|
|
HC |
R |
|
C R' |
C |
R' |
H+ |
C R' |
||||
|
|
|
||||||
|
|
|
|
|||||
|
|
|
NH |
|
|
|
+ |
|
N |
N |
N |
|
|
N |
NH2 |
||
|
|
|
|
|
||||
H |
|
H |
|
|
|
H |
|
618

H |
CH |
R |
|
|
R |
|
H |
R |
|
|
R' |
CH |
+ |
R' |
C |
||||
|
|
|
C |
|
C |
|
C R' |
||
|
|
|
|
|
|
|
|||
|
|
+NH |
|
+ |
|
+ |
|||
|
NH |
NH2 |
NH2 |
NH2 |
|||||
|
|
|
2 |
|
|
N |
|||
|
|
|
|
|
|
|
|
H H |
|
C |
RH |
|
R |
|
|
|
|
|
C R' |
-NH4+ |
R' |
N |
+ |
N |
|
H |
NH3 |
H |
|
12.2.6.ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ И МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Пиррол — бесцветная жидкость с запахом хлороформа с температурой кипения 130 С, малорастворим в воде.
Пирролидинкарбоновые кислоты (пролин и гидроксипролин) являют-
ся важными протеиногенными аминокислотами гл. 6.9.
Порфин — тѐмно-красное кристаллическое вещество. Его молекула содержит четыре пиррольных кольца:
N


 N: HH :N
N: HH :N


N
За счѐт двух водородных атомов (у атомов азота), которые могут быть замещены металлом, образуются устойчивые комплексы, в которых ион металла образует связи одновременно с четырьмя атомами азота.
Замещѐнные порфины называются порфиринами. Они лежат в основе очень важных природных соединений. Например, гем — небелковая часть красного вещества крови гемоглобина. По химическому составу гем является порфирином, содержащим катион Fe2+.
619
