
А Е Щеголев Органическая химия 2016 / 12 Гетероциклические соединения
.pdf
H3C HC CH2
H3C
 N
N 
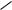 CH3
CH3
N: Fe :N
Fe :N
HOOC-CH2-CH2 |
N |
CH |
CH2
HOOC-CH2-CH2 CH3
гем
Другой пример — зелѐный пигмент растений хлорофилл, содержащий катион Mg2+. Из растений выделены хлорофилл а (сине-чѐрные кристаллы) и хлорофилл b (тѐмно-зелѐные кристаллы). Хлорофиллы были выделены Р.М. Вильштеттером*, им же была установлена формула хлорофилла а и структура его отдельных фрагментов. За эти работы Р.М. Вильштеттер был удостоен в 1915 году Нобелевской премии.
H3C |
|
CH=CH2 |
H3C |
CH=CH2 |
|||
|
|
|
|
|
|
|
O |
H3C |
|
N |
CH3 |
H3C |
|
N |
CH |
|
|
|
|
||||
CH2CH2 |
N: |
Mg N |
CH2CH2 |
N: |
Mg N |
|
|
|
N |
C2H5 |
|
N |
C2H5 |
||
C O |
|
C O |
|
||||
|
|
|
|
|
|
||
OC20H39 HC |
|
|
|
OC20H39 HC |
|
|
|
CH3OOC |
C |
|
CH3 |
CH3OOC |
C |
CH3 |
|
|
|
|
|
||||
|
O |
|
|
|
O |
|
|
хлорофилл а |
|
|
хлорофилл b |
|
|||
Витамин В12 (кобаламины: природные — оксикобаламин и метил-
кобаламин, лекарственная форма — цианкобаламин) — тѐмно-красные кристаллические вещества, растворимые в воде. В основе молекул лежит фрагмент, структурно похожий на порфириновый, содержащий четыре пиррольных кольца и катион Co2+. Витамин В12 является активным средством против анемии, его применяют для лечения злокачественного малокровия, заболеваний нервной системы и печени.
Билирубиноиды — окрашенные вещества, которые содержат четыре бензольных кольца и встречаются в организмах позвоночных, а также некоторых беспозвоночных и даже в водорослях. Они образуются при биологическом окислении гемоглобина и родственных соединений. Важней-
620

шим их представителем является окрашенный в оранжевый цвет билирубин. Он встречается в желчи, а также в желчных камнях и выделяется с калом и мочой.
|
|
|
COOH |
COOH |
|
|
|
|
H2C |
|
CH2 |
|
CH |
|
|
|
|
|
|
2 |
|
|
|
H C |
CH |
H C |
CH |
H C |
CH3 |
H3C HC CH |
|
|
3 |
2 |
2 |
|
|
2 |
|
3 |
|
|
|
|
|
|
|
O |
N |
|
N |
|
N |
N |
O |
|
|
|
|
||||
|
H |
|
H |
|
H |
H |
|
|
|
|
билирубин |
|
|
||
Фуран — бесцветная жидкость с запахом хлороформа; температура кипения 31 С, малорастворим в воде.
Получают фуран из фурфурола (в промышленности) или пирослизевой кислоты (в лаборатории).
Фурфурол — бесцветная или слегка желтоватая жидкость с запахом корочки свежеиспечѐнного ржаного хлеба; температура кипения 162 С, умеренно растворим в воде (10 г на 100 г воды).
Фурфурол образуется при нагревании некоторых моносахаридов (в частности, ксилозы) с минеральными кислотами (гл. 7.1.2.3). Поэтому фурфурол получают из растительного сырья.
Фурфурол является очень важным исходным веществом для органического синтеза. Каталитическим окислением из него получают малеиновый ангидрид:
|
|
O |
[O] |
|
|
|
C |
|
|
O |
|
O |
|
O |
O |
||
H |
|
|
|
||
|
|
|
|
|
Нитрование фурфурола лежит в основе производства таких бактерицидных препаратов, как фурацилин, фуразолидон, фурадонин:
621

|
O |
CH3COONO2 |
|
|
|
O |
|||
|
|
|
|
|
|
|
|||
|
C |
|
O2N |
|
CH=N-NH-C-NH2 |
||||
O |
|
|
. . . |
|
O |
||||
H |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
фурацилин |
||
|
|
|
|
|
|
|
|
||
O2N |
|
CH=N |
N |
O |
O |
|
|
||
|
|
|
|
|
|
|
|
O |
|
|
|
фуразолидон |
|
|
|
|
|
|
O |
O2N |
|
CH=N |
N |
NH |
O |
|
|||
|
|
|
|
|
|
|
|
O |
|
|
|
фурадонин |
|
|
Тиофен — бесцветная жидкость с запахом, похожим на бензол; температура кипения 84 С, нерастворим в воде. Получают из каменноугольной смолы.
Индол — бесцветное кристаллическое вещество с неприятным запахом; температура плавления 52 С, температура кипения 253 С, нерастворим в воде. Используют в органическом синтезе и в парфюмерии.
Триптофан — одна из незаменимых протеиногенных -ами- нокислот (гл. 6.9).
Триптамин — «биогенный амин», образующийся в организме человека и животных при декарбоксилировании аминокислоты триптофана под действием ферментов — декарбоксилаз.
|
|
CH2- |
CH-COOH |
|
|
|
|
CH2-CH2-NH2 |
|
|
|
|
|||||
|
|
NH2 |
|
|
|
|
|
|
|
|
- CO2 |
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
N |
|
|
|
|
N |
|
|
|
H |
|
|
|
|
H |
|
триптофан |
|
|
триптамин |
|||||
Скатол (3-метилиндол) является конечным продуктом биологических превращений триптофана. Он обладает пронзительным запахом фекалий, однако в очень больших разбавлениях имеет цветочный запах и поэтому добавляется к цветочным композициям.
Серотонин (3-аминоэтил-5-гидроксииндол) является «биогенным амином». Он обладает высокой биологической активностью, содержится в сыворотке теплокровных, участвует в поддержании тонуса сосудов и про-
622

цессе передачи нервных импульсов в центральной нервной системе. В организме образуется из триптофана.
Буфотенин был впервые выделен из кожи жаб. Кроме того, он содержится в некоторых растениях. Вызывает повышение кровяного давления и парализует дыхательные центры головного и спинного мозга.
Псилоцин является психоактивным веществом, выделенным из мексиканского священного гриба Teonanacatl. Он повышает психическую возбудимость и вызывает галлюцинации.
H2N |
(CH3)2N |
(CH3)2N |
||
CH2 |
CH2 |
OH |
CH2 |
|
CH2 |
CH2 |
CH2 |
||
|
||||
HO |
HO |
|
|
|
N |
N |
|
N |
|
H |
H |
|
H |
|
серотонин |
буфотенин |
псилоцин |
|
|
12.3. ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ С ДВУМЯ ГЕТЕРОАТОМАМИ
Среди этих гетероциклических соединений наиболее важны в практическом отношении имидазол, пиразол, оксазол, тиазол, изоксазол, изотиазол и конденсированные системы на их основе бензимидазол и бензотиазол.
N |
|
N |
N |
|
|
N |
|
|
N |
N |
N |
O |
S |
O |
H |
H |
|
|
|
имидазол |
пиразол |
оксазол |
тиазол |
изоксазол |
|
|
N |
N |
|
|
N |
N |
S |
|
|
S |
|
||
|
|
H |
|
|
|
изотиазол |
бензимидазол |
бензотиазол |
|
623

12.3.1. НОМЕНКЛАТУРА ИМИДАЗОЛА И ПИРАЗОЛА
Систематические названия имидазола и пиразола — 1,3-диазол и 1,2- диазол. Атомы цикла нумеруются начиная с гидрированного (или замещѐнного) азота (N–H или N–R) в направлении второго атома азота по кратчайшему пути.
4 |
|
N 3 |
4 |
3 |
|
|
N 2 |
||
5 |
2 |
5 |
||
|
N1 |
N |
1 |
|
|
H |
H |
|
|
Названия радикалов, образованных от этих гетероциклов, — имидазолил и пиразолил, с указанием атома, имеющего свободную валентность, цифровым локантом.
12.3.2. СТРОЕНИЕ ИМИДАЗОЛА И ПИРАЗОЛА
Молекулы имидазола и пиразола, так же как и пиррола, являются сопряжѐнными системами. Природа атомов азота, входящих в гетероцикл, различна. Один из них образует двойную связь с атомом углерода и в целом участвует в образовании двух -связей и -связи за счѐт своих валентных электронов. Неподелѐнная электронная пара этого атома азота находится на sp2-гибридной орбитали, ось которой лежит в плоскости гетероцикла, и потому эти электроны не могут участвовать в сопряжении с-электронной системой кольца. Такой атом азота называется пиридиновым, так как по природе идентичен атому азота в шестичленном гетероцикле пиридине (см. далее).
Другой атом азота по природе является таким же, как и в пирроле и называется пиррольным. Его неподелѐнная электронная пара, так же как и в пирроле, участвует в сопряжении с двумя -связями кольца. В результате здесь тоже образуется циклическая сопряжѐнная система с шестью-электронами (четыре -электрона от двух двойных связей и два — от пиррольного атома азота). По сравнению с пирролом имидазол и пиразол имеют более ароматический характер, так как пиридиновый атом азота, являясь акцептором, способствует более полной делокализации неподелѐнной электронной пары пиррольного азота по кольцу, а значит, и более равномерному распределению электронной плотности в кольце.
624

|
N |
пиридиновый азот |
|
|
|
|
|
|
|
|
N |
N |
|
пиррольный азот |
N |
|
H |
||
H |
|
|
|
|
|
|
12.3.3.ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ИМИДАЗОЛА И ПИРАЗОЛА
Имидазол и пиразол являются бесцветными кристаллическими веществами, но их N1-производные (не содержащие связи N–H) могут быть жидкостями. Кристаллическое состояние вещества самих диазолов обусловлено наличием прочных межмолекулярных водородных связей. Например, для имидазола:





 N
N  N H
N H 




 N
N  N H
N H
для пиразола:
 N
N




 H
H
N 
N
H 




 N
N
Следствием этого являются как их высокие температуры кипения (например, в сравнении с пирролом), так и существенная разница этих температур для имидазола и пиразола между собой (для имидазола температура кипения составляет 256 С, для пиразола — 187 С, для пиррола — 131 С).
На химические свойства диазолов, в отличие от пиррола оказывает влияние наличие пиридинового атома азота.
12.3.3.1. Кислотно-оснόвные свойства
Имидазол и пиразол обладают амфотерными свойствами. Они являются слабыми NH-кислотами аналогично пирролу.
N |
OH- |
N |
N - |
N |
|
|
- |
|
- |
||
|
-H2O |
|
N |
||
N |
N |
N |
|||
|
H
625

N |
OH- |
- N |
N - |
- N |
|
-H2O |
|||||
N |
N |
N |
N |
||
|
H
В результате при проявлении ими кислотных свойств в анионе атомы азота становятся идентичными друг другу.
Но в сравнении с пирролом кислотные свойства диазолов выражены несколько сильнее, что является результатом акцепторного влияния пиридинового атома азота. Поэтому ряд уменьшения кислотных свойств можно показать следующим образом (в скобках приведено значение рКа):
пиразол (14.2) имидазол (14.2) > пиррол (17.5).
Имидазол и пиразол обладают оснόвными свойствами средней силы за счѐт пиридинового атома азота (рКb имидазола 6.9, а рКb пиразола 11.5). Более низкое значение основности для пиразола связано с наличием N–N- связи в его молекуле и проявлением, таким образом, сильного –I-эффекта пиррольного атома азота, понижающего основность пиридинового азота.
В результате присоединения протона образуются стабильные катионы, циклическая сопряжѐнная система не нарушается, а положительный заряд в равной степени делокализуется по обоим атомам азота:
|
|
+ |
|
|
|
NH |
N |
H+ |
NH |
|
NH |
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ |
N |
|
N |
|
N |
|
N |
|
|
H |
|
H |
|
H |
H |
|
N |
H+ |
+ |
|
NH |
+ |
NH |
|
NH |
+ |
|
|||
N |
|
N |
N |
N |
|
|
H |
|
H |
H |
H |
|
|
В катионе атомы азота становятся идентичными друг другу.
Диазолы не обладают ацидофобностью, как и все гетероциклы с двумя гетероатомами. Ароматичность этих соединений сохраняется и в протонированной форме.
Для замещѐнных диазолов характерны таутомерные превращения. В результате протонного переноса меняется положение заместителей в кольце. Так, таутомерия монозамещѐнных диазолов легко объясняется равнозначностью атомов азота в катионной и анионной формах. Например, превращение 3-метилпиразола в 5-метилпиразол
626

CH3 |
|
|
N |
H3C |
N |
N |
N |
|
H |
|
H |
можно представить так:
CH3 |
|
CH3 |
CH3 |
CH3 |
N + |
|
N |
- N + |
+ NH |
N |
N |
|
N |
N |
H |
H |
|
|
H |
3-метилпиразол |
|
|
|
|
CH3 |
|
CH3 |
|
|
NH |
+ |
NH |
|
|
N |
|
N |
|
|
5-метилпиразол
12.3.3.2. Реакции алкилирования и ацилирования по атому азота
Диазолы легко вступают во взаимодействие с алкилирующими и ацилирующими агентами с участием пиридинового атома азота. По механизму эти реакции — типичные реакции нуклеофильного замещения, в которых имидазол и пиразол являются нуклеофилами. При этом алкилирование избытком галогеналкана приводит к диалкильному производному, а при ацилировании образуется только моноацилированный гетероцикл. Например, взаимодействия имидазола с йодалканом и с ацилхлоридом протекают так:
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
N |
- |
|
|
|
N |
|
R |
- |
OH |
- |
|
NR |
- |
|
|
|
|
|
NR |
- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
R |
I |
|
|
|
|
|
|
|
I |
|
|
R |
I |
|
|
|
|
|
I |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
+ |
|
||||||||
N |
|
|
|
|
N |
|
N |
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
||||||||||||||||||||
H |
|
|
|
|
H |
|
-I- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ O |
|
|
|
|
|
|
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
N |
|
|
|
N-CRCl- |
OH- |
|
|
|
N-CR |
|
|
||||||||||||||||||
|
|
|
|
|
R-C Cl |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
N |
|
|
|
|
|
|
|
||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
-Cl- |
|
|
|
|
|
|
|
|
|
|
||||||
627

12.3.3.3. Реакции электрофильного замещения
Атака электрофильного реагента может осуществляться как по атому азота, так и по атому углерода кольца. На атомах азота электронная плотность выше, однако образующиеся с азотом связи недостаточно прочны, и продукты такого взаимодействия значительно менее стабильны, чем продукты электрофильных реакций по углероду.
Многие типичные SE-реакции протекают в кислой среде. Но имидазол и пиразол протонируются кислотами, при этом молекулы гетероциклов превращаются в мало-реакционноспособные катионы. Это снижает активность диазолов в таких реакциях, как нитрование, сульфирование, но, тем не менее, имидазол и пиразол нитруются нитрующей смесью и сульфируются в обычных условиях с удовлетворительными выходами. Имидазол образует продукты замещения по 4-му или 5-му атому кольца, пиразол — 4-замещѐнные продукты. Например, нитрование можно представить так:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
NH |
|
|
|
+ |
|
|
|
|
|
||||||||||||||
|
|
N |
|
|
H+ |
|
|
|
+ |
|
NO2+ |
|
O2N |
|
|
O N |
|
|
|
|
NH |
|
|
|
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-H+ |
|
|||||
|
N |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
+ |
|
|
|
|
|
|
|
|
2 |
|
|
+ |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
H |
|
N |
|
|
|
|||||||||||||||||||
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
O2N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
-H |
+ |
|
|
|
|
O2N |
|
|
N |
4-нитроимидазол |
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
O2N |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
5-нитроимидазол |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
-H |
+ |
|
|
O2N |
|
N |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
O N |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
2 |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
H+ |
+ |
|
|
|
|
|
|
NO2+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
||||||||||||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
NH |
|
-H+ |
|
+ |
N |
|
-H+ |
|
|
||||||||||||||||||||
|
N |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
N |
||||||||||
|
H |
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
H |
||||||||||
4-нитропиразол
Однако если SE-реакцию удаѐтся провести в щелочной среде, то она протекает легко. Примерами могут служить реакция бромирования и взаимодействие с некоторыми слабыми электрофилами, например, с катионом арендиазония, как показано для имидазола в следующих схемах:
628

|
|
|
|
N |
|
OH- |
|
|
|
N |
|
|
Br |
:Br - |
|
|
|
N |
|
|
Br |
|
|
|
|
|
|
NH |
|
|
|
|
||||||||||||||||||
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. . . |
||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Br |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
-H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
N |
|
|
|
N |
|
|
|
-Br |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
/ OH- |
|
|
Br |
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
. . . |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
Br |
N |
|
|
Br |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2,4,5-трибромимидазол |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
N |
|
|
|
- |
|
|
|
|
N |
|
+ |
|
|
|
|
|
N |
|
|
N=N-Ar |
|
|
|
|
|
|
|
|
|
|
|
NH |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
N=N-Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
N |
|
-H2O |
|
|
N |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
N |
|
|
||||||||||||||||||
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-арилазоимидазол |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
N |
|
H |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
5-арилазоимидазол
Существенно отличается от имидазола и пиразола поведение тиазола и оксазола по отношению к электрофильным агентам. Тиазол не вступает в реакцию нитрования даже при использовании азотной кислоты в олеуме при 160 С, но метилтиазолы успешно нитруются, причѐм преимущественно образуются 5-нитро- и в меньшем количестве 4-нитропроизводные. Гораздо менее реакционноспособные оксазолы не подвергаются нитрованию вовсе.
Сульфирование тиазола протекает в жѐстких условиях. Для этого требуются высокие температуры (250 С) и присутствие сульфата ртути (II) в качестве катализатора. Оксазол не сульфируется.
12.3.4. СПОСОБЫ ПОЛУЧЕНИЯ
Для синтетического получения имидазола, пиразола, оксазола, тиазола, а также других пятичленных гетероциклических соединений с двумя гетероатомами используют исходные вещества, содержащие структурные фрагменты необходимого гетероцикла. Приведѐм некоторые примеры таких синтезов.
629
