
- •§1.Общая характеристика атомов.
- •§2.Законы теплового излучения.
- •§3.Испускание и поглощение излучения по квантовой теории. Вывод формулы Планка по Энштейну., 1916г.
- •§5. Ядерная модель атома. Формула резерфорда.
- •§14. Дифракция рентгеновских лучей (рл) на кристаллической решетке.
- •§15. Формула Вульфа-Брегга.
- •§16. Экспериментальное наблюдение дифракции
- •§17. Корпускулярно волновой дуализм.
- •§18. Эффект Комптона.
- •§19. Волновые свойства частиц.
- •§20. Экспериментальное подтверждение гипотезы де Бройля.
- •§21. Статистическая интерпретация волн де Бройля.
- •§22. Соотношение неопределенностей Гейзенберга 1927г.
- •§23. Постулаты квантовой физики.
- •§24. Принцип суперпозиции квантовых состояний.
- •§25. Примеры движения квантовой частицы в стационарных
- •§26. Момент импульса квантовой теории.
- •§27. Гипотеза Уленбека (Юленбека) и Гаудсмита о спине электрона.
- •§28. Спектр атома водорода.
- •§29. Щелочные металлы.
- •§36. Эффект Зеемана.
- •§37. Неразличимость тождественных квантовых частиц.
- •§ 38. Периодическая система элементов (псэ)
§3.Испускание и поглощение излучения по квантовой теории. Вывод формулы Планка по Энштейну., 1916г.
Энштейн опирался на постулаты Бора, и кроме того, постулировал наличие вынужденного или индуцированного излучения.
Постулаты Бора:
Атом (электрон атома) может находиться только в определенных энергитических состояниях
 , называемых стационарными. При этом
атом не испускает и не поглощает свет.
, называемых стационарными. При этом
атом не испускает и не поглощает свет.Испускание и поглощение излучения происходит при переходе атома из одного стационарного состояния в другое.


Существует
три вида взаимодействия излучения с
веществом. Рассмотрим систему, состоящую
из двух уровней энергии
 .
Пусть эта система находится в ЭМП
(электромагнитном поле) с объемной
плотностью излучения
.
Пусть эта система находится в ЭМП
(электромагнитном поле) с объемной
плотностью излучения .
.
Спонтанное испускание излучения – самопроизвольный ни от чего независящий случайный процесс перехода атома из состояния с более высокой энергией
 в состояние с более низкой
в состояние с более низкой .
.


Вероятность этого процесса определяется выражением:

где
 – коффициент Энштейна.
– коффициент Энштейна.

Вынужденное поглощение излучения

 –коэффициент
Энштейна для вынужденного поглощения,
которое является лучевым процессом.
–коэффициент
Энштейна для вынужденного поглощения,
которое является лучевым процессом.

Вынужденное испускание


Первый фотон индуцирующий (первичный)
Второй фотон индуцированный (вторичный)
Первичный и вторичный фотоны полностью идентичны друг другу, эти фотоны образуют когерентную волну.
 ,
, ,
, – коэффициенты Энштейна, не зависящие
от внешних условий (температура, давление
и т.д.), характеризуют конкретный квантовый
переход.
– коэффициенты Энштейна, не зависящие
от внешних условий (температура, давление
и т.д.), характеризуют конкретный квантовый
переход.
Рассмотрим случай термодинамического равновесия между системой атомов и ЭМ излучением.
 –заселенности
уровней 1 и 2, т.е. количество атомов в
единице объема, имеющих энергии
–заселенности
уровней 1 и 2, т.е. количество атомов в
единице объема, имеющих энергии
 соответственно. При термодинамическом
равновесии
соответственно. При термодинамическом
равновесии определяются распределением Больцмана,
которое имеет вид:
определяются распределением Больцмана,
которое имеет вид:

 –cтатистический
вес уровня или кратность вырождения,
т.е. число различных состояний атома, в
которых его энергия одна и та же и равна
–cтатистический
вес уровня или кратность вырождения,
т.е. число различных состояний атома, в
которых его энергия одна и та же и равна


В состоянии термодинамического равновесия число прямых процессов в единицу времени должно быть равно числу обратных процессов.

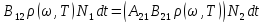


Рассмотрим случай очень больших температур:




С точностью до статистических весов коэффициенты Энштейна для вынужденного испускания и поглощения совпадают. А т.к. они не зависят от T – это выполняется всегда, а не только в рассмотренном случае.


В случае малых частот или высоких температур:

Если пренебречь вынужденным испусканием, то:

Частная формула Винна:



Рассмотрим радиационный распад уровня, т.е. только процесс спонтанного излучения в отсутствии внешнего поля.


 –убыль
заселенности второго уровня.
–убыль
заселенности второго уровня.



 -
для большинства атомных уровней, такие
уровни уширены.
-
для большинства атомных уровней, такие
уровни уширены.
Также существуют метастабильные или долгоживущие уровни:

§5. Ядерная модель атома. Формула резерфорда.
Модели атомов.
Модель Томсона 1903г.
Атом представляет собой каплю положительно заряженной жидкости, в которой взвешены отрицательно заряженные электроны.

Ядерная или планетарная модель.

Атом
представляет собой тяжелое ядро с
положительным зарядом
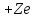 и вращающимися вокруг ядра по эллиптическим
орбитам электронами.
и вращающимися вокруг ядра по эллиптическим
орбитам электронами.



Опыт Резерфорда.

 частицы,
попадая на экран, вызывают сцинтилляции
– вспышки света, которые наблюдаются
в микроскоп и подсчитываются.
частицы,
попадая на экран, вызывают сцинтилляции
– вспышки света, которые наблюдаются
в микроскоп и подсчитываются.




Таким
образом, было установлено, что большинство
 - частиц отклоняется на относительно
небольшие углы, но есть частицы,
отклоняющиеся существенно (до
- частиц отклоняется на относительно
небольшие углы, но есть частицы,
отклоняющиеся существенно (до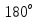 )
– рассеяние назад.
)
– рассеяние назад.
Резерфорд
разработал количественную теорию
рассеяния
 - частиц, основываясь на ядерной модели
и предполагая, что при прохождении
- частиц, основываясь на ядерной модели
и предполагая, что при прохождении - частицы рядом с ядром на нее действует
Кулонова сила отталкивания со стороны
ядра.
- частицы рядом с ядром на нее действует
Кулонова сила отталкивания со стороны
ядра.

Траектория – гипербола:

b – прицельный параметр.
Значительное отклонение от своего первоначального направления может быть обусловлено только тяжелым положительно заряженным ядром, сосредоточенным в малом объеме. Электроны не могут оказать значительного влияния вследствие своей малой массы.

 -
число частиц, пролетающих через единицу
площади поперечного сечения пучка в
единицу времени - плотность потока
-
число частиц, пролетающих через единицу
площади поперечного сечения пучка в
единицу времени - плотность потока
 частиц.
частиц.
 -
число
-
число
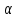 -
частиц, рассеянных в единицу времени в
интервале углов
-
частиц, рассеянных в единицу времени в
интервале углов .
.
Рассмотрим рассеяние на одном ядре.
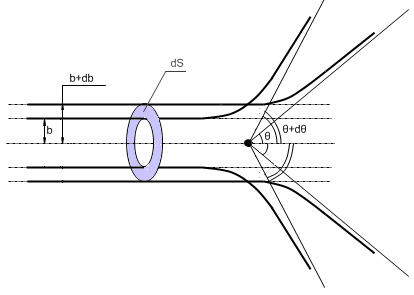
Если
на единицу площади фольги приходится
 ядер, то:
ядер, то:

Из закона сохранения импульса можно показать, что:

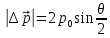




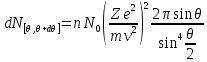




Элемент телесного угла между растворами двух конусов:

Формула Резерфорда:

Удалось экспериментально проверить.
Формула
Резерфорда согласуется с экспериментом.
Кроме того, её справедливость была
подтверждена в опытах с различными
металлическими пленками, т.е. при
различных Z,
n,
а также при различных
 .
.
Также
было установлено, что элементы в
периодической системе располагаются
в порядке возрастания Z,
а не массового числа А, определены
границы применимости закона Кулона.
Выяснилось, что он работает вплоть до
расстояний
 .
.
Оценка размера ядра.

Рассмотрим ядро серебра (серебряную пленку)




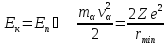

Т.к.
система неподвижных электрических
зарядов является неустойчивой, Резерфорду
пришлось предположить, что
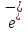 вращается вокруг ядра, что противоречило
классической ЭД.
вращается вокруг ядра, что противоречило
классической ЭД.
Всякая заряженная частица, движущаяся с ускорением – испускает ЭМВ, т.е. теряет энергию, а значит электроны в атоме Резерфорда со временем должны упасть на ядро. Но т.к. атом – устойчивая система, то классические законы стали к нему не применимы.
Законы, по которым построен атом, были изучены благодаря исследованию атомных спектров.
Закономерности в спектре атома водорода.
Спектр
– зависимость интенсивности
 или энергии излучения
или энергии излучения от частоты
от частоты или длины волны
или длины волны .
.
Нагретые тела испускают сплошные (непрерывные) спектры.

Атомарные или ионные газы испускают линейчатый ( дискретный ) спектр.

Молекулярные газы испускают полосатые спектры.

Спектральные линии расположены не беспорядочно, а в соответствии с определенными закономерностями и объединены в серии.
Для
характеристики спектров используют
частоту
 ,
длину волны
,
длину волны и спектральное волновое число
и спектральное волновое число
 ,
,

 -
количество длин волн в вакууме,
укладывающихся на 1см.
-
количество длин волн в вакууме,
укладывающихся на 1см.
 -
волновое число.
-
волновое число.
Рассмотрим линии серии Бальмера атома водорода (1885г.), которые находятся в видимой и ультрафиолетовой области.

 -
граница серии, за ней сплошной спектр.
-
граница серии, за ней сплошной спектр.
 -
обобщенная формула Бальмера.
-
обобщенная формула Бальмера.
 -
постоянная
Ридберга.
-
постоянная
Ридберга.

Серия Лаймана – УФО (ультрафиолетовая область)

Серия Бальмера

Серия Пашена – БИКО (ближняя инфракрасная область).
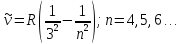
Серия Брекета

Серия Пфунда

Все серии атома водорода можно описать обобщенной формулой Бальмера:

Зафиксировав
 из общей формулы Бальмера, получают
конкретные спектральные серии, которые
принято характеризовать спектральными
термами:
из общей формулы Бальмера, получают
конкретные спектральные серии, которые
принято характеризовать спектральными
термами:

 -
комбинационный принцип Ритца.
-
комбинационный принцип Ритца.
Любую линию в спектре можно получить, как комбинацию термов, однако не всякая комбинация дает линию, присутствующую в спектре.
Разрешенные линии в спектре устанавливаются правилами отбора.
Постулаты Бора.
1913г. Нильс Бор опирался на идею Планка, согласно которой излучение испускается не непрерывно, а порциями или квантами с энергией:

Атом – квантовая система, состоящая из ядра и электронов, которая может находится не во всех состояниях, допускаемых классической теорией, а только в определенных квантовых состояниях, характеризуемых некоторыми значениями энергий

В этих состояниях, называемых стационарными, атом не излучает и не поглощает энергию.
Правило частот Бора.
При
переходе атома из стационарного состояния
с большей энергией
 в стационарное состояние с меньшей
энергией
в стационарное состояние с меньшей
энергией , если такой переход происходит из-за
излучения, испускается квант света –
фотон с энергией:
, если такой переход происходит из-за
излучения, испускается квант света –
фотон с энергией:

Переход
атома из состояния
 в
в может происходить без излучения,
например, при соударениях атомов.
может происходить без излучения,
например, при соударениях атомов.




Сравнивая вышестоящие три формулы получаем:

Спектральный терм – это величина с точностью до постоянной, пропорциональная значению энергии уровня атома.
Схема уровней атома водорода.


Состояние с наименьшей возможной энергией называется основным, все остальные – возбужденными.
Спектральная линия, возникающая при переходе между ближайшим к основному и основным уровнями энергии, называется резонансной или головной.
Атом – это устойчивая система, которая может существовать только в области отрицательной энергии атома. Движение электрона при этом финитно (finity), т.е. ограничено или конечно.
Если энергия атома положительна, то атом перестает существовать и есть отдельно положительный ион или электрон, движение которого инфинитно или неограниченно.
Энергия ионизации числено равна работе, которую необходимо затратить на то, чтобы удалить электрон с основного состояния на бесконечность.


Между уровнями энергии атомов могут выполняться 3 типа переходов:
Связано-связанные переходы, между дискретными уровнями энергии в области отрицательных энергий атома.
Связано-свободные переходы, переходы из дискретного спектра атома с отрицательными энергиями в непрерывный спектр в область положительных энергий.
Например: фотоионизация.

Свободно-связанные переходы, переходы из непрерывного спектра в дискретный.
Например: рекомбинация.

Экспериментальное подтверждение постулатов Бора (опыт Франка и Герца).
Опыт Франка-Герца – 1914г.
Рассмотрим столкновения электронов с атомами. Возможны два вида ударов: упругие и неупругие.
При упругом ударе кинетическая энергия электрона и внутренняя энергия атома – неизменны.

При неупругом ударе энергии атома и электрона изменяются, причем возможны два вида неупругих ударов:
Первого
рода:

Второго
рода:

 –быстрый
электрон,
–быстрый
электрон,
 - атом в возбужденном состоянии.
- атом в возбужденном состоянии.
Опыт Франка и Герца.

В баллоне находятся пары ртути при низком давлении порядка 1мм. рт. ст.
Подогреваемый катод, в следствии термоэлектронной эмиссии, является источником электронов, которые ускоряются благодаря напряжению между катодом и сеткой.
Между сеткой и анодом приложено напряжение – задерживающий потенциал. Исследуя зависимость анодного тока от напряжения сетки-катода, Франк и Герц получили следующую ВАХ.

Рассмотрим уровни энергии атома.

 -
кинетическая
энергия электрона.
-
кинетическая
энергия электрона.
Если
 , то столкновение электрона с атомом
упругое, он не может привести атом в
возбужденное состояние и с ростом
напряжения сила тока растет, как только
кинетическая энергия электрона становится
достаточной для возбуждения атома,
происходят неупругие удары первого
рода и электрон, возбуждая атом, тратит
почти всю кинетическую энергию,
задерживается сеткой – соответственно
ток в цепи падет. При дальнейшем увеличении
напряжения электрон может успеть набрать
необходимую энергию. Ток в цепи не падает
до нуля по следующим причинам:
, то столкновение электрона с атомом
упругое, он не может привести атом в
возбужденное состояние и с ростом
напряжения сила тока растет, как только
кинетическая энергия электрона становится
достаточной для возбуждения атома,
происходят неупругие удары первого
рода и электрон, возбуждая атом, тратит
почти всю кинетическую энергию,
задерживается сеткой – соответственно
ток в цепи падет. При дальнейшем увеличении
напряжения электрон может успеть набрать
необходимую энергию. Ток в цепи не падает
до нуля по следующим причинам:
Даже при
 неупругий удар может не произойти.
неупругий удар может не произойти.Электроны вылетают с катода с различными скоростями.
Наличие упругих ударов, которые изменяют направление скорости электрона.
Напряжения
 - называются критическими потенциалами
возбуждения.
- называются критическими потенциалами
возбуждения.
Для
изменения
 необходимо понизить давление в трубке
так, чтобы электрон успевал набрать
энергию
необходимо понизить давление в трубке
так, чтобы электрон успевал набрать
энергию ,
не потеряв ее при этом в других соударениях.
,
не потеряв ее при этом в других соударениях.
Для ртути было установлено:
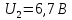
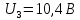
Т.о. опыт Франка-Герца экспериментально подтверждает постулаты Бора.
Следствие:
до тех пор, пока
 ,
атомы ртути находятся в основном
состоянии, как только
,
атомы ртути находятся в основном
состоянии, как только - в трубке наблюдается свечение.
- в трубке наблюдается свечение.

А
через время жизни
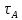 атома:
атома:

В
результате спонтанных процессов атом
переходит в основное состояние. В
эксперименте наблюдается спектральная
линия ртути



Теория водородоподобного атома по Бору. Изотопические эффекты.
Рассмотрим изоэлектронный ряд водорода:


Любой
элемент этого ряда – это водородоподобный
атом, имеет заряд ядра
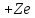 и один электрон.
и один электрон.
Рассмотрим движение электрона вокруг неподвижного ядра по круговой орбите.

 –орбитальный
механический момент импульса электрона.
–орбитальный
механический момент импульса электрона.

Бор предположил, что из всех механически возможных движений электрона вокруг ядра стационарными или возможными являются лишь те, для которых орбитальный механический момент – есть целое кратное от постоянной Планка.

 -
главное квантовое число, определяет
номер орбиты электрона.
-
главное квантовое число, определяет
номер орбиты электрона.
 -
правило квантования круговых орбит по
Бору.
-
правило квантования круговых орбит по
Бору.
Кулоновская сила удерживает электрон возле ядра.

Полная энергия электрона:

По второму закону Ньютона получаем:



 -
первый Боровский радиус. Согласно теории
Бора линейные размеры атома порядка
-
первый Боровский радиус. Согласно теории
Бора линейные размеры атома порядка



Рассмотрим атом водорода.
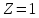





 -
энергия
ионизации водорода.
-
энергия
ионизации водорода.
В соответствии со вторым постулатом Бора получим остальные значения спектральных линий.


Обобщенная формула Бальмера:

Рассмотрим серию Лаймана атома водорода.

Рассмотрим
 и переходы на второй уровень.
и переходы на второй уровень.
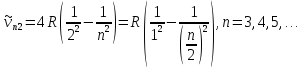
При
четных
 линии иона гелия
линии иона гелия должны совпадать с линиями серии Лаймона
водорода.
должны совпадать с линиями серии Лаймона
водорода.
Рассмотри
линию Пикеренга,


Линии
данной серии должны совпадать с линиями
серии Бальмера атома водорода при четных

|
He 2 |
6560 |
5412 |
4859 |
4562 |
4338 |
|
He 1 |
6563 |
- |
4861 |
- |
4340 |
Было
установлено, что между линиями данных
серий существует изотопическое смещение

Опытным путем было установлено, что отношения постоянных Ридберга водорода и гелия:

В теории Бора предполагалось, что электрон вращается вокруг неподвижного ядра, т.к.

На самом же деле ядро и электрон движутся совместно относительно общего центра масс.

 -
приведенная
масса атома.
-
приведенная
масса атома.


Таким
образом ион
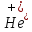 возможно рассматривать, как изотоп
водорода, т.к. он имеет схожее строение
и в связи с этим сдвиг спектральных
линий относят к изотопическим эффектам,
которые могут быть связаны либо с
разностью в массах ядер, что существенно
для легких элементов, либо с разностью
в размерах ядер, что существенно для
тяжелых элементов.
возможно рассматривать, как изотоп
водорода, т.к. он имеет схожее строение
и в связи с этим сдвиг спектральных
линий относят к изотопическим эффектам,
которые могут быть связаны либо с
разностью в массах ядер, что существенно
для легких элементов, либо с разностью
в размерах ядер, что существенно для
тяжелых элементов.
Изотоп – разновидность атома одного и того же химического элемента с разным количеством нейтронов в ядре. У водорода существует три устойчивых изотопа.
|
|
Np |
Nn |
m |
|
H |
1 |
- |
Mp |
|
D |
1 |
1 |
2mp |
|
T |
1 |
2 |
3mp |
Изотопические эффекты.
Рассмотрим
головные линии Водорода
 и Дейтерия
и Дейтерия серии Бальмера и соответствующие им
переходы
серии Бальмера и соответствующие им
переходы


Принцип соответствия. Кризис теории Бора.


Т.е. для больших квантовых чисел дискретность энергетических уровней практически не заметна, что соответствует сплошному спектру в расчетах классической ЭД.

В классической физике частоты ЭМВ могут быть представлены следующим образом:

 -
частота основного тона, а
-
частота основного тона, а
 - номер гармоники или обертона.
- номер гармоники или обертона.
Принцип
соответствия Бора: любому квантовому
переходу соответствует некоторая
частота, вычисленная по классической
теории, ее порядковый номер
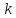 совпадает с изменением квантового числа
совпадает с изменением квантового числа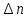
Данный
принцип был предложен в связи с тем, что
по теории Бора удалось определить
энергии
 стационарных уровней и частоты переходов
стационарных уровней и частоты переходов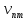 в водородоподобном атоме, но невозможно
рассчитать амплитуду или поляризацию
волны.
в водородоподобном атоме, но невозможно
рассчитать амплитуду или поляризацию
волны.
Однако привлечение принципа соответствия не могло описать строение более сложных атомов (даже атома гелия He) и мультиплетную структуру их спектров, это связано с главным недостатком теории Бора, ее внутренней противоречивостью.
Теория Бора – ни последовательно квантовая, ни последовательно классическая.
Пример:
на ряду с правилом квантования момента
импульса
 применяется классический второй закон
Ньютона.
применяется классический второй закон
Ньютона.
Квантовые свойства света.
Законы фотоэффекта (д/з)
Внешний фотоэффект.
- явление вырывания электрона с поверхности металлов под действием видимого и ультрафиолетового света.
Основные закономерности внешнего фотоэффекта:
-
наличие красной границы, если
 - фотоэффект прекращается.
- фотоэффект прекращается.
-
кинетическая энергия фотоэлектронов
пропорциональна частоте падающего
излучения

-
при
 количество фотоэлектронов пропорционально
интенсивности света
количество фотоэлектронов пропорционально
интенсивности света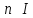
- фотоэффект практически безинерционен.
Уравнение Энштейна для внешнего фотоэффекта:
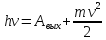
Энштейн предположил, что свет можно представить, как поток частиц, квантов света, названных фотонами, с энергией:

Экспериментальное подтверждение корпускулярной природы света состоит в существовании коротковолновой границы тормозного рентгеновского излучения.
Тормозное рентгеновское излучение (РИ)
РИ – ЭМВ с длинами волн:

 -
мягкий Рентген
-
мягкий Рентген
 –жесткий
Рентген
–жесткий
Рентген
Устройство Рентгеновской трубки.

Анод изготавливается из тяжелых металлов.
В
следствии термоэлектронной эмиссии
электроны, вылетая из катода и ускоренные
разностью потенциалов
 врезаются в анод. В зависимости от
приложенного напряжения, возможно два
вида возникающего при этом рентгеновского
излучения.
врезаются в анод. В зависимости от
приложенного напряжения, возможно два
вида возникающего при этом рентгеновского
излучения.
 (
( зависит от материала анода) – возникает
тормозное рентгеновское излучение,
имеющее сплошной или белый спектр, в
этом случае электроны попадая в материал
анода – тормозятся электростатическим
полем ядер вещества и двигаясь с
ускорением согласно классической ЭД
становятся источниками ЭМВ рентгеновского
диапазона.
зависит от материала анода) – возникает
тормозное рентгеновское излучение,
имеющее сплошной или белый спектр, в
этом случае электроны попадая в материал
анода – тормозятся электростатическим
полем ядер вещества и двигаясь с
ускорением согласно классической ЭД
становятся источниками ЭМВ рентгеновского
диапазона.

При одном и том же напряжении меньше порогового данный спектр одинаков для любого материала анода.
 возникает
характерный рентгеновский спектр, вид
которого зависит от материала.
возникает
характерный рентгеновский спектр, вид
которого зависит от материала.

Характеристическое РИ – следствие переходов электронов во внутренних оболочках атома вещества анода.








Существование коротковолновой границы тормозного рентгеновского излучения вытекает из корпускулярной теории света, на этом явлении основан наиболее точный экспериментальный метод определения постоянной Планка.
