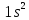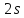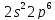- •§1.Общая характеристика атомов.
- •§2.Законы теплового излучения.
- •§3.Испускание и поглощение излучения по квантовой теории. Вывод формулы Планка по Энштейну., 1916г.
- •§5. Ядерная модель атома. Формула резерфорда.
- •§14. Дифракция рентгеновских лучей (рл) на кристаллической решетке.
- •§15. Формула Вульфа-Брегга.
- •§16. Экспериментальное наблюдение дифракции
- •§17. Корпускулярно волновой дуализм.
- •§18. Эффект Комптона.
- •§19. Волновые свойства частиц.
- •§20. Экспериментальное подтверждение гипотезы де Бройля.
- •§21. Статистическая интерпретация волн де Бройля.
- •§22. Соотношение неопределенностей Гейзенберга 1927г.
- •§23. Постулаты квантовой физики.
- •§24. Принцип суперпозиции квантовых состояний.
- •§25. Примеры движения квантовой частицы в стационарных
- •§26. Момент импульса квантовой теории.
- •§27. Гипотеза Уленбека (Юленбека) и Гаудсмита о спине электрона.
- •§28. Спектр атома водорода.
- •§29. Щелочные металлы.
- •§36. Эффект Зеемана.
- •§37. Неразличимость тождественных квантовых частиц.
- •§ 38. Периодическая система элементов (псэ)
§ 38. Периодическая система элементов (псэ)
ПСЭ, которая должна быть:
|
|
0 S |
1 p |
2 d |
3 f |
4 g |
|
|
1K |
2 |
- |
- |
- |
- |
2 |
|
2L |
2 |
6 |
- |
- |
- |
8 |
|
3M |
2 |
6 |
10 |
- |
- |
18 |
|
4N |
2 |
6 |
10 |
14 |
- |
32 |
|
5O |
2 |
6 |
10 |
14 |
18 |
50 |
Говорят,
что
 слой состоит из двух оболочек:
слой состоит из двух оболочек:


Докажем, что в замкнутой оболочке атома электроны имеют нулевые результирующие моменты импульсов. Будем следовать принципам Паули методом индукции.
Рассмотрим
 - оболочку
- оболочку


Рассмотрим замкнутую
 - оболочку
- оболочку
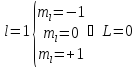


Элементы
в ПСЭ расположены по возрастанию
зарядового числа
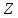 ,
определяющего количество электронов
в атоме. Все физико – химические свойства
атомов определяются числом и расположением
внешних валентных электронов.
,
определяющего количество электронов
в атоме. Все физико – химические свойства
атомов определяются числом и расположением
внешних валентных электронов.
Любой период или строка ПСЭ начинается с заполнения электронами нового слоя, поэтому периодичность застройки электронных оболочек ведет к периодичности свойств атомов.
В идеальной ПСЭ периоды должны содержать элементы со следующим количеством электронов:
|
|
В идеальной ПСЭ |
В реальной ПСЭ |
|
1 |
2 |
2 |
|
2 |
8 |
8 |
|
3 |
18 |
18 |
|
4 |
32 |
18 |
|
5 |
50 |
32 |
Построение реальной ПСЭ отличается от идеальной в связи с невозможностью пренебрежения взаимодействием между электронами и, как следствие, отклонением поля, в котором они движутся, от Кулоновского. Учет взаимодействия электронов позволяет полностью объяснить построение ПСЭ.
Основные принципы, которыми определяется порядок заполнения различных состояний:
Принцип Паули.
Принцип минимума энергии.
Каждый вновь присоединившийся электрон связывается в состояние с наименьшими допустимыми принципом Паули квантовыми числами т.о., чтобы энергия СС была минимальна.
Существует импирическое правило Хунда (Гунда):
Если электронная оболочка заполнена меньше, чем на половину, то каждый вновь присоединенный электрон связывается так, чтобы результирующий механический момент оболочки был максимальным.
В
начале ПСЭ, когда число электронов в
атомах не велико, заполнение электронных
состояний происходит без особенностей
( и
и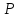 заполняются регулярно). Начиная с
четвертого периода, сначала заполняются
заполняются регулярно). Начиная с
четвертого периода, сначала заполняются – состояния, затем
– состояния, затем ,
т.к., в соответствии с принципом минимума
энергии, более выгодным оказывается
присоединить электрон с большим
,
т.к., в соответствии с принципом минимума
энергии, более выгодным оказывается
присоединить электрон с большим и меньшим
и меньшим ,
чем наоборот.
,
чем наоборот.
|
Z |
элемент |
K |
L |
M |
N |
термы | ||||
|
1s |
2s |
2p |
3s |
3p |
3d |
4s |
4p | |||
|
1 |
H |
1 |
_ |
_ |
_ |
_ |
_ |
_ |
_ |
|
|
2 |
He |
2 |
_ |
_ |
_ |
_ |
_ |
_ |
_ |
|
|
3 |
Li |
2 |
1 |
_ |
_ |
_ |
_ |
_ |
_ |
|
|
4 |
Be |
2 |
2 |
_ |
_ |
_ |
_ |
_ |
_ |
|
|
5 |
B |
2 |
2 |
1 |
_ |
_ |
_ |
_ |
_ |
|
|
_ |
|
|
|
|
|
|
|
|
|
|
|
10 |
Ne |
2 |
2 |
6 |
_ |
_ |
_ |
_ |
_ |
|
|
11 |
Na |
2 |
2 |
6 |
1 |
_ |
_ |
_ |
_ |
|
|
_ |
|
|
|
|
|
|
|
|
|
|
|
18 |
Ar |
2 |
2 |
6 |
2 |
6 |
_ |
_ |
_ |
|
|
19 |
K |
2 |
2 |
6 |
2 |
6 |
_ |
1 |
_ |
|
|
20 |
Ca |
2 |
2 |
6 |
2 |
6 |
_ |
2 |
_ |
|
|
21 |
Sc |
2 |
2 |
6 |
2 |
6 |
1 |
2 |
_ |
|
Отдельно
за ПСЭ вынесли лантаноиды (редкоземельные)
и актиноиды. У этих элементов происходит
застройка внутренних
 и
и состояний, а т.к. количество валентных
электронов на внешних
состояний, а т.к. количество валентных
электронов на внешних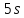 и
и оболочках у них одинаково, то все их
свойства идентичны и их, фактически,
можно поместить в одну клетку ПСЭ.
оболочках у них одинаково, то все их
свойства идентичны и их, фактически,
можно поместить в одну клетку ПСЭ.
В настоящее время в природе зарегистрировано 90 стабильных элементов, последний из них – уран. Элементы: технеций и прометий в природе в естественных условиях не встречаются, т.к. они радиоактивны и их период полураспада меньше возраста Земли.
Все трансурановые элементы радиоактивны, т.е. неустойчивы относительно спонтанного деления атомных ядер. Это связано с тем, что для данных элементов кулоновское отталкивание между протонами играет большую роль, чем силы ядерного притяжения между нуклонами.