
- •Производные п-аск, о-абк, м-абк, фенилуксусной и фенилпропионовой кислот Производные парааминосалициловой кислоты
- •Фп Натрия пара-аминосалицилат (паск-Nа) Natrii рага- aminosalicylas
- •Химические свойства
- •Подлиннность
- •Реакции подлинности
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Формы выпуска
- •Нфп Кислота мефенамовая (мефенаминовая)
- •Количественное определение
- •1.Алкалиметрия в ацетоне (растворитель), индикатор - тимоловый синий. Титруют NаОн от желтого до синего окрашивания
- •Производные арилалифатических кислот – фенилуксусной и фенилпропионовой
- •Diclofenac – Natrium (Ortophenum, Voltaren)
- •Описание
- •Растворимость
- •Реакции подлинности
- •Чистота
- •Количественное определение
- •Хранение
- •Применение
- •Ibuprofenum – Ибупрофен (Нурофен, Миг)
- •Описание
- •Чистота
- •Количественное определение
Diclofenac – Natrium (Ortophenum, Voltaren)
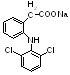
2-[(2,6-дихлорфенил)-амино]-фенилуксусной кислоты натриевая соль
Получение – синтез
исходные вещества – 2,6-дихлорацетанилид и бромбензол

конденсацией 2-хлорфенилуксусной кислоты с 2,6-дихлоранилином с последующей нейтрализацией образующейся кислоты рассчитанным количеством натрия гидроксида:

t° кат Cu+2
(толуол) кислота
- HCl
+ NaOH
- H2O



Описание
Белый или с кремоватым оттенком до светло-кремового цвета кристаллический порошок без запаха.
Растворимость
Мало растворим в воде, легко - в этаноле и ментоле, практически не растворим в хлороформе.
Подлинность
1. ИК -спектр, снятый в диске с калия бромидом, в области 4000-400 см-1 должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца.
2. УФ-спектр в области 240-350 нм в растворе 0,1М натрия гидроксида имеет максимум поглощения при 276±2 нм и минимум при 249±2 нм
Реакции подлинности
Реакция вытеснения органической кислоты сильной минеральной кислотой из ее соли и образование индолинона. При добавлении к водному раствору препарата разведенной соляной кислоты выпадает белый творожистый осадок 2-[(2,6-дихлорфенил)-амино]-фенилуксусной кислоты, которая частично превращается (циклизация) в производное индолинона:

Ион натрия доказывают по окрашиванию бесцветного пламени в желтый цвет.
Ионы хлора в фильтрате после восстановительной минерализации ковалентно связанного хлора (прокаливания в тигле и растворения остатка в воде) дают реакцию с раствором серебра нитрата.
Реакции окисления:
а) Реактив Марки при наслаивании на раствор препарата образует зелено-белое кольцо
б)
При
действии окислителей
(дихромата калия, перманганата калия,
йодата калия, натрия нитрита в среде
конц серной кислоты) образуются окрашенные
в различные цвета растворы. С
нитритом натрия (на фрагмент дифениламина)
– синее
[O]
- H2O
[O]
- H2O


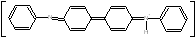
Дифенилбензидин-виолет синее окрашивание
HSO4-

в) При обработке кристаллов конц серной кислотой на часовом стекле, они приобретают малиновое окрашивание.
Реакции соле- и комплексообразования (по карбоксильной и амино- группе).
С нитратом серебра АgNО3 – белый осадок
С хлоридом железа (III) FеСl3 – жёлто-коричневый осадок
С сульфатом меди CuSО4 – светло-зеленый осадок
Чистота
Цветность определяют спектрофотометрическим методом. Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0,28.
Специфические примеси (продукты синтеза – наличие соответствующей кислоты и индолинона) определяют методом ВЭЖХ.
Подвижная фаза: метанол – 0,1% раствор ортофосфорной кислоты (6:4). Детектор – спектрофотометр (длина волны 254 нм).
Количественное определение
1.Ацидuметрический мeтод титрования в среде протогенного растворителя (неводное титрование). Титруют хлорной кислотой в среде ледяной уксусной кислоты (субстанция диклофенака-натрия). Точку эквивалентности устанавливают по ФС потенциометрически или по индикатору кристаллическому фиолетовому. f .экв. (диклофенана-натрия) = 1. Суммарно:

лед.CH3COOH
+ HClO4


+ NaClO4
Растворение (ошибка):
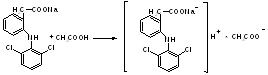
Титрант:

Титрование и регенерация растворителя:
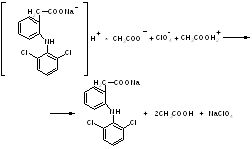
2. Спектрофотометрия в УФ-области спектра (лекарственные препараты: мази, таблетки). Метод основан на свойстве препарата поглощать свет в УФ-области спектра. Расчёт ведут по рабочему стандартному образцу (РСО).
Готовим 2 раствора:
Раствор №1 – исследуемое вещество (Сх);
раствор №2 – стандартный образец исследуемого вещества (Со);
На спектрофотометре измеряем соответственно Dx и Do. Из закона Бугера – Ламберта – Бера следует, что:
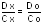 ;
;
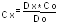 ;
;
с
учетом разведения:
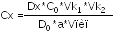 .
.
Где а – навеска сухого вещества в граммах, порошка растертых таблеток или объем раствора, взятый для анализа.
3. Метод ВЭЖХ для диклофенака-натрия (таблетки, растворы для инъекций). Количественное содержание рассчитывают по площади пика, которая пропорциональна количеству ЛВ в пробе.
4.Ацuдuметрическuй метод титрования в водной среде (вариант вытеснения) в присутствии эфира, который извлекает органическую кислоту и тем самым сдвигает равновесие реакции вправо
R–СООNа + НСl → R–COOH↓ + NaCl f экв. = 1
