
Неравновесные процессы в катализе
.pdf
ским коэффициентам, с которыми они входят в уравнение этой реакции (стадии). Поверхностную концентрацию обычно заменяют пропорциональной ей величиной – степенью заполнения поверхности данным реагентом. Во внешнекинетической области на стадиях адсорбции и десорбции достигается равновесие, и долю занятой веществом однородной поверхности можно найти из изотермы Лэнгмюра. Получаемые при этом уравнения называют кинетикой Лэнгмюра – Хиншельвуда.
Рассмотрим одностороннюю элементарную гетерогенно-ката- литическую мономолекулярную реакцию, когда реагенты находятся в газовой фазе:
AS * k BS * ZS *,
где AS*, BS* и ZS* обозначает, что реагенты А, В, Z участвуют в поверхностной реакции на катализаторе, находясь в адсорбированном состояниинаактивныхцентрах; S* – активныйцентрнаповерхности катализатора. Если эта реакция протекает в кинетической области, то ее скорость лимитирует процесс и, согласно закону действующих поверхностей, υ = k А. Отсюда скорость реакции
|
|
|
kbA pA |
|
|
, |
1 b p |
A |
b p b p |
|
|||
|
A |
B B |
Z |
Z |
||
где рА, рВ, рZ – парциальные давления реагентов в потоке газа. В разных частных случаях это уравнение упрощается.
1. При заполнении поверхности всеми реагентами (область Генри) можно пренебречь в знаменателе слагаемыми bAрА, bBрВ, bZрZ, получим
υ = kbAрА.
2. В начальном периоде протекания реакции или при слабой адсорбции продуктов реакции можно пренебречь в знаменателе слагаемыми bBрВ и bZрZ и уравнение принимает вид
kb p
A A .
1bA pA
3.Для мономолекулярных реакций основного органического
синтеза более типичен случай, когда, ввиду большой основности или ненасыщенности, один из продуктов реакции (например, вода, олефин и т. д.) адсорбируется на катализаторе сильнее, чем другие ве-
31
щества. ТогдавзнаменателеможнопренебречьслагаемымиbAрА иbZрZ или 1 + bAрА + bZрZ по сравнению сbBрВ, и уравнение принимает вид
|
kbA pA |
или |
|
kbA pA |
. |
|
|||||
1 b p |
|
||||
|
|
|
b p |
||
|
B B |
|
|
B B |
|
Этот случай характеризуется торможением процесса образующимися продуктами.
Адсорбционная и промежуточная области гетерогенного катализа
Пусть адсорбция – десорбция реагентов протекают достаточно медленно. При этом адсорбционное равновесие не успевает установитьсяинужноприниматьвовниманиекинетикуадсорбцииидесорбции компонентов. В общем случае для мономолекулярной реакции AS * BS * на поверхности катализатораучитывают три стадии:
|
ka, A |
|
k |
|
kĆ,b |
|
|
* |
→ |
* * |
→ |
* * |
→ |
* |
, |
|
1 |
|
|||||
A + S |
← AS ; AS |
← BS ; BS |
← B + S |
||||
|
kĆ,` |
|
k#1 |
|
kĆ,b |
|
|
где S* – активный центр на поверхности катализатора.
Если скорости стадии адсорбции – десорбции некоторых реагентов сравнимы со скоростью собственно химической реакции на поверхности зерна катализатора, то гетерогенно-каталитический процесспротекаетвпромежуточнойобласти(междувнешнекинетической и адсорбционной). В приведенной реакции скорость адсорбции – десорбции реагента А сравнима со скоростью самой химической реакции A B, а в стадии десорбции – адсорбции продукта В успевает установиться практически равновесное состояние. ТогдаА и В в выражении скорости реакции υ = k1 А – k–1 В при стационарном режиме реакции определяют, приравнивая скорости адсорбции – десорбции вещества А и скорости химической реакции
kа,А рА 0 – kд,А А = k1 А – k–1 В,
где 0 – доля свободной поверхности.
Из условия равновесности стадии адсорбции – десорбции продукта В получаем
В = bB рВ 0
и баланс по активным центрам дает
1 = А + В + 0.
Из этих уравнений находим А = 1 – (bB рВ + 1) 0, где
32

Θ0 = |
|
kĆ,` + k1 |
|
. |
|||
ka,` pA |
+ k-1 pB bB |
+ ( pB bB + 1)(kĆ,` + k1 ) |
|||||
|
|
|
|||||
Подставляя значения А и В |
в уравнение скорости реакции, по- |
||||||
лучаем искомое кинетическое уравнение |
|
|
|||||
υ = |
|
|
ka,`k1 pA |
− kĆ,`k−1 pB bB |
. |
||
kĆ, ` + k1 |
+ ka,` pA |
+ (kĆ,` + k1 + k−1 ) pBbB |
|||||
|
|
|
|||||
Аналогично можно получить выражение для скорости реакции, |
|||||||
когда адсорбция – десорбция продукта В сравнима со скоростью реакции, а адсорбция – десорбция исходного вещества А происходит быстро и в этой стадии устанавливается равновесие.
Рассмотримдвапредельныхслучая. Впервомпредельномслучае скорость процесса лимитируется химической реакцией, слагаемыми k1 и k–1 в знаменателе можно пренебречь как сравнительно малыми величинами. Последелениячислителяизнаменателянаkд,А изамены ka, `  kĆ, ` = bA найдем выражение для скорости процесса, совпадающее с уравнением, полученным для внешнекинетической области.
kĆ, ` = bA найдем выражение для скорости процесса, совпадающее с уравнением, полученным для внешнекинетической области.
Во втором предельном случае, когда скорость процесса лимитируется адсорбцией – десорбцией реагента А, можно пренебречь слагаемыми в числителе, которые содержат множители kа,А и kд,А, как сравнительно малыми величинами. Умножим числитель и знаме-
натель на b` K k1 |
, вынесем kа,А за скобки в числителе и обозначим |
||
k 1 k1 1 K и kд,` |
ka,` 1 bA . При этом получим |
||
|
υ = |
ka,` (KpAbA + pBbB ) |
|
|
|
. |
|
|
KbA + (K + 1)bA pBbB |
||
Полученное выражение отвечает скорости процесса в адсорбционной области. В этой области работы катализатора наблюдаемая энергия активации близка к теплоте хемосорбции и превышает 80 кДж/моль, чтосоответствуетеезначениювкинетическойобласти катализа. С практической точки зрения адсорбционная и кинетическая области работы катализатора весьма близки друг к другу.
Внешнедиффузионная и промежуточная области гетерогенного катализа
При проведении гетерогенно-каталитического процесса самой медленной стадией, определяющей общую скорость, может оказать-
33
сястадияпереносавеществаизпотокаквнешнейповерхностизерна катализатора или стадия переноса продуктов от нее в поток. Работа катализатора в таких условиях соответствует внешнедиффузионной области. Рассмотрим мономолекулярную реакцию
AS * BS * .
Если эта реакция протекает во внешнедиффузионной области, то ее скорость лимитируется скоростью πм,п массопередачи вещества А из потока к поверхности катализатора. Эта скорость (на единицу внешней поверхности катализатора) при стационарных условиях протекания процесса пропорциональна разности концентраций вещества А в потоке сА,0 и вблизи поверхности сА,п:
υм,п = А(сА,0 – сА,п),
где А = DA/ A – коэффициент массопередачи; DA – коэффициент диффузии; A – толщина эффективного диффузионного слоя. Если скорость реакции не является лимитирующим фактором, то реакция протекает достаточно быстро и, следовательно, концентрация А у поверхности практически равна нулю. При этом уравнение принимает вид (сА,п = 0)
Когда взаимодействуют два реагента, подводящиеся из потока к поверхности зерна, полученное уравнение обычно остается верным, так как массопередача лимитируется подводом одного из них, имеющего наименьший коэффициент диффузии или содержащегося в потоке в меньшей концентрации. Следовательно, во внешнекинетической области порядок реакции остается первым, независимо от порядка поверхностной химической реакции по этому веществу.
Рассмотрим макрокинетические закономерности работы катализатора в промежуточной области между внешнедиффузионной и внешнекинетической. Для конкретности рассмотрим поверхностную химическую реакцию AS * BS * . Уравнение скорости процесса может быть получено, исходя из непрерывности потока в стационарных условиях: на поверхности катализатора может прореагировать только то количество вещества, которое будет подведено к ней путем массопередачи. Скорость массопередачи υм,п должна быть равна скорости реакции υ = k А. При этом cА,п ≠ 0, так как константа
34
реакции сравнима по порядку величины с коэффициентом массопередачи. Отсюда
υм,п = υх,р и А = (сА,0 – сА,п) = k А.
Если реакция протекает в области небольших заполнений поверхности (область Генри), то концентрация сА,п реагента А вблизи поверхности и степень заполнения поверхности А веществом А пропорциональны друг другу: А = bAсА,п (bA – коэффициент адсорбции вещества А). При этом считаем, что на поверхности устанавливается адсорбционное равновесие для всех реагентов. С учетом последнего соотношения получим:
А(сА,0 – сА,п) = k bAсА,0 и cA,C = |
|
β` |
|
|
|
. |
||||||||||
β` |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
+ bAk |
|||||||
Подставляя значение сА,п в уравнение скорости химической ре- |
||||||||||||||||
акции, получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
υ = kΘA = bAkcA,C = |
β`bA k |
, |
|
|
|
|||||||||||
β` |
+ bAk |
|
|
|
||||||||||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
υ = kэффсА,0, |
|
|
|
|
|
|
|
|
||||||
где |
|
|
|
|
|
|
|
|
|
|
||||||
|
`bAk |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
k.-- |
|
и |
|
1 |
|
|
1 |
|
|
|
1 |
. |
||||
|
|
b k |
k |
|
|
|
|
|
||||||||
|
` |
|
.-- |
|
|
b k |
|
|
A |
|||||||
|
|
A |
|
|
|
|
A |
|
|
|
|
|||||
Если реакция протекает в области средних заполнений поверхности, то поверхностную концентрацию реагента А (степень заполнения А) нужно рассчитывать по полному уравнению изотермы Лэнгмюра:
ΘA |
= |
|
bAcA,C |
. |
|
+ bAcA,C + bB cB,C |
|||
|
1 |
|
||
Рассмотрим два предельных случая.
1.Если A bAk , то A bAk bAk . Получим kэфф = А; υ = АсА,0. Реакция протекает во внешнедиффузионной области.
2.Если A bAk, то A bAk A . Получимkэфф = kbA; υ= kbAсА,0. Реакция протекает во внешнекинетической области.
Если оба коэффициента А и kbA имеют одинаковый порядок величины, тонужнопользоватьсяобщимуравнением. Обестадиивлияют на скорость процесса. Лимитирующей стадии нет. Катализатор
35
работает при этом в промежуточной области (между внешнекинетической и внешнедиффузионной).
Рассмотрим влияние скорости потока и температуры на скорость гетерогенного катализа. Скорость потока через слой катализатора не влияет на скорость процесса на поверхности катализатора, если он работает во внешнекинетической области, так как процесс в этой области лимитируется кинетическими факторами, а не скоростью диффузии. Если же процесс протекает во внешнедиффузионной (или промежуточной) области, то с увеличением скорости потока скорость процесса возрастает, так как доставка вещества конвективной диффузией к поверхности катализатора при этом ускоряется. При увеличении скорости потока процесс из внешнедиффузионной может перейти в смешанную и внутрикинетическую области.
Скорость реакции во внешнекинетической области растет с температурой по экспоненциальному закону. Но коэффициент массопередачи зависит от температуры гораздо слабее, чем константа скорости реакции. Поэтому с ростом температуры k увеличивается быстрее, чем А, и при k > А процесс из внутрикинетической перейдет в промежуточную, а при достаточно высокой температуре (k A ) и во внешнедиффузионную область. С дальнейшим увеличением температуры скорость процесса растет медленнее. Если катализатор работает во внешнедиффузионной, промежуточной или внешнекинетической области, то пористость зерна катализатора не имеет значения. Имеет значение только величина внешней поверхности катализатора. Поэтому при работе катализатора в этой области используют непористые материалы, например изготавливают катализатор в виде сетки из непористого материала.
Внутридиффузионная и внутрикинетическая области гетерогенного катализа
При постепенном переходе от внешнедиффузионной к внешнекинетической области поверхностные концентрации исходных веществ увеличиваются, что приводит к их диффузии через устья порквнутреннейповерхностизеренкатализатора. Поэтомувнешнекинетической области работы катализатора в чистом виде не существует, так как на нее накладывается реакция, протекающая в при-
36
поверхностной части пор зерен. Во внутридиффузионной кинетике предполагается, что на внешней поверхности катализатора устанавливается внешнекинетическая область катализа, поэтому концентрации исходных веществ в устье пор равны их концентрациям в объеме. Под влиянием разности концентраций в устье и внутри пор исходные вещества проникают в поры и участвуют в гетерогеннокаталитической реакции, а продукты диффундируют в противоположном направлении и выходят из пор зерна в объем.
Массоперенос внутри узких каналов (пор) имеет ряд особенностей по сравнению с молекулярной диффузией в объеме. Закономерности диффузии вещества внутри узких каналов зависят, в частности, от соотношения между длиной свободного пробега молекул и диаметром поры d. В очень узких порах, когда > d, велика вероятность столкновения молекулы со стенкой поры; при этом коэффициент диффузии пропорционален диаметру поры (так называемое кнудсеновское течение). В более широких порах при < d перенос вещества описывается законами Фика для молекулярной диффузии
вобъеме; при этом коэффициент диффузии пропорционален длине свободного пробега молекул . Кроме того, при протекании реакции внутри пор нужно учитывать перенос вещества под действием разности давлений снаружи и внутри поры. Перепад давлений может быть следствием изменения числа молей вещества при реакции или перегрева (переохлаждения) внутри зерна катализатора. При этом создается дополнительный поток вещества внутри поры.
Массоперенос, связанный с протеканием химической реакции, мы рассмотрим на основе псевдогомогенной модели зерна, предложенной Я.Б. Зельдовичем. В этой теории модель зерна рассматривается как некоторая сплошная неподвижная среда. Математический анализ сводится к рассмотрению реакции в неподвижной жидкости,
вкоторую с поверхности диффундируют исходные вещества, а продукты реакции диффундируют навстречу к поверхности. При этом для упрощения вывода математических соотношений полагают, что диффузия в псевдогомогенной модели зерна линейная; адсорбцию на поверхности катализатора не учитывают. Несмотря на то, что псевдогомогенная модель зерна является очень упрощенной моделью реально пористого зерна катализатора, она правильно описы-
37
вает характер основных закономерностей протекания гетерогеннокаталитических процессов в зерне и верно предсказывает влияние на процесс различных факторов. Рассмотрим элементарную мономолекулярную одностороннюю реакцию
А → Продукты.
Процесс считаем стационарным. Адсорбцию – десорбцию для упрощения не учитываем. При стационарной линейной диффузии второе уравнение Фика с учетом протекания химической реакции в потоке в порах внутри зерна имеет вид
Dƒ 2lc2A A 0,
где первое слагаемое – это изменение количества вещества А за счет диффузии, а второе – изменение за счет протекания реакции (отнесенное к единице объема внутри зерна); υА – скорость образования вещества А. В нашем случае вещество А расходуется, поэтому ско-
рость образования отрицательна: υА = – k c |
. Отсюда |
||||||
|
|
2c |
|
|
|
з A |
|
D |
|
A |
k c |
|
0, |
|
|
ƒ |
|
A |
|
||||
|
l 2 |
3 |
|
|
|||
где Dз – эффективный коэффициент диффузии вещества А в поре зерна; kз – эффективная константа скорости реакции. Эти эффективные величины пропорциональны истинным и могут быть оценены расчетным путем и найдены из опыта. Они формально учитывают отличие моделиот реального зерна, а также особенностимассопереноса в порах, о которых говорилось выше.
Решаяэтодифференциальноеуравнение, получаемзависимость концентрации сА исходного вещества от расстояния l в интервале от устья поры (l = 0) до ее центра:
|
|
|
c |
ed L |
|
c edƒ L |
e l L , |
||
c |
|
C |
|
|
C |
||||
A |
1 edƒ L |
1 |
edƒ L |
||||||
|
|
|
|
||||||
где
L Dƒ 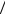 kƒ .
kƒ .
L – параметр, который зависит как от эффективного коэффициента диффузии, так и от эффективной константы скорости химической реакции внутри поры.
38

Особенности поведения катализатора во внутридиффузионной области
1. Скоростьпроцессаконтролируетсянетолькодиффузией, нои кинетикой химической реакции. Найдем скорость процесса во внутридиффузионной области. Очевидно, внутри зерна прореагирует столько вещества, сколько его продиффундирует через наружную поверхностьзерна; всевеществоприработекатализаторавовнутридиффузионной области успевает прореагировать. А это количество определяется первым законом Фика, который при линейной диффу-
зии имеет вид |
dc |
|
|
|
||
|
A |
|
||||
ƒ |
sƒ Dƒ |
|
|
, |
||
dl |
||||||
|
|
l 0 |
|
|||
где sз – внешняя поверхность зерна. Уравнение для cA упрощается для внутридиффузионной области, учитывая, что для этой области L сравнительно мало. Первое слагаемое можно отбросить, так как
множитель 1 1 e |
dƒ |
L |
|
мал. Во втором слагаемом можно пренебречь |
||||||||
|
|
|
|
edƒ L |
, тогда e |
|
|
|
|
|
1 . После этих |
|
единицей по сравнению с |
dƒ L |
1 e |
dƒ |
L |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
упрощений получим c |
= с e l L. После нахождения производной вы- |
|||||||||||
|
|
|
A |
|
п |
|
|
|
|
|
|
|
ражение для скорости массопереноса через поверхность зерна при- |
||||||||||||
мет вид ƒ sƒ DƒcC |
L. Учитывая, что L |
Dƒ kƒ , получим для ско- |
||||||||||
ростипроцессаназерневовнутридиффузионнойобластивыражение
sƒ kƒ Dƒ cn ,
а после отнесения к единице объема катализатора (если зерно имеет сферическую форму)
6 dƒ kƒ Dƒ cC .
dƒ kƒ Dƒ cC .
Как видно из уравнения, скорость процесса во внутридиффузионной области пропорциональна параметру kƒ Dƒ , который зависит какот скорости диффузии (Dз), так и от скорости реакции (kз). Таким образом, вовнутридиффузионнойобласти, вотличиеотвнешнедиффузионной, нет лимитирующей стадии.
2. В работе катализатора участвует не вся внутренняя поверхность пор в зерне; средняя часть зерна не работает, так как реакция успевает закончиться раньше. Кроме того, чем меньше вещества А, тем тоньше работающий слой зерна. В пределе при достаточно малых значениях параметра L реакция успевает практически закон-
39
читься на поверхности зерна и процесс переходит во внешнекинетическую область.
3.Из уравнения 6 dƒ kƒ Dƒ cC видно, что чем меньше диаметр dз зерна, тем больше скорость процесса на единицу объема катализатора. Поэтому при работе катализатора в этой области макроскопической кинетики целесообразно использовать более мелкие зерна катализатора.
dƒ kƒ Dƒ cC видно, что чем меньше диаметр dз зерна, тем больше скорость процесса на единицу объема катализатора. Поэтому при работе катализатора в этой области макроскопической кинетики целесообразно использовать более мелкие зерна катализатора.
4.В соответствии с уравнением Аррениуса зависимость кон-
станты скорости kз от температуры имеет вид kƒ Ae E RT , где Е – истинная энергия активации процесса. Но, согласно полученному уравнению, скоростьпроцессаврассматриваемомслучаепропорци-
RT , где Е – истинная энергия активации процесса. Но, согласно полученному уравнению, скоростьпроцессаврассматриваемомслучаепропорци-
ональна kƒ (если мы пренебрежем более слабой зависимостью Dз от температуры), т. е.
E 2 .
2 .
kƒ Ae RT
Таким образом, во внутридиффузионной области работы катализатора кажущаяся (наблюдаемая) энергия активации равна половине истинной.
5. Для внешнедиффузионной области характерно сильное влияние теплопередачи, имеющей тот же диффузионный механизм и почти такую же скорость, как массопередача. Вследствие этого при быстрой химической реакции (что всегда имеет место во внутридиффузионной области) теплота не успевает отводиться из зерна в объем потока и поверхность катализатора при экзотермических или эндотермических реакциях имеет соответственно более высокую или низкую температуру, чем поток реакционной массы. Для экзотермическихреакцийэтоможетприводитькперегревукатализатора и снижению активности. В меньшей мере эти же недостатки присущи внешнедиффузионой области.
Влияние размера пор в псевдогомогенной модели зерна на скорость процесса в данном курсе не затрагивается. Рассмотрение другой, более сложной модели процесса, например модели цилиндрической поры, показывает, что при одинаковом удельном размере пор и радиусе зерна влияние среднего радиуса пор на эффективную константу скорости во внутридиффузионной области различно. При достаточно широких порах, где протекает молекулярная диффузия,
40
