
Неравновесные процессы в катализе
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ОСНОВНЫЕ ПОНЯТИЯ И МЕХАНИЗМЫ КАТАЛИТИЧЕСКИХ
И СОПРЯЖЕННЫХ РЕАКЦИЙ. НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ В КАТАЛИЗЕ
(Классические системы)
Учебное пособие для вузов
Составители: И.Я. Миттова, А.А. Самсонов, Б.В. Сладкопевцев
Издательско-полиграфический центр Воронежского государственного университета
2012
Утверждено научно-методическим советом химического факультета 16 июня 2011 г., протокол № 6
Рецензент д-р хим. наук, проф. В.Н. Семенов
Учебное пособие подготовлено на кафедре материаловедения и индустрии наносистем химического факультета Воронежского государственного университета.
Рекомендуется для магистрантов химического факультета первого года обучения.
Для направлений: 020300 – Химия, физика и механика материалов; 020100 – Химия
СОДЕРЖАНИЕ |
|
1. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ И МЕХАНИЗМЫ КАТАЛИЗА......... |
4 |
1.1. Кислотно-основный катализ............................................................. |
12 |
1.2. Окислительно-восстановительный катализ.................................... |
16 |
1.3. Автокатализ и ингибирование.......................................................... |
19 |
2. ГЕТЕРОГЕННЫЙ КАТАЛИЗ.................................................................... |
21 |
2.1. Активация в гетерогенных каталитических реакциях. |
|
Применение метода переходного состояния в гетерогенном |
|
катализе ..................................................................................................... |
23 |
2.2. Кинетика гетерогенно-каталитических реакций |
|
на равнодоступной поверхности............................................................. |
27 |
2.3. Макрокинетика гетерогенного катализа.......................................... |
28 |
3. КИНЕТИКА КАТАЛИТИЧЕСКИХ РЕАКЦИЙ ...................................... |
41 |
4. КИНЕТИКА И МЕХАНИЗМ ЭЛЕМЕНТАРНЫХ АКТОВ |
|
НА ПОВЕРХНОСТИ...................................................................................... |
44 |
5. ИНДУКЦИЯ И КАТАЛИЗ ХИМИЧЕСКИХ РЕАКЦИЙ. |
|
СОПРЯЖЕННЫЕ РЕАКЦИИ........................................................................ |
51 |
5.1. Взаимосвязанные реакции................................................................ |
54 |
5.2. Правила для определения механизма индуцированной реакции... |
63 |
5.3. Примеры применения сопряженных реакций. |
|
Проблема фиксации азота........................................................................ |
65 |
6. НЕКОТОРЫЕ АСПЕКТЫ НЕРАВНОВЕСНОГО КАТАЛИЗА.............. |
66 |
6.1. Энергетическая схема адсорбции с прекурсором........................... |
72 |
6.2. Хемоэнергетическое стимулирование............................................. |
74 |
6.3. Пучковые исследования.................................................................... |
79 |
6.4. Лазерные методы............................................................................... |
80 |
6.5. Струевые методы изучения дезактивации возбужденных |
|
молекул...................................................................................................... |
81 |
6.6. Диссипативные структуры в катализе............................................. |
84 |
6.7. Самоорганизация в физических явлениях...................................... |
86 |
6.8. Самоорганизация в химии................................................................ |
86 |
6.9. Устойчивость и неустойчивость. Критические состояния. |
|
Бифуркации............................................................................................... |
88 |
6.10. Примеры диссипативных структур в катализе............................. |
90 |
6.11. Фазовые превращения в катализе.................................................. |
92 |
ЛИТЕРАТУРА.................................................................................................. |
95 |
3

1. ОСНОВНЫЕ ПРЕДСТАВЛЕНИЯ И МЕХАНИЗМЫ КАТАЛИЗА
Рассмотрим сначала основные классические представления о катализе. Катализ – явление ускорения реакций в присутствии веществ – катализаторов, которые вступают в промежуточное взаимодействие с реагирующими веществами, но не входят в состав продуктов реакции.
Определение катализатора по Г.К. Борескову: катализатором называют вещество, изменяющее скорость химической реакции участием в образовании активированного комплекса одной или нескольких стадий химического превращения и не входящее в состав конечных продуктов.
Катализатор в данной реакции не входит в состав исходных веществ и продуктов и не влияет на G процесса ( G – функция состояния). Следовательно, он не может вызвать протекания реакции с G > 0. Поскольку G RT ln K p , то катализатор не влияет на Kp, одновременно ускоряя прямую и обратную реакции.
Различают гомогенный и гетерогенный катализ. При гомогенном катализе реагирующие вещества и катализатор находятся в одной фазе. При гетерогенном катализе катализатор находится в другой фазе и химическая реакция протекает на границе фаз.
|
Примеры каталитических реакций |
|
1. |
Гидролиз сложных эфиров |
|
|
|
C2H5OH, |
|
CH3COOC2H5 H2O CH3COOH |
|
где H3O или OH – катализатор. |
|
|
2. |
Гомогенное каталитическое гидрирование олефинов |
|
|
|
CH3 |
|
R CH CH2 H2 R CH2 |
|
вприсутствии комплексов переходных металлов.
3.Синтез аммиака
|
→ |
1 2 N2 + 3 2H2 |
P =30−100lo= |
← NH3 . |
|
|
T =700K |
Катализатор – пористое железо с добавкамиAl2O3 и К2О. Специфичностькатализа заключаетсявтом, чтореакциидан-
ного типа ускоряются катализаторами определенного состава неза-
4

висимооттого, гомогенныониилигетерогенны. Кислотно-основные реакции ускоряются кислотами или основаниями, а окислительно-вос- становительные– переходнымиметалламииихсоединениями(особенновысокаактивностьэлементовVIII Вгруппы). Специфичностьобусловлена особенностью химических связей, которые возникают между катализаторомиреагентом. Вобразованиисвязисреагентамиучаствуют определенные группы атомов катализатора. Такую группу атомов называют каталитическим или активным центром. В вышеприве-
деннойреакции1 активныйцентр– H3O ; в комплексных соединениях это может быть «вакантное место» в координационной сфере, а на поверхности твердого тела – группы атомов или ионов и т. д.
Активность катализатора
В общем случае любая классическая каталитическая реакция включает2 стадии: 1) взаимодействиеактивногоцентрасмолекулой реагента и образование промежуточного соединения; 2) его распад с образованием продуктов и регенерацией активного центра. Последний снова вступает во взаимодействие. Это цикл, который многократно повторяется. Число циклов, совершающихся за единицу времени на одном активном центре, называется числом оборотов катализатора. Мерой активности катализатора как раз и служит число его оборотов. Для гомогенно-каталитических реакций это
скорость реакции, деленная на молярную концентрацию катализатора: n* , где nк – число оборотов катализатора, с–1; υ – скорость
реакции,cмоль* /(с · м3); ск – концентрация катализатора, моль/м3.
Для гетерогенных реакций число оборотов – скорость реак-
ции, отнесенная к единице поверхности катализатора. Активность катализатора зависит от многих условий, в том числе и от растворителя, поэтому сравнение надо проводить в идентичных условиях.
Селективность – свойство катализатора ускорять химическое превращение лишь в одном из возможных направлений:
C2H5OH Al2O3, 700K C2H4 H2O – дегидратация;
C2H5OH ме2 Cu C2H4O H2 – дегидрирование.
Вэтихреакцияхизодногоитогожереагентавприсутствииразличных катализаторов получаются разные продукты.
5
Селективность может быть охарактеризована долей реагента, превратившегося в целевой продукт; это интегральная селективность. Онаберетсяпоотношениюктеоретическивозможной, когда образуется только данный продукт.
Дифференциальная селективность – отношение скорости об-
разования целевого продукта к сумме скоростей химического превращения реагентов по всем возможным направлениям. Повышение селективностипозволяетснизитьколичествопобочныхвеществ. Реально 100%-я селективность достигается у ферментов и некоторых гомогенных катализаторов.
Активность и селективность меняют путем воздействия на катализатор. Активность катализатора может увеличиваться при добавлении вещества, которое само не обладает каталитическими свойствами для данного процесса. Такие вещества называются промоторами, а само явление – промотированием. Разделяют структурнообразующие и модифицирующие промоторы. Структурнообразующие промоторы стабилизируют активную фазу катализатора, например по отношению к нагреванию или к каким-то другим воздействиям. По-видимому, роль промоторов сводится к увеличению срока жизни микрокристаллической фазы катализатора, неустойчивой термодинамически. Таково, например, промотирование оксидом алюминия железного катализатора синтеза аммиака. Модифицирование катализаторов заключается в том, что одни и те же добавки в зависимости от концентрации могут оказывать как отравляющее, так и промотирующее действие. Модифицирующие промоторы изменяют строение и химический состав активной фазы катализатора. Возможно, их роль сводится к синтезу на поверхности катализатора активных центров новой химической природы, поэтому при модифицировании иногда изменяется и селективность. Примером модифицирующегопромотированияслужитдобавлениеК2Окжелезному катализатору синтеза аммиака. Добавка К2О к катализатору, не промотированному Аl2O3, понижает каталитическую активность; к промотированному – дает четкий активирующий эффект.
Понижениеилиполноеподавлениеактивностикатализатораназывается его отравлением. Оно обусловлено присутствием в системе даже в ничтожных количествах некоторых веществ, называемых
6
каталитическими ядами. Механизм отравления состоит в блокировании ядом активных центров катализатора. Поскольку адсорбция может быть обратимой и необратимой, различают обратимое и необратимое отравление. Так, платиновый катализатор отравляется СО и СS2, однако при внесении его в чистую смесь газообразных исходных веществ происходит десорбция ядов и активность восстанавливается. При отравлении же Н2S и РН3 платина полностью дезактивируется. Известными каталитическими ядами как для гомогенных, так и для гетерогенных катализаторов являются соединения мышьяка, ртути, серы, фосфора. Некоторые вещества при низкой концентрации их в катализаторе могут проявлять промотирующее действие, а при высоких – отравляющее. В ферментативном катализедляобозначенияэтогоявленияприменяютсятермины«ингибирование» и «ингибитор» (см. ниже).
На современном уровне явления промотирования и отравления объясняются способностью некоторых веществ вступать в химическое взаимодействие с активным центром катализатора. При этом может произойти формирование новой, более активной структуры активного центра и повышение активности катализатора. Образование же устойчивых инертных соединений активного центра с молекулой каталитического яда ведет к дезактивации и отравлению катализатора.
Кинетика каталитических реакций
Несмотря на чрезвычайное многообразие каталитических реакций, большинство из них можно свести к двум схемам.
Схема 1
Пусть имеем реакциюR1 R2 P1 P2 .
Эту реакцию можно представить как совокупность следующих стадий:
1.R1 K P1 KX ;
2.KX R2 P2 K .
Вэтом случае катализатор является переносчиком атомных
групп, атомов или электронов от молекул R1 к R2.
Примером такого механизма является реакция окисления SO2 кислородом в присутствии NO:
7

O2 NO 2NO2 . 2SO2 2NO2 2SO3 2NO.
Это раздельный, или диссоциативный механизм катализа.
Схема 2
Согласно этой схеме вышеприведенная реакция может быть представлена в виде следующих стадий:
1.R1 R2 K P1KP2;
2.R1KR2 P1 P2 K .
Это слитный, или синхронный механизм. Здесь имеет место обратимое образование промежуточного соединения активного центра катализатора с молекулами обоих реагентов, которое затем распадается на продукт и «свободный» активный центр катализатора, а последний, в свою очередь, вступает в новый цикл превращений. Примером такого механизма является реакция гидрирования олефинов в присутствии комплексных соединений родия или иридия либо гидролиз простых эфиров в присутствии ферментов.
Рассмотрим мономолекулярную реакцию R → P, протекающую по механизму 2.
|
|
|
|
|
|
|
|
|
→ P + K, |
|
|
|
|
|
|
|
|
R K KR |
|||
|
dCR |
|
k C C |
k C |
, |
|
||||
|
|
|||||||||
|
dt |
|
|
|
1 R |
k |
1 KR |
|
|
|
|
|
|
|
|
|
|
|
|
||
dCKR |
k1CRCK |
k 1CKR k2CKR , V = const, закрытая система. |
||||||||
|
|
|
|
|
||||||
dt |
||||||||||
|
|
|
|
|
|
|||||
dC |
P |
k2CKR |
, |
|
|
|
||||
|
|
|
|
|
||||||
dt |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
Уравнение материального баланса по катализатору
CK0 CK CKR .
Для квазистационарного режима
dCKR / dt 0 k 1CRCK k 1CKR k2CKR 0.
С учетом материального баланса имеем
k C C 0 |
k C C |
k C |
KR |
k C |
KP |
0 (выражали C |
k |
). |
|
1 R K |
1 |
R KR |
1 |
2 |
|
|
|||
Отсюда CKR |
k C C 0 |
|
. |
|
|
|
|
||
1 |
R K |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
k1CR k 1 k2
8
Подставим это в первое или третье уравнение:
|
dCR |
|
dCP |
|
k1k2CR |
|
C 0 . |
||
|
|
|
|
|
|
||||
|
dt |
|
|
dt |
|
|
|
K |
|
|
|
|
k1CR k 1 k2 |
||||||
|
|
k1k2CR / k 1 k2 |
0 |
|
|||||
|
|
CK . |
|||||||
|
1 k1CR / k 1 k2 |
||||||||
Изданногорассмотренияможносделатьследующиезаключения:
1)скорость реакции пропорциональна концентрации катализатора Ck0 ;
2)рассмотренамономолекулярнаяреакция, ноеескоростьслож-
ным образом зависит от концентрации реагента (СR): при низкой концентрации
υ = |
k1k2 |
CRCK0 υ = k.-C R |
, k.- |
= |
|
k1k2 |
|
CK0 . Это 1-й порядок; |
|||||
k−1 + k2 |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
k−1 + k2 |
|||
при высоких концентрациях реагента υ = υmax= k2C0k; порядок по |
|||||||||||||
реагенту равен 0. |
|
|
|
|
|
|
|
|
|
|
|
||
Если k2 |
k1 , товпервойстадииустанавливаетсяравновесие, а |
||||||||||||
вторая – лимитирующая. Тогда |
|
|
|
|
|
||||||||
|
|
k |
|
|
k1 |
|
k C 0 |
Kk C 0 |
, |
|
|||
|
|
.- |
|
|
|
|
|||||||
|
|
|
|
|
|
|
2 k |
|
|
2 k |
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
|
|||
где К – константа равновесия первой стадии. И |
|||||||||||||
|
|
|
|
|
|
k2K1CR |
C 0 . |
|
|
||||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
1 K1CR |
k |
|
|
|||||
|
|
|
|
|
|
|
|
||||||
Из этого уравнения нельзя по отдельности определить констан-
тыскоростистадий, поэтомудляихопределенияиустановлениямеханизма процесса необходимы дополнительные физико-химические исследования.
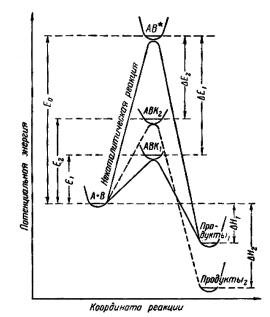
Если сравнить пути элементарной реакции по каталитическому и некаталитическому механизмам, то можно видеть, что разница в энергиях активации есть не что иное, как энтальпия образования активного комплекса, в состав которого входит катализатор, из активногокомплекса, состоящеготолькоизисходныхвеществ(рис. 1).
Таким образом, роль катализатора в рассмотренном выше случае (механизм 2) заключается в изменении (уменьшении) энергии активации процесса из-за того, что меняется характер активного
9
комплекса, он теперь имеет в своем составе катализатор и соответственно обладает уже иной энергией. Снижение же энергии активацииведеткувеличениюскоростиданнойэлементарнойреакцииили стадии сложной реакции.
Рис. 1. Кривые потенциальной энергии вдоль координаты реакции для некаталитического и гомогенно-каталитического процессов
Окислениетиосульфат-ионапероксидомводорода, катализируемое ионами I –, протекает по схеме:
H2O2 I H2O IO ,
IO I 2H I2 H2O,
I2 2S2O32 2I S4O62 .
Итоговое уравнение
H2O2 2H 2S2O32 2H2O S24 O6 .
Реакция проходит через стадии, энергия активации которых ниже, чем для процесса, отвечающего итоговому уравнению. Этот процесс отвечает механизму 1.
10
